高血压合并高脂血症大鼠模型的实验研究
赵胜楠,何黎黎*,李自强,王发展,宋相容,张 智,3*
(1.西南民族大学,成都 610041; 2.四川大学华西医院生物治疗国家重点实验室,成都 610041; 3.四川理工学院,四川 自贡 643000)
近年来,随着生活水平的不断提高和人口老龄化日益严重,心血管疾病的发病率呈上升趋势[1],高血压与血脂异常是目前公认的两大可控制的心血管疾病的重要危险因素[2-3]。截止2015年,我国高血压患者已达2.7亿,其中,约有63.7%患者存在着血脂异常的情况[4-5]。高血压合并高脂血症的危险系数极大,是导致动脉粥样硬化的主要因素,也是心血管病发生发展的危险因素;长期高血压合并血脂水平异常还可导致重要脏器如心、肾器官的损伤,最终导致这些靶器官的功能衰竭[6-7]。因此,建立一种经济便捷、稳定的高血压合并高脂血症大鼠模型,对于进一步研究高血压合并高脂血症的发病机制、筛选和评价相关治疗药物将具有重要意义[8]。
目前,高血压合并高脂血症大鼠模型主要包括基因相关模型(遗传、转基因和基因敲除)、化学药物诱导模型和高脂饮食诱导模型三大类。基因相关模型倾向于单基因增强或缺陷,弱化了环境因素,不能完全模仿高血压合并高脂血症患者的病理特点,因此通常仅用于病理机制研究[9]。化学药物诱导模型易使动物产生不耐受而出现死亡,呈现造模成功率低、模型不稳定、个体差异大等缺点[10]。高脂饮食诱导模型则因其较为稳定,能模拟人类不健康生活方式对疾病产生的影响,且其造模成本比基因相关模型低廉的原因,在药物筛选研究中应用广泛[11]。利用高脂饲料饲喂自发性高血压大鼠(SHR)构建的高血压合并高脂血症大鼠模型(HP/HL-SHR),最接近高血压合并高脂血症患者的病理特征,已成为研究高血压合并高脂血症的病理机制、筛选相关治疗药物的常用动物模型[12]。然而,现有文献报道的HP/HL-SHR造模方法各异、模型重现性差,评价指标不充分,如未对关键指标心、肾组织损伤程度进行考察,不利于直接引用参考。因此,本课题拟以高脂饲料饲喂SHR,构建高血压合并高脂血症大鼠模型,并对其心、肾功能进行系统评价,为相关治疗药物的评价提供药效学动物模型及相关方法的参考。
1 材料和方法
1.1 实验动物
SPF级雄性SHR大鼠20只,3周龄,体重(85±5)g。SPF级龄雄性WKY大鼠10只,3周龄,体重(85±5)g,均购自北京维通利华实验动物技术有限公司[SYXK(京)2013-14]。两种大鼠均饲养于SPF级动物房[SYXK(川)2011-178],3只一笼,自由饮水;光照周期为昼夜各12 h,饲养环境温度维持在20℃~24℃,相对湿度维持在50%~60%。实验动物饲养及实验处理均严格遵循四川大学生物治疗国家重点实验室实验动物福利与伦理委员会相关指南要求。
1.2 饲料
普通维持饲料配方为:玉米73.5%、麦麸20%、鱼粉5%、谷粉1%、食盐0.5%。
高脂饲料配方为:67 %维持饲料、2.5 %胆固醇、10 %猪油、20.0%蔗糖、0.5 %胆酸钠,由北京华阜康生物技术有限公司合成。
1.3 主要试剂与仪器
总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)检测试剂盒,均购自四川迈克生物科技股份有限公司。
微型冷冻离心机FRESCO 17(德国赛默飞公司),用于分离血清;7020全自动生化分析仪(日本日立公司),用于血脂测定;智能无创血压计-鼠仪BP-2010 A(北京软隆生物技术有限公司),用于血压测定;PHY-111病理组织漂烘仪(常州市中威电子仪器)、石蜡包埋机EG1150H(德国徕卡)、石蜡切片机RM2235(德国徕卡),用于心肾组织石蜡切片;正置显微镜BX41TF(Olympus),用于成像拍照。
1.4 实验方法
1.4.1 动物分组
SHR大鼠随机分为空白对照组(SHR-NC)和模型组(SHR-HF)两组,每组10只;WKY大鼠10只作为对照组(WKY-NC)。
大鼠饲养方式为:每日定时、定量放置饲料以及饮水。3组大鼠均先采用普通维持饲料适应性喂养1周后,再行分组饲养。SHR-NC和WKY-NC组饲喂普通维持饲料,SHR-HF组饲喂高脂饲料。
1.4.2 实验步骤
造模实验开始前,称量大鼠的基础体重后将大鼠置于智能无创血压仪的保温筒内,待大鼠稳定后,自动测定三次血压(收缩压SBP)及心率。大鼠禁食16 h(正常饮水)后,取血测定基础血脂指标,具体方法为:乙醚麻醉大鼠后,眼眶取血,离心分离血清,测定基础血脂水平,具体包括:HDL-C、LDL-C、TC、TG。

表1 造模23周后三组雄性大鼠血浆中血脂的变化(mg/dL,n=10)
注:与SHR-NC组相比,*P< 0.05,**P< 0.01。
Note.Compared with the SHR-NC group,*P< 0.05,**P< 0.01.
造模实验期间每周同一时间监测体重和血压,具体操作同上。
实验终点,高脂饲料饲喂23周后,同法监测体重、血压和血脂;然后麻醉处死大鼠,收集肾脏和心脏组织,4%多聚甲醛固定24 h后,石蜡包埋切片,再分批进行Masson染色和HE染色;显微镜下观察各脏器组织的病理学改变。
1.5 统计学方法
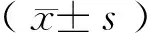
2 结果
2.1 造模23周后三组雄性大鼠的收缩压变化

注:与SHR-NC组相比,*P< 0.05。图1 造模23周后三组大鼠的收缩压变化(n=10)Note.Compared with SHR-NC group, *P< 0.05.Fig.1 Changes of systolic blood pressure in the male rats after 23 weeks feed with high fat diet or normal chow
造模23周结束后,WKY-NC、SHR-NC和SHR-HF组的大鼠血压水平如图1所示。经高脂饮食饲喂后,SHR-HF组的大鼠与饲喂普通饲料的SHR-NC组相比,SBP水平升高幅度明显(P< 0.05);而WKY-NC组的大鼠血压水平明显低于SHR-NC、SHR-HF组。
2.2 造模23周后三组雄性大鼠血脂的变化
造模23周结束后,WKY-NC、SHR-NC和SHR-HF组的大鼠血脂水平见表1,具体指标对比情况如图2所示。SHR-HF组与SHR-NC组相比,大鼠血浆血脂水平表现出了较为明显的紊乱特征,在各个指标上差异有显著性:SHR-HF组的大鼠HDL-C水平下降了27%(P< 0.01);LDL-C水平也上升了138%(P< 0.05);TC、TG水平明显升高,升高倍数分别高达130%、123%(P< 0.01,P< 0.05)。两组SHR大鼠血脂水平与WKY-NC组相比,表征血脂水平的各个指标(HDL-C、LDL-C、TC、TG)均明显低于WKY-NC组。
2.3 造模23周后三组雄性大鼠体重的变化

注:与SHR-NC组相比,*P< 0.05,**P < 0.01。图2 造模23周后大鼠血浆中血脂变化(n=10)Note.Compared with the SHR-NC group,*P< 0.05,**P < 0.01.Fig.2 Plasma lipid levels in the rats with normal chow or high fat diet for 23 weeks

图3 造模23周后三组大鼠的体重变化Fig.3 The changes of body weight in the rats with normal chow or high fat diet for 23 weeks.
WKY-NC、SHR-NC和SHR-HF组的大鼠体重随周龄变化规律如图3所示,大鼠体重随饲喂时间延长逐渐增大,饲喂10周后,增长速度逐渐变缓。造模23周后,高脂饮食饲喂的SHR-HF组的大鼠体重与SHR-NC组相比,平均增加了41 g(P< 0.01),较WKY-NC组平均增加了27 g。
以上结果显示,高脂饮食喂养可成功诱导SHR发生高血压合并高脂血症,因此,进一步对高血压合并高脂血症大鼠的心肾靶器官进行了深入的研究观察。
2.4 造模23周后三组雄性大鼠肾脏病理变化
2.4.1 肾纤维化损伤
造模23周结束后,对各组大鼠肾脏组织的石蜡切片进行Masson染色后,以肾脏皮质或近皮质区域为观察对象,光学显微镜下对每张切片中不同区域进行拍照(100倍),并应用IPP系列多功能图像分析软件测量肾脏纤维化程度;其中,胶原纤维呈蓝色,肾脏纤维化程度以图片中纤维化区域的总光密度值表示,即蓝色区域的强度。
WKY-NC、SHR-NC和SHR-HF组的大鼠肾脏纤维化损伤情况如图4所示。结果表明,高脂饮食饲喂的SHR-HF组与SHR-NC组相比,大鼠的肾脏纤维化情况加重,纤维化面积增幅高达130%(P< 0.01);而WKY-NC组的大鼠肾脏组织病理损伤较轻,纤维化情况明显低于SHR-NC、SHR-HF组。
2.4.2 肾小叶间动脉血管重构

注: a、b、c:大鼠肾脏HE染色(×800);a#、b#、c#:大鼠肾脏HE染色(×400);B:肾动脉血管壁腔内径比(MT/LD);与SHR-NC组相比,*P< 0.05。图5 造模23周后大鼠肾动脉的病理改变Note.A. Renal tissues and arteries. a,b,c: Renal arteries, ×800. a#,#,c#: Kidney tissues, ×400. B: The ratio of renal artery wall/ diameter (MT / LD), compared with the SHR-NC group,*P< 0.05.Fig.5 Histological changes of renal arteries in the rats with normal chow or high fat diet for 23 weeks. HE staining
造模23周结束后,对大鼠肾脏组织石蜡切片进行HE染色后,以肾小管区域为观察对象,光学显微镜下对每张切片中不同区域进行拍照(400倍),观察肾小管区域小叶间动脉血管形态,并应用IPP系列多功能图像分析软件测量血管管腔内径(LD)和血管壁厚度(WT),并进一步计算出血管壁腔内径比(WT/LD)。
WKY-NC、SHR-NC和SHR-HF 组的大鼠肾小叶间动脉血管情况如图5所示。 高脂饮食饲喂的SHR大鼠肾动脉血管出现了明显的病理学改变:血管壁明显增厚、血管腔狭窄,重构严重。与SHR-NC组相比,高脂饲料诱导的大鼠(SHR-HF组)肾动脉血管结构改变,发生明显重构(P< 0.05);而WKY-NC组大鼠的血管结构并未发生严重的病理学改变,肾脏血管受损情况明显轻于SHR-NC、SHR-HF组大鼠。结果表明:高脂饮食诱导SHR-HF组的大鼠肾脏器官受损严重。
2.5 造模23周后三组雄性大鼠心脏组织的病理变化
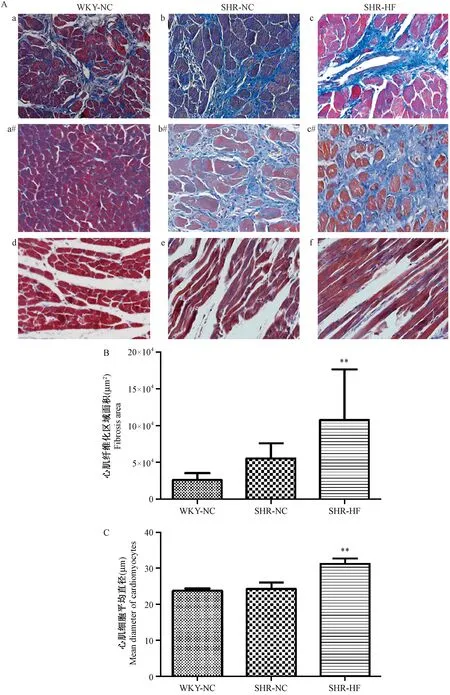
注:A:大鼠心脏心肌组织Masson染色;a(a#)、b(b#)、c(c#):横切Masson染色;d、e、f:纵切Masson染色;与SHR-NC组相比,**P< 0.01。图6 造模23周后大鼠心脏Masson染色(×100)Note.A: Heart tissues. a(a#),b(b#),c(c#): slitting Masson staining;d,e,f: crosscutting Masson staining.Compared with the SHR-NC group,**P< 0.01.Fig.6 Histology of the heart tissue in rats with normal chow or high fat diet for 23 weeks. Masson staining
WKY-NC、SHR-NC和SHR-HF组的大鼠心脏心肌纤维化损伤情况如图6所示。高脂饮食饲喂的SHR-HF组与SHR-NC组相比,大鼠心脏心肌细胞的纤维化程度加深,心肌细胞增大、肥厚严重(P< 0.01);与WKY-NC组相比,SHR-NC、SHR-HF组的大鼠心脏心肌纤维化区域面积增大明显(P< 0.01);然而,SHR-NC组的大鼠心肌细胞并未有增厚等病理改变,而SHR-HF组心肌细胞增厚明显(P< 0.01)。以上结果表明:高脂饮食诱导的SHR-HF组大鼠心脏器官受损明显。
3 讨论
HP/HL是一种对心肾损伤极大,致残致死率较高的全球性公共卫生疾病,其临床表现通常为血压过高,并发血浆中TC、TG或LDL-C过高,或HDL-C过低的血脂异常[3]。目前针对HP/HL的治疗药物多采用合并用药,且侧重点大多在于合理控制患者的血压血脂水平,并未过多强调对心肾器官的保护作用。因此,在开发HP/HL合并症治疗药物时,除对血压血脂进行评价外,关注药物对心肾器官的保护作用也有极其重要的临床意义;同时,构建高血压合并高脂血症且伴随心肾功能损伤的大鼠模型,将助益于推动更高效的HP/HL合并症治疗药物的开发。
本课题组在预试验阶段,采用文献中报道的高脂饲料[12-15]饲喂SHR,旨在构建HP/HL-SHR模型,但TG水平始终未发生显著性改变,推测原因可能是处方中脂肪含量较高(猪油10%~30%不等),制得的高脂饲料质地较软,导致大鼠的每日摄食量减少。本课题优选的高脂饲料处方脂肪含量仅为10%、蔗糖含量为20%、且具有较高的胆固醇含量(2.5%),质地坚硬,适合大鼠咀嚼,摄食量增多,SHR大鼠饲喂23周后可成功引发脂质紊乱,诱导HP/HL。
WKY大鼠常被用作SHR的模型对照组,广泛用于高血压治疗药物的降压作用评价。本课题研究发现,SHR-NC组的LDL-C、TC与TG水平均显著低于WKY-NC组,与文献报道一致[12-13];此血脂水平的差异可能源于WKY与SHR分属不同种系。基于此原因,本课题构建的HP/HL-SHR模型是以SHR-NC组参照来评价血脂水平,即:SHR-HF与SHR-NC组比较,HDL-C降低,TC、TG和LDL降低,则视为SHR-HF组大鼠出现脂质紊乱即高脂血症。此外,本课题进一步的对心肾功能进行对比研究发现,在SHR-HF组,高血压及高血脂对应的靶器官心脏和肾脏均出现大量的损伤,显著严重于SHR-NC组;然而,尽管WKY-NC组的血脂(TC、TG与LDL-C)高于SHR-HF组,但WKY大鼠的心肾靶器官并未出现明显损伤,表明SHR-HF组造模成功。综合可见,本课题构建的HP/HL-SHR模型不仅可以模拟HP/HL的临床表现,更能直观的模拟出合并症对于靶器官的损伤作用。
目前关于HP/HL造模的文献往往只是简单选择血压、血脂作为造模成功与否评判标准, 缺少对心肾靶器官的系统评价。本课题不仅成功构建了HP/HL-SHR模型,还进一步对肾脏、心脏组织的具
体病变损伤情况进行了系统性的研究分析;结果提示,所造动物模型可直观表征出HP/HL对心肾靶器官的损害,可为治疗HP/HL并改善心肾系统损伤的药物药效学评价奠定基础。
[ 1 ] Han TS, Lean ME. A clinical perspective of obesity, metabolic syndrome and cardiovascular disease [J]. JRSM Cardiovasc Dis, 2016, 5: 1-13.
[ 2 ] Bernhardi RV, Zanlungo S, Arrese M, et al. The metabolic syndrome: from an aggravating condition to a pathogenic risk factor for chronic diseases [J]. Revista Medica De Chile, 2010, 138(8): 1012-9.
[ 3 ] 陈伟伟, 高润霖, 刘力生, 等. 《中国心血管病报告2015》概要 [J]. 中国循环杂志, 2016, 31(6): 521-528.
[ 4 ] Bundy JD, He J. Hypertension and related cardiovascular disease burden in China [J]. Annals Global Health, 2016, 82(2): 227-233.
[ 5 ] 殷玥琪, 杨立刚, 孙桂菊. 高脂血症与高血压相关性及其代谢异常研究进展 [J]. 中国老年学, 2014, 34(5): 1414-1417.
[ 6 ] 郑婧. 自发性高血压大鼠心肌组织microRNA-97a与TGF-β1蛋白表达的改变及意义 [J]. 中国比较医学杂志, 2016, 26(11): 72-76.
[ 7 ] 谢亚菲, 蒋学华, 王凌, 等. Dunkin Hartley白化豚鼠和Hartley花色豚鼠高脂造模以及降脂药效学的比较 [J]. 中国比较医学杂志, 2015, 25(9): 56-61.
[ 8 ] 刘晓敏, 陈虹. “二肾一夹”复合高脂灌胃法建立高血压复合高脂血症大鼠模型 [J]. 时珍国医国药, 2008, 19(2): 306-307.
[ 9 ] 程轶群, 李晓辉. 若干实验性高血压大鼠模型的介绍 [J]. 中国比较医学杂志, 2006, 16(5): 305-308..
[ 10 ] Jang SM, Yee ST, Choi J, et al. Ursolic acid enhances the cellular immune system and pancreatic beta-cell function in streptozotocin-induced diabetic mice fed a high-fat die t[J]. Int Immunopharmacol, 2009, 9(1): 113-119.
[ 11 ] Knight SF, Quigley JE, Yuan J, et al. Endothelial dysfunction and the development of renal injury in spontaneously hypertensive rats fed a high-fat diet [J]. Hypertension, 2008, 51: 352-359.
[ 12 ] 夏晓莉, 陈伯钧, 刘泉颖, 等. 利用自发性高血压大鼠建立营养性高血压肥胖模型的研究进展[J]. 现代中西医结合杂志, 2009, 18(8): 945-947.
[ 13 ] Knight SF, Yuan J, Roy S, et al. Simvastatin and tempol protect against endothelial dysfunction and renal injury in a model of obesity and hypertension [J]. Am J Physiol Renal Physiol, 2010, 298(1): F86-94.
[ 14 ] Chung HW, Lim JH, Kim MY, et al. High-fat diet-induced renal cell apoptosis and oxidative stress in spontaneously hypertensive rat are ameliorated by fenofibrate through the PPARα-FoxO3a-PGC-1α pathway [J]. Nephrol Dial Transplant, 2012, 27: 2213-2225.
[ 15 ] Chung S, Park CW, Shin SJ, et al. Tempol or candesartan prevents high-fat diet-induced hypertension and renal damage in spontaneously hypertensive rats [J]. Nephrol Dial Transplant, 2010, 25: 389-399.

