全反式维甲酸诱导经典型霍奇金淋巴瘤B细胞表型
杜 静,宫凯凯,杨丽娟,陈微微,罗丽卿
(1.滨州医学院附属医院,肿瘤研究中心,山东 滨州 256600; 2.滨州医学院附属医院,血液科,山东 滨州 256600)
经典型霍奇金淋巴瘤(classical Hodgkin Lymphoma, cHL)以无痛性、进行性淋巴结肿大为主要临床表现,病理诊断可见特征性的HRS(Hodgkin’s and Reed-Sternberg cells)瘤细胞[1]。尽管目前约85%的病人预后较好,仍有部分病人因原发或继发耐药死亡[2]。虽然cHL细胞具有B细胞特征性的免疫球蛋白(immunoglobulin, Ig)基因重排且起源于B细胞,却缺失了B细胞特异性标记物如CD19,CD20等基因的转录和表达[3-4],同时细胞表面异常高表达B细胞非特异性抗原如CD30[5]。B细胞表型的缺失是造成霍奇金淋巴瘤细胞逃避免疫监视和恶性转化的关键因素[6-7],因此诱导霍奇金淋巴瘤B细胞表型转化将有助于临床治疗。
全反式维甲酸(all trans-retinoic acid,ATRA)是维生素A的代谢产物,具有诱导细胞分化的作用,临床上用于急性早幼粒白血病的治疗。有研究证明,ATRA能够在体内外诱导淋巴母细胞向B细胞分化[8]。本研究构建荧光素酶标记的B细胞特异性启动子cHL报告细胞,检测ATRA对B细胞外源启动子活性及相关基因表达的诱导作用,通过与去甲基化药物5-Aza联合用药,进一步探讨ATRA重新激活cHL细胞B细胞表型的潜在作用。
1 材料和方法
1.1 细胞及主要试剂
霍奇金淋巴瘤细胞系(KMH2、L1236和L428)为本实验室冻存。携带CD19启动子载体由由Kupperschmitt教授惠赠,携带CD79a(mb1)、CD79b(B29)和ICSBP的质粒由Sigvardsson教授惠赠[9-11]。
5-Aza-2’-deoxycytidine(5-Aza)、ATRA和钙黄绿素(Calcein AM,CAM)购自Sigma 公司;Dual-Glo® Luciferase和ONE-GloTMLuciferase检测试剂盒购自Promega;胎牛血清、1640培养基、胰酶购自美国Gibco 公司;质粒构建所需内切酶和连接酶购自NEB公司;RNA提取及逆转录试剂购于Invitrogen;长片段基因扩增所用Dream Taq Green酶购自Fermentas;质粒提取试剂盒购自德国Qiagen 公司; 蛋白免疫印迹所用抗体购自Acris Antibodies;流式细胞染色所需CD30抗体购自BD生物有限公司。流式细胞仪购自BD 生物有限公司;电转仪及相关缓冲试剂购自Lonza。
1.2 实验方法
1.2.1 细胞培养及用药
人的cHL细胞系悬浮培养于含10%胎牛血清和1%双抗的1640 培养基,在含有5% CO2的培养箱中37℃常规培养,根据细胞状态每2~3 d传代。以DMSO处理样本为阴性对照,常规ATRA和5-Aza用药浓度为10 μmol/L(除非特殊标注)。
1.2.2 质粒构建
通过XhoI/SalⅠ双酶切PL452质粒并电泳胶回收得到2038 bp PGK-NEO片段,将插入片段与Sal I单酶切的B细胞启动子pGL3荧光素酶报告载体连接,DH5α转化后挑单克隆并小提,通过Sal I/Bgl II双酶切鉴定阳性克隆。
1.2.3 细胞转染及稳定克隆筛选
提取质粒并去除内毒素,收集细胞,根据Nucleofector电转仪说明选择相应的缓冲液和转染程序进行细胞转染。KMH2和L1236细胞采用T缓冲液和T-001程序转染, L428细胞采用L缓冲液和X-001程序进行转染。
1.2.4 稳定转染细胞筛选
瞬时转染48 h后离心换液,以转染eGFP的相应细胞为平行对照进行G418筛选,药物浓度在KMH2、L1236和L428细胞分别为200、400和400 μg/mL,筛选2周后对照细胞全部死亡,改为G418半量维持培养。
1.2.5 稳定转染细胞的目的片段整合鉴定
提取筛选后cHL细胞基因组并进行PCR,所用引物序列如下:pGL3 For:5’-GGAAGACGCCAAAA ACATAAAG-3’,pGL3 Rev:5’-CATCGGTCGACGGA TCCTTATC-3’
1.2.6 shRNA干扰实验
采用pSUPER-puro 系统(Invitrogen)进行ABF1瞬时和稳定敲除,所需引物如下:ABF1 301 For:5’-GATCCCCGCCGCAGAGTGCAAGCAGTTTCAAGAGA ACTGCTTGCACTCTGCGGCTTTTTGGAAA,ABF1 301 Rev:3’-GGGCGGCGTCTCACGTTCGTCAAAGTTCTC TTGACGAACGTGAGACGCCGAAAAACCTTTTCGA;所用对照无义序列如下:Scramble For: 5’-GATCCCCCGTACGCGGAATACTTCGATTCAAGAGA TCGAAGTATTCCGCGTACGTTTTTGGAAA,Scramble Rev: 3’-GGGGCATGCGCCTTATGAA GCTAAGTTCT
CTAGCTTCATAAGGCGCATGCAAAAACCTTTTCGA
1.2.7 荧光素酶活性检测
在96孔板每孔加入100 μL细胞悬液和10 μmol/L钙黄绿素CAM, 室温避光孵育10 min后检测荧光强度。同时,另取100 μL细胞悬液加入100 μL One-Glo reagent, 室温避光孵育15 min,细胞充分裂解后于560 nm检测化学发光信号强度。
1.2.8 免疫印迹
提取细胞总蛋白并通过Bradford法测量浓度,加入上样缓冲液后于95℃孵育5 min。通过SDS-聚丙烯酰胺凝胶分离蛋白并转到0.22 μm孔径的PVDF膜上,一抗4℃过夜孵育,辣根过氧化物酶HRP标记的二抗室温孵育1 h后通过ECL法显色。
1.2.9 实时荧光定量PCR
使用TRIzol试剂提取细胞总RNA并通过Superscript II Reverse逆转录酶合成互补cDNA。以琥珀酸脱氢酶复合物亚单位A(SDHA)做内参,使用TaqMan进行实时荧光定量PCR检测目的基因表达水平。所有反应均设三个复孔,基因的相对表达量比较采用ΔΔCt法。
1.2.10 流式细胞技术
取5×105细胞于1200 r/min离心5 min,用预冷的PBS洗涤2次,抗体1∶2稀释后避光孵育30 min, PBS洗涤后用含有1% FBS的PBS悬浮细胞,采用FL-1通道上机检测FITC标记的抗体,以同型IgG抗体做阴性对照。采用Flowjo软件分析结果。
1.3 统计学方法

2 结果
2.1 携带G418抗性的B细胞特异性启动子报告载体的构建
对PL452质粒进行XhoI/SalⅠ双酶切得到将PGK-NEO片段,插入由Sal I单酶切线性化的 B细胞启动子pGL3载体内,构建可用于G418稳定筛选的CD19/CD79a/CD79b/ICSBP -pGL3-PGK-NEO质粒(见图1 A)。通过Sal I/Bgl II双酶切鉴定阳性克隆,CD19-pGL3-PGK-NEO正确克隆琼脂糖电泳应显示2 kb和7 kb片段,CD79a/CD79b/ICSBP-pGL3-PGK-NEO质粒正确克隆显示2 kb和5 kb片段,Afe I单酶切后分别产生9 kb和7 kb片段。
2.2 稳定转染克隆的筛选及其B细胞特异性启动子的基因扩增和功能鉴定
采用Lonza核电转染系统,以eGFP为阳性对照摸索出针对不同细胞系的最佳转染条件(程序和缓冲液等详见方法部分)。经G418筛选稳定转染细胞后提取基因组,扩增外源启动子和荧光素酶片段以鉴定其整合,CD79a/CD79b/ICSBP-Luc序列扩增后应为2.2 kb, CD19-Luc序列扩增后应为4 kb,以104倍稀释后的CD79a-pGL3质粒和pGL3空载体为阳性对照,以未转染细胞基因组为阴性对照可见,CD79a/CD79b/CD19-Luc序列稳定整合到KMH2,L1236和L428细胞中(见图1A)。据报道,活化的B细胞因子1(Activated B-cell Factor, ABF1)在cHL细胞内异常高表达且与早期B细胞发育分化的关键转录因子E2A结合并抑制其功能[12]。为进一步检验整合后的启动子是否具有功能,我们通过RNA干扰技术敲除ABF1表达,并在瞬时和稳定敲除ABF1的L428荧光素酶报道细胞中检测其对B细胞特异性启动子活性的影响。结果证实,ABF1表达沉默能够显著增加CD19、CD79a和CD79b启动子的转录活性(见图1B-D)。
2.3 ATRA激活cHL细胞中外源B细胞特异性启动子的转录活性
我们首先采用1和10 μmol/L ATRA孵育CD19-Luc整合的L428细胞后,分别在24、48 h和72 h检测荧光素酶强度,以钙黄绿素(calcein AM,CAM)对活细胞进行荧光标记以排除细胞死亡造成的假阴性。结果显示,10 μM ATRA在48 h对细胞CD19启动子具有最大诱导活性(见图2 A)。
以往研究证实,CD19和免疫球蛋白重链基因的启动子区域在霍奇金淋巴瘤细胞内存在甲基化[13-14],因此我们进一步采用5-Aza和ATRA单独和/或联合孵育报告细胞后进行荧光素酶活性检测,发现两种药物能够在3种cHL细胞系中激活CD19启动子活性,且二者联合用药时具有协同效应(见图2C)。此外,在KMH2和L428细胞中ATRA能够显著诱导CD79a和CD79b启动子活性,尽管5-Aza单独作用时对CD79a无显著作用且对CD79b作用轻微,但是能够增加ATRA对两个B细胞基因的诱导作用(见图2D和E)。
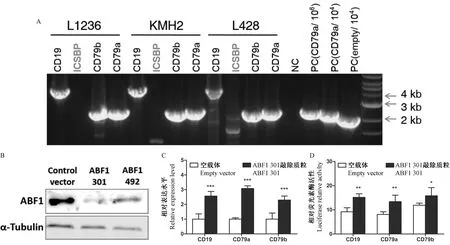
注:与空载体组比较,*P<0.05,**P<0.01,***P<0.001。图1 稳定转染克隆B细胞启动子的基因扩增和功能鉴定Note.Compared with the empty vector group, *P<0.05,**P<0.01,***P<0.001.Fig.1 Amplification and functional verification of B-promoter reporters integrated into the host genome of cHL cell lines

注:与对照组比较,*P<0.05,**P<0.01,***P<0.001。图2 ATRA和5-Aza单独和联合用药时对CD19、CD79a和CD79b外源启动子活性的影响Note.Compared with the DMSO treated group, *P<0.05,**P<0.01,***P<0.001.Fig.2 Effect of single or double treatment of ATRA and 5-Aza on the activity of B-specific promoters
由于许多化合物可与荧光素酶本身结合并影响其活性,为排除5-Aza和ATRA直接作用于荧光素酶而非B细胞启动子,我们以SV40-pGL3-PGK-NEO稳定转染细胞为对照,以同样条件加入5-Aza和/或ATRA孵育发现两种药物对SV40启动子无作用(见图2B),证实5-Aza和ATRA可以特异性诱导B细胞启动子的转录活性。
2.4 ATRA激活cHL细胞中內源B细胞特异性基因转录和表达

注:(C)图中图例DMSO、AZA、ATRA和ATRA/AZA分别代表细胞进行DMSO(对照)、5-Aza、ATRA和联合用药。与对照组比较,*P<0.05,**P<0.01,***P<0.001。图3 5-Aza和ATRA单独和联合用药时对CD19、CD79a和CD79b內源基因表达水平的影响Note.Legends in (C) represent cell treated with DMSO, 5-Aza, ATRA and combination of ATRA and 5-AZA. Compared with the DMSO treated group, *P<0.05,**P<0.01,***P<0.001.Fig.3 Effect of single or double treatment of ATRA and 5-Aza on the expression of B-specific promoters
采用1和10 μmol/L ATRA孵育L428细胞,在6、24和48 h提取RNA并反转录,通过RQ-PCR检测CD19和CD20基因转录水平的改变。如图3 A和B所示,ATRA呈剂量和时间依赖性的诱导L428细胞內源CD19和CD20基因转录。用5-Aza(图中简写为AZA)和/或ATRA孵育KMH2和L428细胞48 h后,检测內源B细胞特异性标记物CD19、CD79a和CD79b转录水平发现,5-Aza和ATRA单独用药时能够诱导內源cHL细胞中CD19,CD79a和CD79b转录,且二者具有协同效应(见图3C)。用10 μmol/L ATRA孵育KMH2和L428细胞后提取蛋白进行免疫印迹,结果显示ATRA能够诱导CD19、CD20和CD79b基因在KMH2和L428细胞重新表达(见图3D)。
2.5 ATRA下调cHL细胞表面特异性CD30抗原表达水平
为揭示ATRA对cHL细胞霍奇金特异性细胞表型的影响,我们进一步检测了ATRA处理对KMH2和L428细胞表面CD30抗原表达水平的作用。流式细胞染色显示,与DMSO处理的对照细胞相比较,ATRA下调KMH2和L428细胞表面cHL特异性标记物CD30表达水平(见图4)。以上结果均提示ATRA能够诱导B细胞表型缺失的cHL细胞重新或得B细胞表型。

图4 ATRA对cHL细胞霍奇金细胞特异性标记物CD30蛋白表达的影响Fig.4 Effect of ATRA on Hodgkin lymphoma cells regarding Hodgkin-cell specific gene CD30 expression
3 讨论
cHL约占B细胞淋巴瘤发病率的10%,瘤细胞携带B细胞特征性的免疫球蛋白重链IgH基因重组,却不具有B细胞特异性基因表达谱,包括CD19、CD20、B细胞表面受体复合物CD79a和CD79b等[15-16],同时异常高表达B细胞非特异性基因如CD30、NOTCH1、ABF1和ID2等[12, 17-18]。瘤细胞表型的转变对其恶性转化及免疫逃逸有重要作用,因此寻找霍奇金淋巴瘤B细胞表型的诱导剂具有潜在的临床治疗价值。
表观遗传修饰如启动子甲基化是肿瘤发生和表型转变的重要因素[14, 19-20]。以往研究发现,cHL原代HRS细胞和商品化的细胞系中CD19和CD79b基因启动子区域及组蛋白H3存在甲基化[13-14],提示B细胞表型缺失与B细胞特异性基因的异常甲基化修饰有关。然而,Hummel[21]和我们以往研究表明,去甲基化药物5-Aza处理cHL细胞并未显著诱导其B细胞特异性基因的表达[22],提示尚有其它因素阻遏cHL细胞内B细胞基因的转录和翻译。
以CD19为标记,Chen等[8]发现ATRA能够诱导小鼠和人的淋巴母细胞向B细胞分化。为进一步探索ATRA对B细胞表型缺失的霍奇金淋巴瘤重新向B细胞分化的诱导作用,本研究首先建立了B细胞特异性启动子(CD19,CD79a和CD79b)驱动荧光素酶稳定整合的cHL报告细胞系。其中CD19启动子包含了B细胞特异性增强子Eμ、B细胞特异性转录因子PAX5和EBF的结合位点和甲基化修饰位点[9],其稳定整合能够更好的模拟和反映內源CD19启动子活性状态。同时,为验证外源启动子功能的完整性,我们敲除了在cHL中异常高表达的转录因子ABF1,发现ABF1沉默可以显著提高CD19、CD79a和CD79b启动子驱动的荧光素酶活性,证明外源启动子能够忠实的反应相应內源基因启动子的转录活性。
以B细胞启动子报告细胞和亲本cHL细胞为模型,我们发现ATRA能够诱导CD19、CD20、CD79a和CD79b的转录与表达,同时降低细胞表面霍奇金细胞特异性CD30抗原表达水平,提示ATRA能够激活cHL内B细胞特异性转录程序并诱导其重新向B细胞转化。去甲基化药物5-Aza联合应用能够进一步提高B细胞特异性基因的表达水平。临床上,抗CD20的单克隆抗体治疗在具有B细胞表型的非霍奇金淋巴瘤病人上取得了显著疗效,此外有大量靶向CD19的抗体在淋巴瘤治疗的相关研究[23-25]。由于表型缺失,CD20单抗在cHL病人治疗中的疗效受到了限制,ATRA对cHL细胞中CD19和CD20表达的诱导或可促进单克隆抗体对复发或耐药cHL病例中的应用。
综上所述,我们建立了稳定整合B细胞特异性启动子驱动荧光素酶的cHL细胞系,该报告细胞可用于后续B细胞表型诱导药物的筛选。本研究发现ATRA能有诱导去分化的cHL细胞重获B细胞表型,具有增敏cHL对靶向B细胞表型单抗治疗的潜在作用。
[1] Bräuninger A, Schmitz R, Bechtel D, et al. Molecular biology of Hodgkin’s and Reed/Sternberg cells in Hodgkin’s lymphoma [J]. Int J Cancer, 2006, 118(8): 1853-1861.
[2] Townsend W, Linch D. Hodgkin’s lymphoma in adults [J]. Lancet, 2012, 380(9844): 836-847.
[3] Küppers R, Rajewsky K, Zhao M, et al. Hodgkin disease: Hodgkin and Reed-Sternberg cells picked from histological sections show clonal immunoglobulin gene rearrangements and appear to be derived from B cells at various stages of development [J]. Proc Natl Acad Sci U S A, 1994, 91(23): 10962-10966.
[4] Marafioti T, Hummel M, Foss HD, et al. Hodgkin and Reed-Sternberg cells represent an expansion of a single cloneoriginating from a germinal center B-cell with functional immunoglobulin gene rearrangements but defective immunoglobulin transcription [J]. Blood, 2000, 95(4): 1443-1450.
[5] Slovak ML, Bedell V, Hsu YH, et al. Molecular karyotypes of Hodgkin and Reed-Sternberg cells at disease onset reveal distinct copy number alterations in chemosensitive versus refractory Hodgkin lymphoma [J]. Clin Cancer Res, 2011, 17(10): 3443-3454.
[6] 刘晓健, 龙志国, 乔忠杰. 经典型霍奇金淋巴瘤表观遗传学异常及其对免疫逃逸的影响 [J]. 实用肿瘤学杂志, 2017, 31(1): 73-77.
[7] Steidl C, Connors JM, Gascoyne RD. Molecular pathogenesis of Hodgkin’s lymphoma: Increasing evidence of the importance of the microenvironment [J]. J Clin Oncol, 2011, 29(14): 1812-1826.
[8] Chen X, Esplin BL, Garrett KP, et al. Retinoids accelerate B lineage lymphoid differentiation [J]. J Immunol, 2008, 180(1): 138-145.
[9] Sirven A, Ravet E, Charneau P, et al. Enhanced transgene expression in cord blood cd34(+)-derived hematopoietic cells, including developing T cells and NOD/SCID mouse repopulating cells, following transduction with modified trip lentiviral vectors [J]. Mol Ther, 2001, 3(4): 438-448.
[10] Sigvardsson M, Clark DR, Fitzsimmons D, et al. Early B-cell factor, e2a, and pax-5 cooperate to activate the early B cell-specific mb-1 promoter [J]. Mol Cell Biol, 2002, 22(24): 8539-8551.
[11] Akerblad P, Rosberg M, Leanderson T, et al. The b29 (immunoglobulin beta-chain) gene is a genetic target for early B-cell factor [J]. Mol Cell Biol, 1999, 19(1): 392-401.
[12] Mathas S, Janz M, Hummel F, et al. Intrinsic inhibition of transcription factor E2A by HLH proteins ABF-1 and Id2 mediates reprogramming of neoplastic B cells in Hodgkin lymphoma [J]. Nat Immunol, 2006, 7(2): 207-215.
[13] Ushmorov A, Leithäuser F, Sakk O, et al. Epigenetic processes play a major role in B-cell-specific gene silencing in classical Hodgkin lymphoma [J]. Blood, 2006, 107(6): 2493-2500.
[14] Ushmorov A, Ritz O, Hummel M, et al. Epigenetic silencing of the immunoglobulin heavy-chain gene in classical Hodgkin lymphoma-derived cell lines contributes to the loss of immunoglobulin expression [J]. Blood, 2004, 104(10): 3326-3334.
[15] Mathas S. The pathogenesis of classical Hodgkin’s lymphoma: A model for B-cell plasticity [J]. Hematol Oncol Clin North Am, 2007, 21(5): 787-804.
[16] 李银珍, 王芳, 邵琼, 等. Igh基因单克隆重排检测及其在B细胞性非霍奇金淋巴瘤诊断中的应用 [J]. 中国病理生理杂志, 2012, 28(11): 1994-1998.
[17] Jundt F, Acikgöz O, Kwon SH, et al. Aberrant expression of notch1 interferes with the B-lymphoid phenotype of neoplastic B cells in classical Hodgkin lymphoma [J]. Leukemia, 2008, 22(8): 1587-1594.
[18] Renné C1, Martin-Subero JI, Eickernjäger M, et al. Aberrant expression of Id2, a suppressor of B-cell-specific gene expression, in Hodgkin’s lymphoma [J]. Am J Pathol, 2006, 169(2): 655-664.
[19] Losman JA. Cancer therapy: The leukaemia epigenome targeted [J]. Nature, 2017, 543(7647): 634-635.
[20] 张玲,盛树力,秦川. 表观遗传学药物的研究进展 [J]. 中国药理学通报, 2013, 29(3): 297-303.
[21] Ehlers A, Oker E, Bentink S, et al. Histone acetylation and DNA demethylation of B cells result in a Hodgkin-like phenotype [J]. Leukemia, 2008, 22(4): 835-841.
[22] Du J, Neuenschwander M, Yu Y, et al. Pharmacological restoration and therapeutic targeting of the B-cell phenotype in classical Hodgkin lymphoma [J]. Blood, 2017, 129(1): 71-81.
[23] Viardot A, Goebeler ME, Hess G, et al. Phase 2 study of the bispecific T-cell engager (bite) antibody blinatumomab in relapsed/refractory diffuse large B-cell lymphoma [J]. Blood, 2016,127(11):1410-1416.
[24] Pérez-Callejo D, González-Rincón J, Sánchez A, et al. Action and resistance of monoclonal CD20 antibodies therapy in B-cell Non-Hodgkin lymphomas [J]. Cancer Treat Rev, 2015, 41(8): 680-689.
[25] Bander NH, Czuczman MS, Younes A. Antibody-drug conjugate technology development for hematologic disorders [J]. Clin Adv Hematol Oncol, 2012,10(8 Suppl 10): 1-16.

