微卫星DNA标记对BABL/c突变卷毛小鼠遗传特性的分析
李晓娟,孙兆增,冯 帆,姜棋予,孙慧伟,李 润,柴燕涛,侯 俊*,李瑞生*
(1.解放军第302医院临床研究管理中心,北京 100039; 2.军事医学科学院实验动物中心,北京 100071)
实验动物遗传背景的一致性和多样性,是衡量实验动物品质的一个重要因素,因此在实验动物的饲养与繁育中,发现和培育具有特殊生物学性能的动物品系是非常重要的[1]。本实验室于2012年发现的BABL/c卷毛小鼠,通过五年多的近交培育现已完全成为一个遗传稳定的近交系突变卷毛小鼠品系[2]。微卫星又称短串联重复序列(short tandem repeat,STR),作为分子标记在实验动物的遗传质量检测和科学研究中已得到了广泛地应用[3-6]。本研究将高通量的荧光PCR技术应用到小鼠微卫星DNA遗传检测中,利用筛选出的38个微卫星位点标记对BALB/c正常小鼠、突变卷毛小鼠和突变无毛小鼠等三个品系进行检测分析,旨在了解BALB/c突变卷毛小鼠与正常近交系BALB/c小鼠的遗传背景是否存在差异以及差异的程度,以期建立近交系BALB/c突变卷毛小鼠种质资源的遗传特性,为后期建系保种、品系培育以及科学研究提供重要的科学依据。
1 材料和方法
1.1 实验动物
选取近交培育的SPF级BALB/c突变卷毛小鼠(来源解放军第302医院动物实验室)、BALB/c正常小鼠和突变无毛小鼠(来源军事医学科学院实验动物中心[SCXK(军)2012-0004])各10只,雌雄各半,体重18~20 g。本实验室使用许可证[SYXK(军)2012-0010],并按实验动物使用的3R原则给予人道的关怀。
1.2 实验方法
1.2.1 DNA样本制备
取小鼠尾巴剪成米粒大小,加入DNA提取液和蛋白酶K过夜消化,采用酚/氯仿抽提法提取基因组DNA,最终稀释成50~100 ng/μL作为DNA模板[7]。
1.2.2 微卫星位点的选择及荧光标记
本研究选D1Mit365、D2Mit15、D2Mit30、D3Mit29、D3Mit51、D4Mit235、D5Mit48、D6Mit8、D6Mit15、D6Mit102、D7Mit12、D7Mit281、D8Mit14、D8Mit33、D8Mit113、D9Mit21、D9Mit23、D10Mit12、D10Mit180、D11Mit4、D11Mit128、D12Mit7、D12Nds11、D12Mit147、D13Mit3、D14Mit3、D14Mit102、 D15Mit5、D15Mit15、D16Mit9、D16Mit145、D17Mit36、D17Nds3、D18Mit9、D18Mit19、D18Mit94、D19Mit3和DXMit16等38个微卫星位点参考MMDBJ 数据库(Mouse Microsatellite Data Base of Japan) 及文献[8],以在不同小鼠品系间多态信息丰富的位点为主,均匀分布于19条常染色体和X染色体上,引物由北京睿博兴科生物技术有限公司合成,各微卫星位点上游PCR引物的5’端均用FAM荧光染料进行标记。
1.2.3 荧光引物PCR扩增
PCR反应体系为10 μL: 2×Type-it Multiplex PCR Master Mix 5 μL,上下游引物(10 μmol/L)各0.1 μL,模板DNA 0.5 μL,RNase-free water补足10 μL。PCR反应程序: 95℃预变性5 min;95℃变性30 s;退火温度58℃和53℃,30 s;72℃延伸30 s;20个循环;72℃继续延伸10 min;扩增产物4℃保存。
1.2.4 PCR 产物检测及STR扫描
四种PCR产物各取0.3 μL、分子量内标0.5 μL和去离子甲酰胺9.5 μL混合加入PCR板,95℃变性5 min,4℃冷却后离心,1× buffer缓冲液上机检测。将荧光标记的PCR产物通过ABI3730 测序仪的毛细管凝胶电泳进行扫描检测,用Genemarker 2.2.0 软件收集测序仪毛细管凝胶电泳的数据,用Gene Mapper软件分析各位点的片段大小。
2 结果
2.1 三个品系小鼠间STR扫描相同微卫星位点结果分析
对三个品系小鼠的38个微卫星位点STR扫描检测结果显示:BALB/c突变卷毛小鼠与正常小鼠间有27个位点的DNA片断完全相同,且突变卷毛雌雄鼠间也完全相同,如D2Mit30位点(见图1),与无毛突变鼠间有26个位点相同;而无毛突变鼠与正常小鼠间有30个位点相同(见表1)。
2.2 三个品系小鼠间STR扫描不同微卫星位点结果分析
STR扫描检测结果显示:BALB/c突变卷毛小鼠与正常小鼠间有11个位点存在差异,而突变卷毛雌雄鼠间完全相同,如D6Mit15位点(见图2),与无毛小鼠间有12个位点存在差异,且卷毛鼠与其他两个品系间有5个位点交叉存在差异;而正常BABL/c鼠与无毛鼠间有8个位点存在差异(见表1)。
2.3 三个品系小鼠间差异性位点的数量及遗传突变率的分析
38个位点中BALB/c突变卷毛鼠与正常小鼠间有11个位点发生突变,其突变率为28.9%,与无毛小鼠间有12个位点存在差异,其突变率为31.6%;而BALB/c突变无毛小鼠与正常鼠间有8个位点发生突变,其突变率为21.1%。结果表明BALB/c突变卷毛鼠的突变率明显高于无毛小鼠(见表2)。

注:A:BALB/c正常鼠(♂);B: BALB/c无毛鼠(♂);C~D: BALB/c卷毛鼠(♂);E~F: BALB/c卷毛鼠(♀);A~F波峰值全部相同;纵坐标为波峰高度,横坐标为扫描时间。图1 D2Mit30位点的微卫星扫描波形Note.A: BALB/c mouse(♂). B: Mutant hairless mouse (♂). C-D: Mutant curly mice (♂). E-F: Mutant curly mice (♀). The peaks are all the same in A-F.Y-axis is the peak height, X-axis is the scan time.Fig.1 The waveforms of loci D2Mit30 in STR scanning

注:A:BALB/c正常鼠(♂);B: BALB/c无毛鼠(♂);C~D: BALB/c卷毛鼠(♂);E~F: BALB/c卷毛鼠(♀);A~B与C~F的波峰值不同;纵坐标为波峰高度,横坐标为扫描时间。图2 D6Mit15位点的微卫星扫描波形Note.A: BALB/c mouse (♂). B: Mutant hairless mouse (♂). C-D: Mutant curly mice (♂). E-F: Mutant curly mice (♀).The peaks in A-B are different from that in C-F.Y-axis is the peak height. X-axis is the scan time.Fig.2 The waveforms of loci D6Mit15 in STR scanning
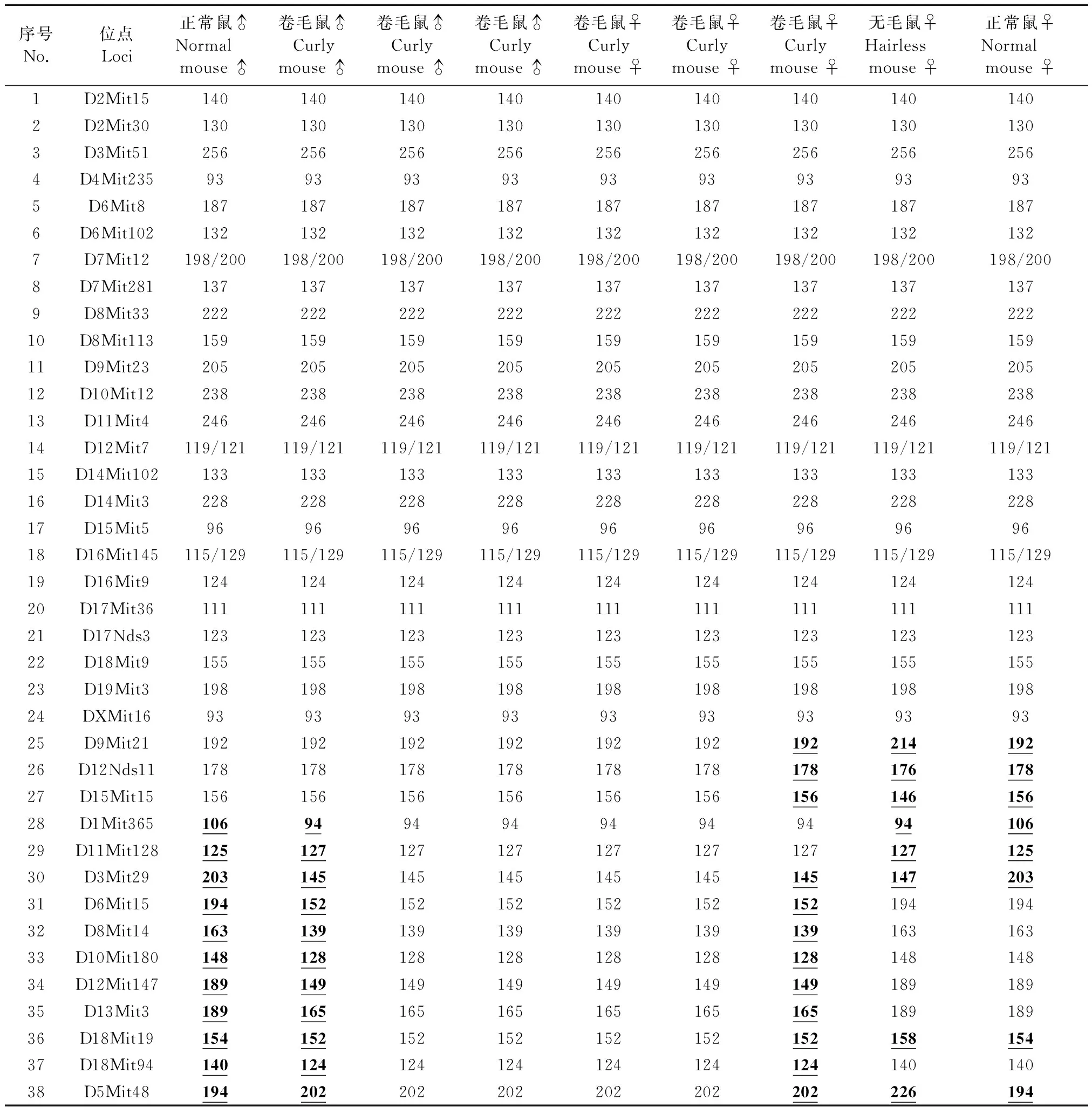
序号No.位点Loci正常鼠♂Normal mouse♂卷毛鼠♂Curlymouse♂卷毛鼠♂Curlymouse♂卷毛鼠♂Curlymouse♂卷毛鼠♀Curlymouse♀卷毛鼠♀Curlymouse♀卷毛鼠♀Curlymouse♀无毛鼠♀Hairless mouse♀正常鼠♀Normal mouse♀1D2Mit151401401401401401401401401402D2Mit301301301301301301301301301303D3Mit512562562562562562562562562564D4Mit2359393939393939393935D6Mit81871871871871871871871871876D6Mit1021321321321321321321321321327D7Mit12198/200198/200198/200198/200198/200198/200198/200198/200198/2008D7Mit2811371371371371371371371371379D8Mit3322222222222222222222222222210D8Mit11315915915915915915915915915911D9Mit2320520520520520520520520520512D10Mit1223823823823823823823823823813D11Mit424624624624624624624624624614D12Mit7119/121119/121119/121119/121119/121119/121119/121119/121119/12115D14Mit10213313313313313313313313313316D14Mit322822822822822822822822822817D15Mit596969696969696969618D16Mit145115/129115/129115/129115/129115/129115/129115/129115/129115/12919D16Mit912412412412412412412412412420D17Mit3611111111111111111111111111121D17Nds312312312312312312312312312322D18Mit915515515515515515515515515523D19Mit319819819819819819819819819824DXMit1693939393939393939325D9Mit2119219219219219219219221419226D12Nds1117817817817817817817817617827D15Mit1515615615615615615615614615628D1Mit3651069494949494949410629D11Mit12812512712712712712712712712530D3Mit2920314514514514514514514720331D6Mit1519415215215215215215219419432D8Mit1416313913913913913913916316333D10Mit18014812812812812812812814814834D12Mit14718914914914914914914918918935D13Mit318916516516516516516518918936D18Mit1915415215215215215215215815437D18Mit9414012412412412412412414014038D5Mit48194202202202202202202226194

表2 38个微卫星位点在三个小鼠种群中的突变率
3 讨论
微卫星DNA标记主要具有分布广、多态性高、遗传稳定、数量多和片段短容易扩增等优势,而被作为一种非常重要、成熟的遗传工具广泛应用于各类实验动物的遗传检测和科学研究中[9]。小鼠基因组图谱已包含了7377个微卫星DNA,其中有6580个具有显著的多态性[10],能够更全面地反映出基因组的遗传特性及变异情况。目前应用微卫星标记方法不但可以进行纯合位点的判定,而且还能对基因位点的变异情况进行统计分析[11]。DNA全自动测序仪的毛细管凝胶电泳技术是近年来快速发展起来的一种新技术,该技术将荧光标记的PCR产物和标准分子量样品(内参) 在同一毛细管中进行电泳,DNA分析仪将结果自动记录在计算机上,利用片段分析软件进行图像收集和分析,而更精确地计算出微卫星位点的等位基因片段大小,是遗传检测研究的主要发展方向[12]。
由于BALB/c突变卷毛小鼠和无毛小鼠均是由正常BALB/c小鼠突变产生的[13],因此本研究结合荧光PCR检测方法和毛细管凝胶电泳法应用到微卫星的分型检测中,将筛选的38个微卫星位点对正常BALB/c小鼠、BALB/c突变卷毛小鼠与BALB/c突变无毛小鼠这三个群体的遗传背景进行检测分析,结果发现38个微卫星位点在BALB/c突变卷毛小鼠和正常小鼠之间有27个微卫星位点是完全相同的,有11个位点存在差异,其突变率为28.9%(11/38)接近三分之一,显示其突变率较高。而BABL/c无毛小鼠与正常小鼠之间有30个位点相同,8个位点存在差异,其突变率为21.1%(8/38),相比发现突变卷毛小鼠其突变率明显高于无毛小鼠。而BABL/c突变卷毛小鼠与无毛小鼠之间也有12个位点存在差异,证明了卷毛小鼠突变与无毛小鼠突变是两个完全不同的突变系。突变无毛小鼠的生理生化指标、染色体定位以及皮肤结构的差异都已得到了证实[13]。实验前期本实验室也证实了BABL/c突变卷毛小鼠的血液生化指标、皮肤组织结构以及生长发育指标均与正常小鼠存在差异[14-15],从而说明了BALB/c突变卷毛小鼠是一个非常宝贵难得的突变系小鼠。
总之,本实验应用38个微卫星位点结合荧光PCR微卫星标记检测技术,对BALB/c突变卷毛小鼠的变异情况进行遗传检测分析,旨在发现BALB/c突变卷毛小鼠与正常小鼠之间存在的差异以及差异的程度,为今后进一步研究BALB/c突变卷毛小鼠的遗传特性和未来开发应用该突变系小鼠模型提供可靠的理论参考。
[1] 王洪,杜小燕,徐平,等.上海KM小鼠种子群体遗传状况分析[J].中国比较医学杂志,2014, 24(12):27-32.
[2] 李晓娟, 张巧云, 李蓓, 等.BALB/c突变卷毛小鼠部分生长发育指标 [J].中国比较医学杂志, 2013, 23(11):36-39.
[3] Basta PV, Whitmore SP, Basham KB, et al.Microsatellite analysis in FVB/N mice [J].Comp Med, 2004, 54(5): 524-527.
[4] Katoh H, Yoshino S, Inui Y, et al.Microsatellite genotyping for genetic quality testing using sperm cells in the mouse [J].Exp Anim, 2005, 54(4): 373 - 376.
[5] 陈振文, 欧阳兆和, 董罡, 等.用微卫星标记技术对国内BALB/c小鼠遗传质量的分析 [J].遗传, 2004, 26(6): 845-848.
[6] 王纯耀, 杨卫红, 宋国英, 等.微卫星DNA 在近交系小鼠遗传监测中的应用 [J].中国兽医学报, 2008, 28(3): 333-335.
[7] 崔智, 李晓娟, 白云峰, 等.PLCε基因敲除小鼠微卫星DNA遗传监测分析 [J].中国比较医学杂志, 2012, 22(10): 19-22.
[8] Nitzki F, Kruger A, Reifenberg K, et al.Identification of a genetic contamination in a commercial mouse strain using two panels of polymorphic markers [J].Lab Anim, 2007, 41(2): 218 -228.
[9] 范涛, 王洪, 魏杰, 等.不同来源高度免疫缺陷小鼠微卫星DNA遗传检测的分析 [J].中国比较医学杂志, 2016, 26(8): 91-95.
[10] Dietrich WF, Miller J, Steen R, et al.A comprehensive genetic map of the mouse genome [J].Nature, 1996, 380(6570): 149-152.
[11] Morin PA, Wallis J, Moore JJ, et al.Paternity exclusion in a community of wild chimpanzzees using hypervariable simple seqence repeats [J].Mol Ecol, 1994, 3(5): 469-477.
[12] 倪丽菊, 赵丽亚, 赵立虎, 等.利用多重荧光STR技术分析上海地区7品系常用近交系小鼠核心群的遗传特性[J].中国实验动物学报, 2016, 24(1): 72-79.
[13] 仇志华, 王冬平, 李瑞生, 等. BALB/c突变无毛小鼠研究概况 [J]. 实验动物科学与管理, 2004, 21(3): 42-46.
[14] 李晓娟, 李硕, 白冰珂, 等. BALB/c突变卷毛小鼠皮肤组织结构的分析 [J]. 中国比较医学杂志, 2014, 24(4): 47-50, 4.
[15] 李瑞生, 李晓娟, 汤紫荣, 等. BALB/c突变卷毛小鼠血液学指标的检测分析 [J]. 中国比较医学杂志, 2014, 24(11): 41-44.

