玉米中β-D-葡萄糖苷酶活性测定条件的研究
王天亮,柯 野,谢 璐,唐新莲,2*
(1.广西大学 农学院,广西 南宁 530005; 2.亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004)
β-D-葡萄糖苷酶(β-D-glucosidase,EC3.2.1.21),又称β-D-葡萄糖苷葡萄糖水解酶,别名龙胆二糖酶、纤维二糖酶(cellobias,CB或β-G)和苦杏仁苷酶,属于纤维素酶类,是纤维素分解酶系中的重要组成成分,能够水解结合于末端非还原性的β-D-葡萄糖键,同时释放出β-D-葡萄糖和相应的配基。β-D-葡萄糖苷酶广泛存在于自然界中,它可以来源于植物、微生物,也可来源于动物,其中β-D-葡萄糖苷酶的植物来源有人参、大豆、玉米等[1-2]。
异羟肟酸类化合物(2, 4-二羟基-2H-1, 4-苯并噁嗪-3(4H)-酮,也称氧肟酸)是禾本科植物重要的次生代谢产物,是一类与植物抗菌、抗虫和化感作用有关的植物次生代谢物[3-4]。唐新莲等[5]研究表明,玉米根、茎、叶器官中均含有异羟肟酸,且铝诱导的根系分泌异羟肟酸类物质可能是一些耐铝玉米品种抵御铝毒害的一种机制。丁布(DIMBOA,2, 4-二羟基-7-甲氧基-1, 4-苯并噁嗪-3-酮)是玉米中最丰富的异羟肟酸类物质,在玉米抗性中起到重要作用[3]。门布(MBOA,6-甲氧基-3-苯并噁啉-3-酮)也是玉米中另一种重要的异羟肟酸类物质[6]。而β-D-葡萄糖苷酶(β-D-glucosidase)在丁布葡萄糖苷(DIMBOA-Glu)水解为有活性的糖苷配基-DIMBOA的过程中起着非常重要的作用,是DIMBOA合成的关键酶[7-9]。所以β-D-葡萄糖苷酶作为丁布合成关键酶对探明玉米耐性(如耐铝性等)新机制具有重要意义。
目前β-D-葡萄糖苷酶活性的测定方法主要有3种:一是Barush和Swiain法;二是萤光法;三是以对硝基苯-β-D-葡萄糖苷(pNPG)为底物的分光光度法比色测定[10]。由于β-D-葡萄糖苷酶与pNPG作用释放出来的对硝基苯可用分光光度法在400~420 nm处测定,具有方法简单、反应快速、反应活性大等优点,目前被广泛采用[11-12]。但不同来源的β-D-葡萄糖苷酶的氨基酸序列、分子量等差异比较大,其与pNPG作用时的最适pH值、pH值稳定性范围、最适反应温度和热稳定性范围上均有很大差别[13]。江昌俊等[10]以对硝基β-D-葡萄糖苷为底物,对茶叶中β-D-葡萄糖苷酶活性测定条件进行了研究,结果表明,粗酶提取液底物浓度为10 mmol·L-1,在49 ℃条件下反应120 min能得到最大的光吸收值。董尚胜等[12]试验表明,茉莉花中采用37 ℃、反应时间在8 h之内,结果具有稳定性,其中反应底物的浓度10 mmol·L-1,缓冲液pH 值5.5,测定波长为405 nm[11]。车建美等[12]对尖孢镰刀菌中的β-D-葡萄糖苷酶活性测定结果表明,当温度为50 ℃、pH值 5.0、底物浓度达到 4 mmol·L-1、反应时间为l6 min时,酶活力达到最大。目前,有关以对硝基苯酚-β-D-葡萄糖苷为底物进行酶解来测定玉米β-D-葡萄糖苷酶活性的适宜条件尚未建立。本文以玉米品种泰玉11号为研究材料,研究玉米植株中β-D-葡萄糖苷酶测定的最佳条件,包括反应底物的浓度、缓冲液pH值、反应温度和时间等对β-D-葡萄糖苷酶活性的影响,建立快速准确的β-D-葡萄糖苷酶活性的检测方法。
1 材料与方法
1.1 供试材料
玉米品种为泰玉11号,种子经消毒浸种12 h并催芽露白后于光照培养箱中培养,光强度为12 000 lx左右,设置白天14 h,温度为28 ℃,晚上10 h,温度为20 ℃,湿度为70%,取玉米叶片作为试验材料。
所用试剂有0.2 mol·L-1磷酸氢二钠-0.1 mol·L-1柠檬酸缓冲溶液,1 mol·L-1Na2CO3,对硝基苯酚,不同浓度的pNPG。
仪器设备有万分之一电子天平、恒温水浴锅、高速离心机、分光光度计。
1.2 试验方法
1.2.1 粗酶提取
取玉米样品0.5 g于冰冻的研钵中,加入等重的PVP,加入5 mL 0.2 mol·L-1磷酸氢二钠-0.1 mol·L-1柠檬酸缓冲溶液,冰浴研磨至匀浆,转移至10 mL离心管中,10 000 r·min-14 ℃离心10 min,取其上清液作为反应的酶液备用。
1.2.2 β-D-葡萄糖苷酶活性测定
参考车建美等[12]的酶测定方法略作修改。取0.1 mL适度稀释的酶液,加入0.9 mL的0.2 mol·L-1磷酸氢二钠-0.1 mol·L-1柠檬酸缓冲溶液,在恒温水浴锅中预热一定时间,加入已预热10 min的pNPG底物溶液1 mL,10 min后立即加入1 mol·L-1Na2CO3溶液1 mL终止反应,室温放置5 min,测定消光值D。以加热失活的酶液按同样方法处理作空白对照。
酶活单位定义为每1 mL酶液1 min水解1 μmol·L-1pNPG的酶活力为一个酶活单位U。
酶活计算公式:酶活性=(Y×V2×V)/(K×V1×M×T)。
其中:K为 对 硝 基 苯 酚 标 准 曲 线 的斜率;V为提取酶液总量(mL);Vl为反应体系中酶液量(mL);V2为反应液总量(mL);M为样品鲜重(g);Y为酶促反应的吸光值;T为反应的时间(min)。
对硝基苯酚标准曲线的绘制。称取55.664 mg标准物对硝基苯酚,以蒸馏水溶解定容至1 L容量瓶中,此溶液的浓度为400 μmol·L-1。然后以1 mol·L-1Na2CO3溶液作为溶剂,吸取10 mL 400 μmol·L-1的对硝基苯酚溶剂稀释至100 mL,此时溶液浓度为40 μmol·L-1,以此溶液为准,进行等比稀释,分别得到浓度为20、10、5、2.5 μmol·L-1对硝基苯酚标准溶液,以1 mol·L-1Na2CO3溶液作为空白对照,按照酶测定波长进行测定,得到每个浓度对应的吸光值D,然后以浓度为横坐标,以吸光值为纵坐标,绘制标准曲线。
1.2.3 试验设置
特征吸收波长的确定。用1 mol·L-1Na2CO3溶液配制20 μmol·L-1对硝基苯酚溶液,然后利用分光光度计中光谱扫描在波长390~420 nm每隔2 nm波长扫描,以确定对硝基苯酚的最大吸收峰的波长。
缓冲溶液pH值的确定。配制pH值分别为3.6、4.0、4.4、4.8、5.2、5.6、6.0、6.4的0.2 mol·L-1磷酸氢二钠-0.1 mol·L-1柠檬酸缓冲溶液,用其提取β-D-葡萄糖苷酶,以确定适合的pH值。
反应底物浓度的选择同。采用试验得到的最适pH值的缓冲溶液,分别加入1 mL浓度为2.5、5、10、20、40 mmol·L-1的底物pNPG溶液,反应温度45 ℃,其他反应条件同上述测定方法保持一致,在试验得到的最适吸收波长下测定β-D-葡萄糖苷酶活性,最终根据酶活选择反应底物的浓度。
反应时间和反应温度的选择。采用试验得到最适pH值的缓冲溶液,以及最适底物pNPG溶液浓度,设定反应温度分别为35、40、45、50、55、60 ℃,反应时间分别为10、20、30、40 min,其他条件与上述测定方法保持一致,在试验得到的最适吸收波长处测定消光值D,以确定最适温度与时间组合。
2 结果与分析
2.1 对硝基苯酚标准曲线
绘制对硝基苯酚标准曲线,以对硝基苯酚浓度为横坐标,以消光值D为纵坐标,绘制标准曲线,如图1。标准曲线为y=0.019x-0.002,相关系数r2=0.999,对硝基苯酚与消光值成线性关系,因此样品中β-D-葡萄糖苷酶水解底物(β-D-葡萄糖苷,简称pNPG)生成的对硝基苯酚量可以根据生成的对硝基苯酚的吸光值从标准曲线中计算得出。
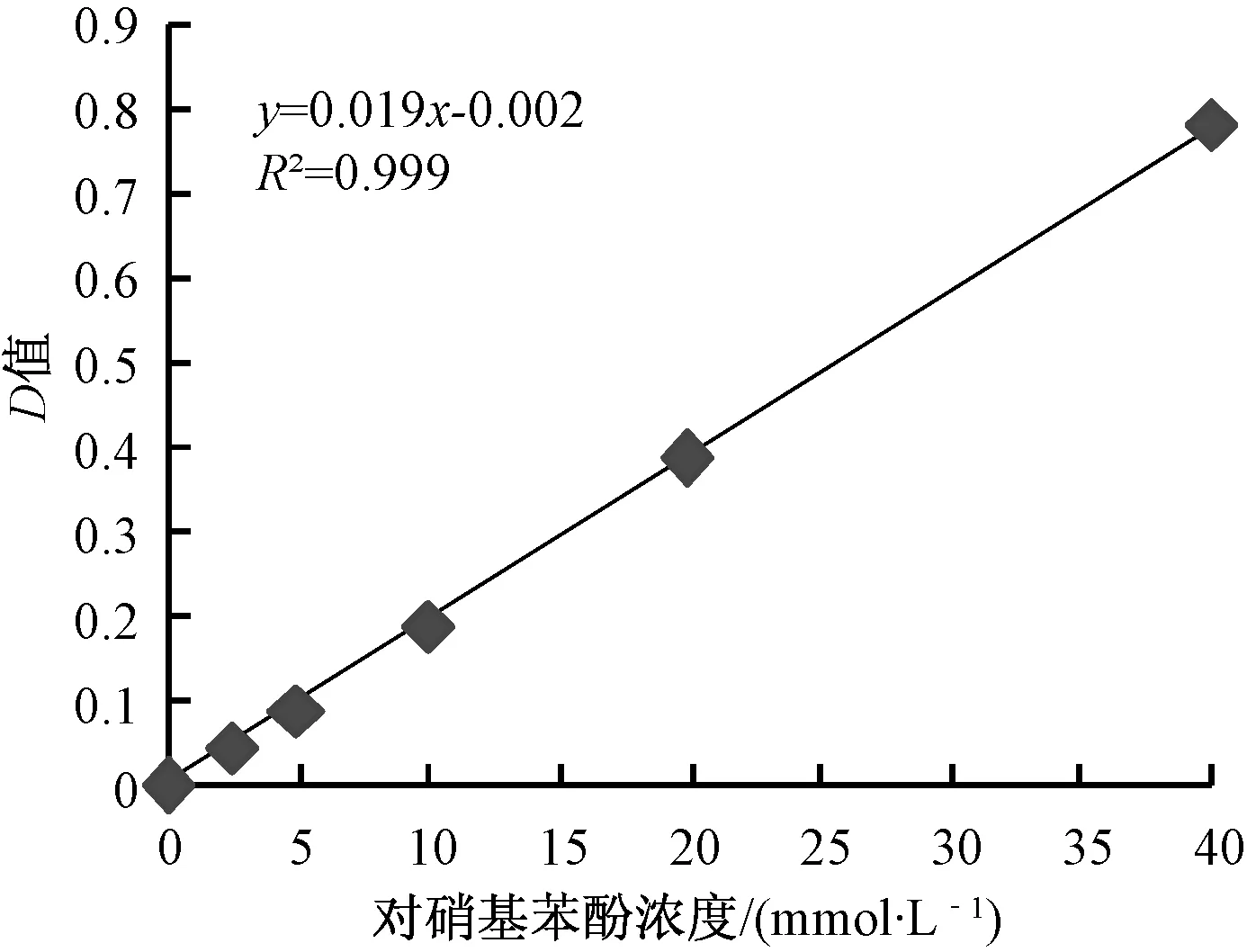
图1 对硝基苯酚光密度标准曲线
2.2 吸收波长的选择
图2为20 μmol·L-1的对硝基苯酚溶液在390~420 nm可见光范围内的光谱扫描结果。从图中可以看出,对硝基苯酚在390~420 nm可见光范围内有特征吸收峰值,且在402 nm处有最大吸收值,因此402 nm是最适测定波长。

图2 对硝基苯酚波长扫描
2.3 缓冲液pH值对酶活性的影响
每种酶都有其最适pH值,且在不同的植物中其最适pH值有所差异,酶在最佳pH值时能够表现出最大的酶活力。图3为不同pH值缓冲液对酶提取和酶测定的影响。从图3可见,在其他条件保持一致的情况下,用pH值分别为3.6、4.0、4.4、4.8、5.2、5.6、6.0、6.4的0.2 mol·L-1磷酸氢二钠-0.1 mol·L-1柠檬酸缓冲溶液提取和测定β-D-葡萄糖苷酶酶活性时,当缓冲液pH值为4.8时,β-D-葡萄糖苷酶酶活性表现最高,因此缓冲液pH值 4.8是提取和测定β-D-葡萄糖苷酶的最佳pH值。

图3 缓冲液pH对β-D-葡萄糖苷酶活性的影响
2.4 底物浓度对β-D-葡萄糖苷酶酶活性的影响
酶反应体系中底物与酶浓度比值影响着酶反应速度。本试验为了确定玉米中β-D-葡萄糖苷酶的反应底物浓度,设置了一系列pNPG底物浓度分别与酶反应,结果如图4。从图4中可见,在底物浓度为2.5~10 mmol·L-1时β-D-葡萄糖苷酶的酶活性随着底物浓度的增加而增加,当底物浓度达到20 mmol·L-1时,酶活性不再增加,表明当反应底物浓度为10 mmol·L-1时已经达饱和,因此10 mmol·L-1为底物pNPG(对硝基苯β-D-葡萄糖苷)的最佳反应浓度。
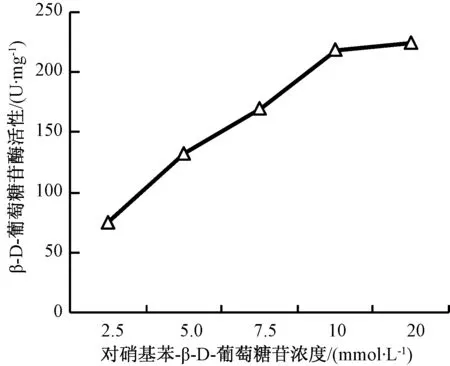
图4 底物浓度对β-D-葡萄糖苷酶活性的影响
2.5 反应时间和反应温度对β-D-葡萄糖苷酶酶活性的影响
在酶的催化作用中,反应温度会影响着酶的反应速度。从图5中可以看出,随着酶促反应时间的延长,各温度的酶活呈上升趋势。其中温度为40 ℃的酶活性上升速度快,温度为30和50 ℃的酶活上升速度最缓慢,而温度为35和45 ℃酶反应速度居中。酶促反应时间为10 min时,各温度下的β-D-葡萄糖苷酶活性差异不大,当反应时间为20 min时,酶促反应温度为40 ℃时酶活性最大且与其他温度的酶活差异大,随着反应时间的增加,温度为40 ℃的酶活不断与其他各温度下的酶活差距越来越大,当反应时间达到50 min时,酶活差距最大,因为反应温度为40 ℃、反应时间 40 min之前的酶活性与时间线性好。可见最适反应温度和反应时间的组合为40 ℃与40 min,是玉米β-D-葡萄糖苷酶活性测定的最佳温度和时间组合。
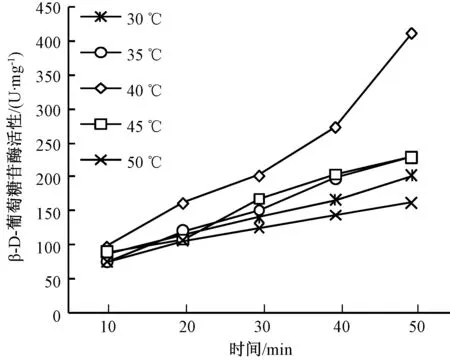
图5 反应温度和反应时间对β-D-葡萄糖苷酶活性
3 讨论
β-D-葡萄糖苷酶是玉米植株中丁布合成的关键酶,而丁布是玉米抗虫、抗病的重要次生代谢物质。目前测定β-D-葡萄糖苷酶活性的方法大多用分光光度法,但不同来源的β-D-葡萄糖苷酶与pNPG作用时的最适pH值、pH值稳定性范围、最适反应温度和热稳定性范围上均有很大差别。茶叶[10]、茉莉花[11]、尖孢镰刀菌中[12]等β-D-葡萄糖苷酶活性的测定已见报道,但条件控制各有不同。本研究关于对硝基苯酚在390~420 nm可见光范围内有特征吸收峰值的扫描结果表明:对硝基苯酚在402 nm处有最大吸收值,因此402 nm是最适测定波长。另外,本试验通过缓冲液pH值、底物浓度、反应时间和反应温度对酶活性影响的系列试验得出:当反应温度为40 ℃、反应时间为40 min、缓冲液pH值为4.8、反应底物pNPG的浓度为10 mmol·L-1、测定波长为402 nm时,β-D-葡萄糖苷酶的活力达最大。
[1] 车建美, 李芳, 刘波. 淡紫拟青霉培养过程中酶及可溶性蛋白的变化[J]. 武夷科学, 2005(1): 1-6.
[2] WOODWARD J, WISENMAN A. Fungal and other β-glucosidases:Their properties and application[J]. Enzyme Microbial Technology, 1982, 4: 73-79.
[3] WAHLROOS O, VIRTANEN A I. The precursors of 6-methoxy-benozxoazlinone in maize and wheat plants:Their isolation and some of their porperties[J]. Acta Chemica Scandinavica, 1959,13:1906-1908.
[4] ARGANDA V H, CORCUERA L J. Distribution of hydroxamic acids inZeamaystissues[J]. Phytochemistry, 1985, 24(1): 177-185.
[5] 唐新莲, 郭添香, 高小凤, 等. 玉米异羟肟酸类物质的分泌与其耐铝性的关系[J].生态环境学报, 2015, 24(4): 547-553.
[6] XIE Y S, ARNASON J T, PHILOGENE B J R. Distribution and variation of cyclic hydroxamic acids and compounds in maize (Zeamays) root system [J]. Canadian Journal of Botany-revue Canadienne De Botanique, 1991, 69(3): 677-681.
[7] BABCOCK G D, ESEN A. Substrate specificity of maize β-glucosidase[J]. Plant Science, 1997, 101(1): 31-39.
[8] SUE M, ISHIHARA A, IWAMURA H. Purification and characterization of a β-glucosidase from rye(SecalecerealeL.) seedlings [J].Plant Science, 2000, 155(1): 67-74.
[9] POSCHENRIEDER C, TOLRA R, BARCELO J. A role for cyclic hydroxamates in aluminium resistance in maize[J]. Journal of Inorganic Biochemistry, 2005, 99(9): 1830-1836.
[10] 江昌俊, 李叶云.茶叶中β-D-葡萄糖苷酶活性测定条件的研究[J].安徽农业大学学报, 1999, 26 (2): 212-215.
[11] 董尚胜, 童启庆, 渡边修治, 等.茉莉花中β-D-葡萄糖苷酶活性测定条件的探讨[J].福建茶叶, 1997(4): 23-25.
[12] 车建美, 刘波, 朱育菁, 等.尖孢镰刀菌中β-D-葡萄糖苷酶活性测定条件的研究[J].江西农业大学学报, 2006, 28(1): 126-128.
[13] 王志江, 魏红福.β-葡萄糖苷酶的研究[J].饲料工业, 2006, 27(22): 20-22.

