药用植物细叶石仙桃内生细菌的分离和分子鉴定
詹昕烨
(台州市第一中学,浙江 台州 318000)
兰科(Orchidaceae)是高等植物的第二大科,在全球各地均有分布,约有700属20 000余种,其中蝴蝶兰(Phalaenopsisaphrodite)、铁皮石斛(Dendrobiumofficinale)、大花无柱兰(Amitostigmapinguiculum)、长瓣兜兰(Paphiopedilumdianthum)和细叶石仙桃(Pholidotacantonensis)等多个物种是著名的药用植物和观赏性珍贵花卉[1]。细叶石仙桃隶属兰科石仙桃属(Pholidota),又名小石仙桃、果上叶和岩豆等。全草均可入药,具有清热凉血、滋阴润肺和消肿止痛等功效[2-3]。内生菌一词最早由De Bary[4]提出,指生活在健康植物组织内的微生物,包含内生真菌、内生细菌和放线菌等。100多年前,人们首次发现了植物内生菌的存在[5]。内生菌具有十分丰富的生物多样性,一种植物体内通常可分离得到数十种甚至数百种内生菌[6]。Arnold等[7]对巴拿马中部雨林2种植物叶片的内生菌进行分析,结果发现分离自83个健康叶片的内生菌多达972个形态学种。
植物内生细菌是一类在植物组织内部生存,对宿主没有伤害的微生物,对植物的生长发育有一定促进作用,尤其对种子萌发、增强植株抗逆性有较好的生物学功能,在兰科植物生活史中具有不可忽视的作用[8-9]。细菌进入植株体内的方式有很多,其中,植物的气孔、皮孔和伤口等处都是入宿的通道[10-11]。经多年研究发现,感染内生细菌的植物往往比未感染的植株具有更强的适应性,对环境胁迫的抗逆性强、他感作用强,且生长速度快,产量高。陈丽梅等[12]对甘蔗(Subtrib saccharinae)体内的重氮营养醋杆菌进行研究,发现甘蔗吸收的氮素80%可能来自生物固氮,只有少数来自人工施加的化学氮肥。潘丽晶等[13]对蝴蝶兰(Phalaenopsisaphrodite)根部内生细菌进行研究,发现蝴蝶兰根内生长着可分泌吲哚乙酸(indole-3-acetic acid,IAA)的内生细菌。这些实验也证明了植物内生细菌具有增强对必需元素的吸收和产生植物促生物质等功能,解释了植物生长速度加快的原因。近年来,对植物内生细菌的研究报道较多,但有关细叶石仙桃内生细菌的研究尚未见报道。本实验以细叶石仙桃为研究对象,在分离内生细菌的基础上,采用分子生物学方法进行鉴定。
1 材料与方法
1.1 材料
细叶石仙桃样品采自乐清雁荡山、临海白岩山和黄岩划岩山,剪取假鳞茎带回实验室,用大量自来水冲洗后备用。
1.2 方法
1.2.1 内生细菌分离与培养
内生细菌分离采用组织块分离法:在超净工作台上,先用大量的无菌水冲洗,再用75%乙醇擦拭,用无菌滤纸吸干表面残留的液体;用无菌刀片将假鳞茎切成小块,置于无菌研钵中,加入5 mL无菌水充分研磨,取500 μL研磨液于10 mL无菌离心管中,加入无菌水稀释至3 mL,摇匀后备用。
内生细菌培养:用微量移液器吸取8 μL稀释液,均匀涂布于LB固体培养基上;将培养皿进行封口并做好标记;28 ℃恒温培养箱中倒置培养,每隔12 h观察1次并拍照记录细菌生长情况。
1.2.2 内生细菌16S rDNA序列的PCR扩增
挑取内生细菌的单菌株,接种到LB液体培养基中,在28 ℃恒温摇床中200 r·min-1振荡培养12 h后用作PCR模板。PCR引物采用细菌16S rDNA通用引物27F:5′-AGAGTTTGATCCTGG CTCAG-3′和1492R:5′-GGTTACCTTGTTACGACTT-3′[14]。反应体系为:10 × PCR Buffer 2.0 μL,dNTPs 0.5 μL,27F和1492R引物各0.4 μL,菌液模板0.5 μL和TaqDNA聚合酶0.4 μL,最后加入适量ddH2O至总体积20 μL。PCR反应程序为:95 ℃ 5 min;95 ℃ 30 s,51 ℃ 30 s,72 ℃ 1 min,共循环32次;72 ℃ 10 min。PCR产物进行1.0%琼脂糖凝胶电泳。选取条带亮度高且清晰的产物测序,引物合成与序列测序委托生工生物工程(上海)股份有限公司完成。
1.2.3 革兰氏阴、阳性鉴定
以安徽省巢湖市弘慈医疗器械有限公司生产的革兰氏染色液为鉴定试剂,对内生细菌进行革兰氏阴阳性鉴定[15-16]。具体步骤为:取洁净载玻片数张,平放桌上,取一环需要鉴定的菌液涂布成1个直径1.0~1.5 cm的圆形涂片,自然干燥;将Ⅰ液滴加在细菌涂片上,染色1 min后用蒸馏水洗去多余染料;滴加Ⅱ液,1 min后用蒸馏水洗去多余染料;滴加Ⅲ液脱色30 s,水洗;滴加Ⅳ液复染1 min,用蒸馏水洗去多余染料,自然干燥后镜检。若细菌呈蓝紫色则为革兰氏阳性菌,呈红色则为阴性细菌[17]。
1.2.4 数据分析
根据内生细菌16S rDNA测序结果,与NCBI数据库序列进行相似性比对分析,确定菌株的种属[18]。
2 结果与分析
2.1 内生细菌的分离培养
将内生细菌菌液均匀涂布到LB固体培养基,于28 ℃恒温培养箱内培养,每隔24 h观察1次细菌的生长情况。结果显示,LB固体培养基上出现的单菌落颜色、大小和生长速率均有差异;菌落光滑、凸起,且生长速度快。由雁荡山采集的材料内生细菌生长迅速,菌落间存在颜色和生长速度的差异(图1)。白岩山和划岩山细叶石仙桃内生细菌观察到类似的现象,也发现了大小不一的金黄色、淡黄色和白色的菌落。
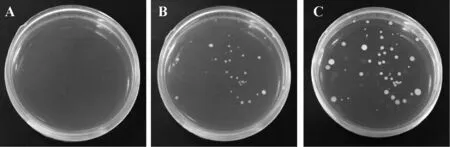
A为0 h;B为24 h;C为48 h图1 雁荡山细叶石仙桃内生细菌的生长动态
2.2 内生细菌的革兰氏染色
采用革兰氏染色法对细叶石仙桃内生细菌进行鉴定,染色结果表明:所有供试材料分离得到的73个内生细菌革兰氏染色结果均呈现红色,表明从细叶石仙桃假鳞茎中分离得到的内生细菌都是革兰氏阴性菌。同时在油镜下对细菌形态特征进行观察,发现雁荡山1~20号内生细菌均呈长杆状,初步鉴定1~20号菌为杆菌。经镜检,白岩山和划岩山细叶石仙桃内生细菌也均为杆菌。
2.3 内生细菌16S rDNA序列的克隆
以内生细菌菌液为DNA模板,采用细菌16S rDNA通用引物27F和1492R进行PCR反应,产物进行凝胶电泳检测。结果表明,所有内生细菌样品均可扩增出大小约为1 500 bp的PCR产物(图2)。电泳条带单一、清晰且亮度大,可用于后续的测序实验。
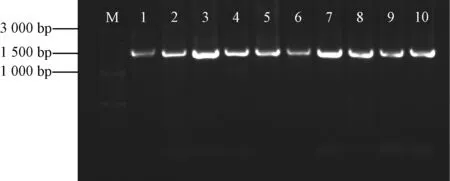
M为100 bp DNA标准分子量;1~10为内生细菌的PCR产物图2 雁荡山细叶石仙桃部分内生细菌16S rDNA的PCR扩增结果
2.4 内生细菌的序列分析
根据测序结果,利用Blast在线工具(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对来自雁荡山、白岩山和划岩山73个内生细菌的16S rDNA序列进行比对,以序列匹配度98%为最低指标确定种属。结果表明:雁荡山和白岩山细叶石仙桃中均分离得到9种内生细菌,划岩山的样品分离得到11种内生细菌。73个单菌株隶属9个属,分别为果胶杆菌属(Pectobacterium)、克雷伯氏菌属(Klebsiella)、泛菌属(Pantoea)、科泽氏菌属(Koserella)、藤黄色杆菌属(Koserella)、肠杆菌属(Enterobacter)、假单胞菌属(Pseudomonas)、类芽孢杆菌属(Paenibacillus)和芽孢杆菌属(Bacillus)(表1)。芽孢杆菌属的种类最多,有3种,分别为巨大芽孢杆菌、地衣芽孢杆菌和韦氏芽孢杆菌;类芽孢杆菌属和假单胞菌属次之,各为2种,分别是胶质类芽孢杆菌与多粘类芽孢杆菌、斯氏假单胞菌与栖稻假单胞菌。杓兰果胶杆菌、产酸克雷伯菌、雷金斯堡预研菌、藤黄色杆菌、肠杆菌和斯氏假单胞菌在3个样地采集到的细叶石仙桃内均有分布。

表1 不同地理来源的细叶石仙桃内生细菌的 种类分布
注:+ 表示有,-表示无。
3 讨论
目前,在各种植物中发现的内生细菌已超过54个属120多种[19]。朱育菁等[20]在无患子科(Sapindaceae)龙眼(Dimocarpuslongan)果实内分离到肠杆菌属、果胶杆菌属、克鲁沃菌属(Kluyvera)和沙门氏杆菌属(Salmonella)等内生菌。内生细菌中,大多数内生细菌为土壤微生物种类,其中假单胞菌属、芽孢杆菌属、肠杆菌属以及土壤杆菌属(Agrobacterium)最为常见[19]。本实验从细叶石仙桃体内分离得到假单胞菌属、芽孢杆菌属、肠杆菌属、果胶杆菌属、产酸克雷伯菌和成团泛菌等多种细菌种属。假单胞菌属、芽孢杆菌属、肠杆菌属还有伯克霍尔德氏菌属(Burkholderia)等是多种林木植物的解磷细菌[21-23]。杓兰果胶杆菌也是一种解磷细菌,可通过自身的代谢活动将土壤基质中难溶的磷元素转化为可溶性磷,利于植物吸收从而提高产量[24]。王舒等[25]从油茶(Camelliaoleifera)中分离到杓兰果胶杆菌等3种细菌,对其解磷能力进行试验,结果显示,筛选得到菌株的解磷能力都较高,可有效提高油茶对磷的利用率。
生物固氮可为农业提供经济价值高、对环境无污染的氮肥,是生物学领域的一项重要研究课题[26]。克雷伯氏菌属是一类固氮菌,呈革兰氏阴性[27],本实验结果与此一致。李宏伟等[28]和朱俊波[29]对克雷伯氏菌进行研究发现,其SW1菌株具有较高的固氮酶活性,HP1菌株具有较高产氢活力,通常用于制备氢燃料。陈卓君等[30]以白菜(Brassicapekinensis)、油菜(B.campestris)和玉米(Zeamays)作为研究材料,发现产酸克雷伯菌可通过固氮和产生生长素促进植物生长。冯永君[31]初步发现成团泛菌YS19可利用光合作用固定的有机碳源和能量进行代谢来固定大气中的游离氮气,促使植物更好生长。本研究中,在3个样点的细叶石仙桃中均分离到产酸克雷伯氏菌,它是否具有固氮作用,尚待进一步研究。
假单孢菌属细菌在植物病害的生物防治上有着广泛应用。研究发现,假单胞菌能在代谢反应中产生多种抗菌产物,可有效抵御病原细菌、真菌和线虫等微生物,部分产物还具杀虫功能,可替代农药试剂,提升植物的抗病能力,在保护生态环境方面也有潜在价值[32-34]。朱玥妍等[35]对芽孢杆菌属的多种菌进行研究分析,提出芽孢杆菌可作为生防菌剂,其中,地衣芽孢杆菌(B.lincheniformis)对番茄(Lycopersiconesculentum)、棉花(Ginkgobiloba)和辣椒(Capsicumannuum)等多种植物的病害有防治功能,如番茄灰霉病和棉花枯萎病等[36-37]。韦氏芽孢杆菌在生物防治方面也有较好的前景,对马铃薯(Solanumtuberosum)坏疽病、枯萎病和炭疽病等也均具防治效果,而且还有溶磷和固氮作用[38]。张淑梅等[39]从番茄叶片中分离筛选到具广谱抑真菌活性的类芽孢杆菌,其对水稻(Oryzasativa)恶苗病菌有明显的拮抗抑制作用。本研究中,分离到胶质类芽孢杆菌、多粘类芽孢杆菌、巨大芽孢杆菌、地衣芽孢杆菌和韦氏芽孢杆菌等芽孢杆菌,胶质类芽孢杆菌为雁荡山细叶石仙桃所特有,韦氏芽孢杆菌为划岩山样品所特有,今后将进一步研究它们的功能。
研究表明,植物内生细菌易在细胞或组织的间隙形成聚集群落,便于吸收营养物质,也避免环境威胁,保证了生存环境的适宜性[10]。内生细菌可作为联合固氮菌剂,对植物固氮起到积极作用,可分泌产生多种对植物有促生作用的激素,也可用作载体将外源基因转入宿主细胞[40-41]。许多内生细菌在非豆科植物固氮方面的作用十分显著,在溶磷和抗虫抗病等方面也有较大作用,在环境保护和农业生产中更是具有潜在的应用价值[42-43]。本实验对细叶石仙桃内生细菌进行分离与鉴定,得到果胶杆菌属、克雷伯氏菌属、泛菌属和芽孢杆菌属等多种属种,为进一步研究生物固氮、防治以及溶磷作用提供物质基础和理论支持,为进一步探索内生细菌的生物学功能和生理提供一定的基础材料。
[1] 吴应祥. 中国兰花: 第2版[M]. 北京: 中国林业出版社, 1993.
[2] 张小佳, 李旭梅, 曾建红. 细叶石仙桃的性状和显微鉴别研究 [J]. 时珍国医国药, 2016(8): 1909-1911.
[3] 汪昂. 本草备要(中医临床必读丛书)[M]. 北京: 人民卫生出版社, 2012.
[4] DE BARY A. Hofmeister’s handbook of physiological botany [M]. Engelmann: Ulan Press, 1886.
[5] 邹文欣, 谭仁祥. 植物内生菌研究新进展[J]. 植物学报(英文版), 2001, 43(9): 881-892.
[6] 秦路平. 植物内生真菌生物多样性和活性代谢产物研究(摘要)[C]//中国药学会. 第十届全国中药和天然药物学术研讨会论文集. 2009.
[7] ARNOLD A E, MAYNARD Z, GILBERT G S, et al. Are tropical fungal endophytes hyperdiverse? [J]. Ecology Letters, 2000, 3(4): 267-274.
[8] LODEWYCKX C, VANGRONSVELD J, PORTEOUS F, et al. Endophytic bacteria and their potential applications [J]. Critical Reviews in Plant Sciences, 2002, 21(6): 583-606.
[9] 李能章, 彭远义. 植物内生菌研究进展[J]. 生物技术, 2004, 14(2): 69-71.
[10] 沈丽珍, 梁峰, 王忠, 等. 马铃薯内生细菌StC01的鉴定与促生作用[J]. 江苏农业科学, 2008 (1): 143-146.
[11] 姚领爱, 胡之璧, 王莉莉, 等. 植物内生菌与宿主关系研究进展[J]. 生态环境学报, 2010, 19(7): 1750-1754.
[12] 陈丽梅, 樊妙姬. 甘蔗固氮内生菌:重氮营养醋杆菌的研究进展[J]. 微生物学通报, 2000, 27(1): 63-66.
[13] 潘丽晶, 陈继敏, 张妙彬, 等. 蝴蝶兰根内生细菌的分离及可分泌IAA细菌的筛选[J]. 中国农学通报, 2014, 30(16): 148-152.
[14] 刘琳. 温室盆栽春兰可培养内生细菌多样性研究[D]. 保定: 河北大学, 2010.
[15] 赵斌, 林会, 何绍江. 微生物学实验: 第2版[M]. 北京: 科学出版社, 2014.
[16] 龚明霞. 几种革兰氏染色方法的比较与体会[J]. 卫生职业教育, 2002, 20(5): 39.
[17] 何健民. 细菌革兰氏染色辅助鉴别技术的实验研究[J]. 现代检验医学杂志, 2003, 18(4): 38-39.
[18] 别小妹, 陆兆新, 房耀维, 等. 利用16S rDNA序列分析鉴定一株产抗菌物质的微生物菌株[J]. 食品科学, 2006, 27(11): 466-470.
[19] 姜怡, 杨颖, 陈华红, 等. 植物内生菌资源[J]. 微生物学通报, 2005, 32(6): 146-147.
[20] 朱育菁, 王秋红, 陈璐, 等. 龙眼内生菌的分离与脂肪酸鉴定[J]. 亚热带植物科学, 2008, 37(4): 22-25.
[21] 任嘉红, 刘辉, 吴晓蕙, 等. 南方红豆杉根际溶无机磷细菌的筛选、鉴定及其促生效果[J]. 微生物学报, 2012, 53(3): 295-303.
[22] 韩烁, 夏冬亮, 李潞滨, 等. 毛竹根部解磷细菌的筛选及多样性研究[J]. 河北农业大学学报, 2010, 33(2): 26-31.
[23] 王岳坤, 于飞, 唐朝荣. 海南生态区植物根际解磷细菌的筛选及分子鉴定[J]. 微生物学报, 2009, 49(1): 64-71.
[24] 张云翼, 邹碧莹. 土壤解磷细菌的研究进展[J]. 现代农业科技, 2008(15): 182-184.
[25] 王舒, 张林平, 张扬, 等. 红壤区油茶根际解磷细菌的筛选、鉴定及其解磷能力[J]. 林业科学研究, 2015, 28(3): 409-416.
[26] 史清亮, 白成云, 贾玉, 等. 抓生物固氮技术促生态农业建设[J]. 山西农经, 2001 (1): 58-61.
[27] 覃丽萍, 黄思良, 李杨瑞. 植物内生固氮菌的研究进展[J]. 中国农学通报, 2005, 21(2): 150-152.
[28] 李宏伟, 邵文尧, 刘海, 等. 固定产酸克雷伯氏菌产氢的研究[J]. 宁夏工程技术, 2007, 6(2): 119-121.
[29] 朱俊波. 产酸克雷伯氏菌(Klebsiellaoxytoca)HP1高效产氢基因工程菌的构建[D]. 厦门: 厦门大学, 2007.
[30] 陈卓君, 吴毅歆, 毛自朝, 等. 萝卜根内生产酸克雷伯克氏菌的分离鉴定及其促生长作用研究[J]. 西南农业学报, 2014, 27(4): 1645-1648.
[31] 冯永君. 水稻内生优势成团泛菌YS19对宿主侵染和定殖机制的研究[D]. 北京: 中国农业科学院, 2001.
[32] 张文, 杨志荣, 朱文, 等. 类产碱假单胞菌杀虫物质的分离纯化和鉴定[J]. 微生物学报, 1998(1): 57-62.
[33] 罗霞, 杨志荣, 朱文, 等. 类产碱假单胞菌杀虫蛋白的激光拉曼光谱研究[J]. 生物化学与生物物理进展, 2000, 27(1): 68-71.
[34] 杨海君, 谭周进, 肖启明, 等. 假单胞菌的生物防治作用研究[J]. 中国生态农业学报, 2004, 12(3): 158-161.
[35] 朱玥妍, 刘姣, 杜春梅. 芽孢杆菌生物防治植物病害研究进展[J]. 安徽农业科学, 2012, 40(34): 16635-16638.
[36] 宁幸连, 张慧杰. 奥瑞根对棉花主要病害的防治效果[J]. 农业技术与装备, 2013(18): 37-38.
[37] 唐丽娟, 纪兆林, 徐敬友, 等. 地衣芽孢杆菌W10对灰葡萄孢的抑制作用及其抗菌物质[J]. 中国生物防治学报, 2005, 21(3): 203-205.
[38] 崔月贞, 杨小利, 杨成德,等. 拮抗马铃薯晚疫病菌的高寒草地牧草内生细菌的鉴定及其生物功能测定[J]. 植物保护学报, 2016, 43(5): 789-795.
[39] 张淑梅, 沙长青, 赵晓宇, 等. 一株抗真菌内生多粘芽孢杆菌的分离鉴定及对水稻恶苗病菌的抑制作用[J]. 中国生物工程杂志, 2010, 30(2): 84-88.
[40] 杨海莲, 孙晓璐, 宋未. 植物内生细菌的研究[J].微生物学通报, 1998, 25(4):224-227.
[41] STURZ A V, CHRISTIE B R, NOWAK J. Bacterial endophytes: Potential role in developing sustainable systems of crop production [J]. Critical Reviews in Plant Sciences, 2000, 19(1): 1-30.
[42] 王卫霞. 新疆几种典型荒漠植物根际微生物特征及内生固氮菌的分离、促生性能研究[D]. 乌鲁木齐: 新疆农业大学, 2009.
[43] 周鸿宾, 郝家骐, 袁长芳, 等. 与某些非豆科植物共生的弗兰克氏菌(Frankiasp.)的泡囊及其固氮作用[J]. 植物生理学报, 1985(3): 101-104.

