隔日限食疗法对脊髓损伤大鼠的保护作用及其机制①
何宇,张安仁,孙年怡,王文春,王志强,田丽君,邹文晨,张志强
1.中国医科大学附属盛京医院康复中心,辽宁沈阳市110134;2.中国人民解放军成都总医院康复医学科,四川成都市610083
相关文献报道,全球范围内脊髓损伤的发生率为每百万人中236~4187例[1]。我国有近200万脊髓损伤患者,并且每年增长约5万人[2]。如何有效治疗脊髓损伤患者,使其最大程度获得功能的恢复和生活质量的改善,是当前医学界的研究热点和难点。饮食干预疗法可能是目前脊髓损伤多种潜在有效治疗方法中临床可行性、安全性及经济效率最好的方法之一[3]。
近十多年来,一种新饮食限制方法间断性禁食(intermittent fasting,IF)显示出有益健康的作用,并逐渐被人们接受。IF是采用常规饮食和禁食不断交换来防治某些疾病的饮食限制方案。IF并不局限于单一的方式,多采用隔日限食(every-other-day fasting,EODF),即正常饮食与禁食各24 h,交替进行,禁食期间饮水不受任何限制[4]。IF对神经系统产生有益作用的相关细胞机制包括减少氧化损伤分子的积累、细胞生物能量学改善、神经营养因子信号增强以及炎性反应减轻等[5]。有基础研究证实,IF可通过减轻脑卒中、脑外伤动物模型的炎性反应发挥神经保护作用,有助于改善神经功能缺损[4,6-10]。本实验使用医用脑血管临时动脉瘤夹建立大鼠钳夹脊髓损伤模型,观察EODF对脊髓损伤大鼠脊髓组织病理变化和运动功能恢复的影响,及其对脊髓损伤急性期肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-10(interleukin-10,IL-10)水平的影响,为进一步的机制研究奠定实验基础。
1 材料与方法
1.1 一般材料
1.1.1 实验动物
清洁级健康雌性Sprague-Dawley成年大鼠,体质量280~300 g,共216只,购自成都达硕生物科技有限公司,实验动物质量合格证号SCXK(川)2015-030,适应性喂养1周后进入实验。术前、术后分笼饲养于安静、通风、清洁的普通级动物房。实验过程中动物的饲养及处置遵循动物保护、动物福利和国家实验动物伦理的相关规定。
1.1.2 主要试剂
10%水合氯醛、无水乙醇、蒸馏水、二甲苯、中性树胶:国药集团化学试剂有限公司。4%多聚甲醛、甲苯胺蓝染色试剂:武汉谷歌生物科技有限公司。
大鼠IL-10 ELISA试剂盒:杭州联科生物技术股份有限公司。大鼠TNF-αELISA试剂盒:美国昂飞公司。
1.1.3 主要仪器和设备
Yasargil牌FT228T钛合金迷你型脑动脉瘤夹(标定力70 g)、施夹钳:德国贝朗医疗有限公司。手术显微镜:上海安信光学仪器制造有限公司。光学显微镜:上海光学仪器厂。SE-93自动蒸馏水器:上海亚荣生化仪器厂。组织包埋机:美国热电公司。切片机:赛默飞世尔科技(中国)有限公司。酶标仪:芬兰雷勃公司。
其他:持针器、血管钳、蚊式钳、眼科剪、眼科镊、玻璃分针等常规手术器械,采血针、采血管、移液枪、TIP头、EP试管、微波炉、染色缸、染色架、湿盒、载玻片、盖玻片、医用缝合针等。
1.2 实验动物分组与干预措施
1.2.1 实验1
将36只大鼠编号1~36,利用EXCEL建立一列编号1~36,在每个数字之后生成一个随机数“=RAND()”,根据所生成随机数的值进行降序排列,依次分至假手术组、假手术+EODF组、脊髓损伤组和脊髓损伤+EODF组,每组9只。两个脊髓损伤组接受脊髓损伤手术,两个假手术组仅接受椎板切除术。假手术+EODF组和脊髓损伤+EODF组术后立即开始禁食24 h(仅供饮水,下同),之后给予24 h常规食物,然后再禁食24 h,如此反复直至试验结束。
1.2.2 实验2
另外180只大鼠随机分配方法和分组同实验1,每组45只,各组又分为术后6 h、12 h、1 d、3 d、7 d五个时间点,每个时间点各9只。干预措施同实验1。
1.3 造模
采用医用脑血管临时动脉瘤夹钳夹脊髓的方法[11-14]建立大鼠脊髓钳夹损伤模型。大鼠称重,10%水合氯醛3 ml/kg腹腔注射麻醉,麻醉生效后,将大鼠俯卧固定于自制手术台上,确定T10位置。背部局部剪毛备皮,常规消毒辅巾。以T10棘突为中心点,后正中切口约3 cm,逐层切开皮肤、皮下筋膜组织以及椎旁肌,钝性分离椎旁肌肉至关节突并向两侧牵开,充分暴露T9~T11棘突和双侧椎板。用蚊式钳小心咬除T10棘突、椎板及部分T9、T11棘突和椎板,清晰暴露脊髓背侧硬膜。用持针器夹住三角针,将三角针的钝性端从硬膜与其前方的椎体之间穿至对侧,从而在两者之间形成一通道,以容动脉瘤夹通过。用施夹钳夹持住动脉瘤夹,张开瘤夹后从T10处经通道穿至对侧,确保动脉瘤夹完全横跨过脊髓,然后释放瘤夹,紧紧完全夹住脊髓。30 s后,撤去瘤夹,可见钳夹处硬膜有一条明显的血肿印记。生理盐水冲洗伤口及清除残留血液,止血后常规分层缝合伤口。假手术组除不进行夹脊髓外其余操作同脊髓损伤组。术后大鼠置于温暖环境直至完全苏醒。
术前对每只大鼠腹腔注射生理盐水5 ml,增加循环血量,预防创伤性失血所致休克而引起的死亡。术后3 d常规肌注青霉素20万IU/d。术后保持垫料清洁干燥,每天2次(8时和20时)膀胱挤压协助排尿,直至大鼠无血尿并恢复自主排尿。
1.4 观测指标
1.4.1 实验1
1.4.1.1 运动功能
应用Ohio State University 1995年发布的经典BBB行为评分法[15](Basso-Beattie-Bresnahan score,BBB score)进行行为学观察。于术前1 d及术后1 d、术后第2、4、6、8、10、12周对各组进行评分。由熟悉评分标准的2名非本组实验人员独立进行观察记录,观察人员对分组不知情。每次观察4 min,左右两侧肢体分别评分,取2名观察者的平均值作为每次记录值。
1.4.1.2 甲苯胺蓝染色
术后第12周,过量药物麻醉处死大鼠,经心脏灌流取脊髓组织。截取以损伤部位为中心的脊髓组织长10 mm,样本置于4%多聚甲醛固定过夜后,石蜡包埋,连续切片,行甲苯胺蓝染色,高倍镜下观察脊髓结构变化。
1.4.2 实验2
在术后6 h、12 h、1 d、3 d、7 d五个时间点,采集各组大鼠血清标本,采用ELISA检测血清TNF-α、IL-10水平。
1.5 统计学分析
采用SPSS 22.0进行统计学分析。采用Kolmogorov-Smirnov检验对计量变量进行正态性检验。正态分布资料以(xˉ±s)表示,组间方差齐同条件下,实验分组均数差异比较采用两因素方差分析,并采用LSD-t检验进行两两组间比较;组间方差不齐条件下,多组间比较采用Kruskal-Wallis H检验,两组间比较采用Mann-Whitney U检验。显著性水平α=0.05。
2 结果
2.1 BBB评分
术前各组大鼠BBB评分均为21分。脊髓损伤组和脊髓损伤+EODF组BBB评分在术后1 d降至最低(P<0.05),随时间逐渐增加,术后第8、10、12周,脊髓损伤+EODF组优于脊髓损伤组(P<0.05)。见表1。
2.2 脊髓组织病理变化
术后第12周,假手术组和假手术+EODF组组织形态结构正常,未见明显病理改变。脊髓蝴蝶型灰质区结构完整清晰;神经元胞浆内见琥珀斑状尼氏体;白质区神经纤维结构清晰。见图1、图2。
脊髓损伤组见脊髓蝴蝶型灰质区损伤严重,结构不清,大面积坏死脱落,神经细胞大量减少,结缔组织增生并伴有炎性细胞浸润;部分神经元细胞结构不清晰,胞浆内尼氏体结构不清;灰质区外白质区部分神经纤维结构不清。见图3。
脊髓损伤+EODF组可见脊髓蝴蝶型灰质区损伤严重,结构不清,局灶性坏死脱落,神经细胞大量减少,结缔组织增生并伴有炎性细胞浸润;存活神经元细胞结构完整,胞浆内清晰可见着色均匀琥珀斑状尼氏体;灰质区外白质区神经纤维结构不清,排列紊乱并伴有炎性细胞浸润。见图4。
2.3 血清TNF-α水平
与假手术组相比,脊髓损伤组术后12 h血清TNF-α水平升高(P<0.05),呈先升后降趋势,7 d恢复。术后1 d,脊髓损伤+EODF组血清TNF-α表达水平低于脊髓损伤组(P<0.05);术后1 d、7 d,假手术+EODF组TNF-α表达水平低于假手术组(P<0.05)。见表2。
2.4 血清IL-10水平
与假手术组相比,脊髓损伤组术后各时间点血清IL-10水平均升高(P<0.05)。术后各时间点,脊髓损伤+EODF组与脊髓损伤组间血清IL-10水平无显著性差异(P>0.05),假手术+EODF组和假手术组间血清IL-10水平无明显差异(P>0.05)。见表3。
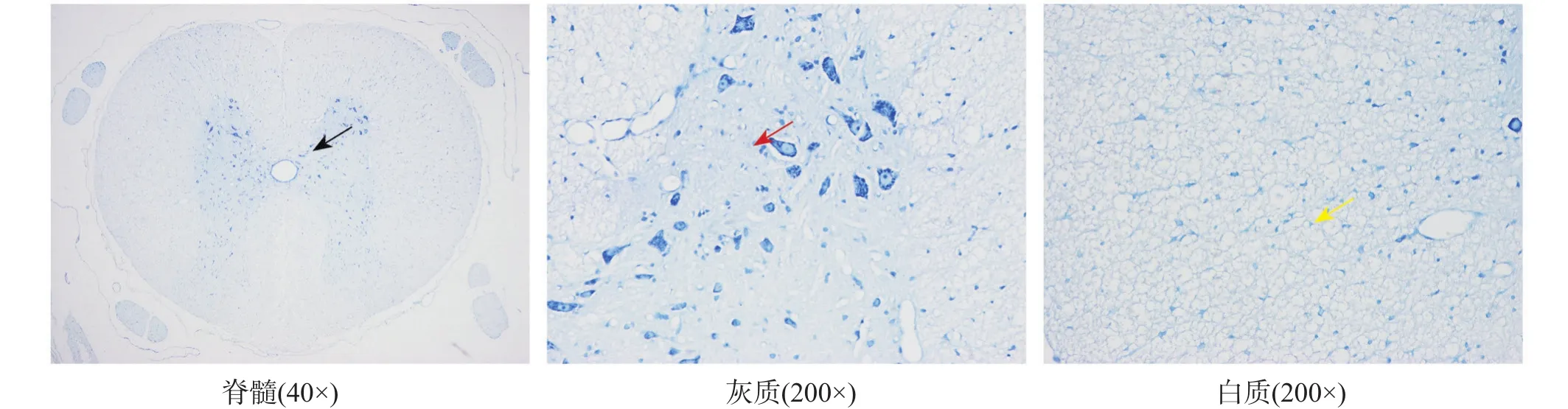
图1 术后12周假手术组脊髓组织病理形态(甲苯胺蓝染色)

图2 术后12周假手术+EODF组脊髓组织病理形态(甲苯胺蓝染色)

图3 术后12周脊髓损伤组脊髓组织病理形态(甲苯胺蓝染色)
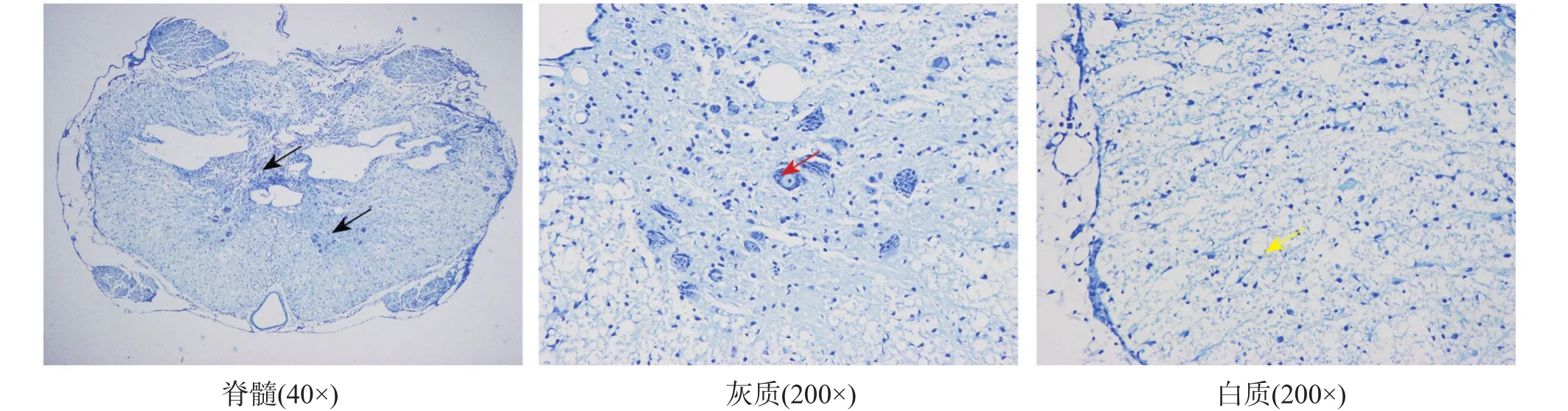
图4 术后12周脊髓损伤+EODF组脊髓组织病理形态(甲苯胺蓝染色)

表1 术后各时间点各组BBB评分比较

表2 各组大鼠术后各时间点血清TNF-α水平(pg/ml)

表3 各组术后各时间点血清IL-10水平(pg/ml)
3 讨论
脊髓损伤的病理生理过程可分为原发性损伤和继发性损伤两个阶段。原发性损伤是暴力创伤产生的瞬间脊髓组织受到的直接破坏,在这个过程中,脊髓的神经组织会立即遭受到不可逆转的永久性伤害,出现大量神经细胞死亡[16-17];继发性损伤是由原发性损伤引起的一系列细胞学和分子生物学反应,研究表明[18-22],其主要因素有出血、缺血、神经递质的累积、离子通道的开放、兴奋性毒性损伤、脂质过氧化、自由基的产生、炎性反应和细胞凋亡等。继发性损伤可出现于受伤最初的数分钟内,持续数小时到数天,甚至会超过数周到数月,这些一系列反应会进一步引起组织的破坏和损伤区域的扩大[23]。继发性损伤具有可逆性,在脊髓损伤早期采取正确及时的干预,可以保护残存的脊髓组织,减轻持续的神经损伤,可直接影响脊髓损伤患者的最终康复效果。因此,在脊髓损伤早期,以继发性损伤为目标、旨在减少病理后果的神经保护策略是脊髓损伤治疗的关键。
神经损伤后,改变饮食或代谢的治疗方法与其他疗法相比可能是侵害性最小的。这类治疗方法近年来才被应用于实验性脊髓损伤。有研究者将EODF用于治疗颈段及胸段急性脊髓打击伤大鼠,发现EODF具有显著的神经保护作用,并能有效促进损伤肢体的功能恢复[24-27]。本实验将EODF应用于T10节段大鼠钳夹型脊髓损伤模型,通过12周的行为学观察和组织学分析,结果发现,EODF能有效促进钳夹型脊髓损伤模型大鼠损伤肢体的功能恢复,具有神经保护作用
TNF-α是一种分子量为17 kDa的多肽,主要由活化的巨噬细胞、T细胞、星形胶质细胞和小胶质细胞产生。它处于炎症级联反应的中心,被称为促炎性细胞因子(proinflammatory cytokines),是许多炎症反应过程的积极参与者。现代研究发现,创伤后,患者体内TNF-α的表达水平快速上调,并与受伤严重程度呈正相关,脊髓损伤有关研究结果一致[18,28-33]。
IL-10是一种强力的抗炎性细胞因子,在炎性疾病的动物模型实验和人体试验中,研究者发现其能成功地减轻炎症并改善功能预后[34-35]。在脊髓损伤急性期,IL-10可通过抑制炎性反应达到保护神经功能的作用[36]。本实验研究发现,脊髓损伤后血清TNF-α水平显著升高,呈先升后降趋势;血清IL-10水平显著升高,说明脊髓损伤同时启动了促炎性和抗炎性细胞因子的分泌[18],与前人[37-38]的研究一致。
EODF后,脊髓损伤急性期血清TNF-α上升被抑制,IL-10并未显著下降,提示EODF对脊髓损伤后急性期炎性反应有一定抑制作用。
综上所述,长期EODF可促进脊髓损伤大鼠后肢运动功能障碍的恢复,减轻脊髓损伤后的病理损害程度,对脊髓损伤具有一定的神经保护作用。EODF对脊髓损伤急性期炎性反应的抑制作用,可能是其发挥神经保护作用的基础。
[1]Lee BB,Cripps RA,Fitzharris M,et al.The global map for traumatic spinal cord injury epidemiology:update 2011,global incidence rate[J].Spinal Cord,2014,52(2):110-116.
[2]吴周睿,朱元贵,程黎明,等.脊髓损伤与修复的关键科学问题——第81期“双清论坛”综述[J].中国科学基金,2013,27(3):147-153.
[3]Ramer LM,Ramer MS,Bradbury EJ.Restoring function after spinal cord injury:towards clinical translation of experimental strategies[J].Lancet Neurol,2014,13(12):1241-1256.
[4]Varady KA,Hellerstein MK.Alternate-day fasting and chronic disease prevention:a review of human and animal trials[J].Am JClin Nutr,2007,86(1):7-13.
[5]Mattson MP.Energy intake and exercise as determinants of brain health and vulnerability to injury and disease[J].Cell Metab,2012,16(6):706-722.
[6]Davis LM,Pauly JR,Readnower RD,et al.Fasting is neuroprotective following traumatic brain injury[J].J Neurosci Res,2008,86(8):1812-1822.
[7]Fann DY,Santro T,Manzanero S,et al.Intermittent fasting attenuates inflammasome activity in ischemic stroke[J].Exp Neurol,2014,257:114-119.
[8]Manzanero S,Erion JR,Santro T,et al.Intermittent fasting attenuates increases in neurogenesis after ischemia and reperfusion and improves recovery[J].J Cereb Blood Flow Metab,2014,34(5):897-905.
[9]Arumugam TV,Phillips TM,Cheng A,et al.Age and energy intake interact to modify cell stress pathways and stroke outcome[J].Ann Neurol,2010,67(1):41-52.
[10]Varendi K,Airavaara M,Anttila J,et al.Short-term preoperative dietary restriction is neuroprotective in a rat focal stroke model[J].PLoSOne,2014,9(4):e93911.
[11]Rivlin AS,Tator CH.Effect of duration of acute spinal cord compression in a new acute cord injury model in the rat[J].Surg Neurol,1978,10(1):38-43.
[12]von Euler M,Seiger A,Sundström E.Clip compression injury in the spinal cord:a correlative study of neurological and morphological alterations[J].Exp Neurol,1997,145(1):502-510.
[13]刘小康,徐建广,连小峰,等.大鼠钳夹式急性脊髓损伤模型的制备与评价[J].中国矫形外科杂志,2012,20(14):1318-1322.
[14]李经辉,黄辉,吴海鹰,等.钳夹型急性大鼠脊髓损伤模型的建立与评价[J].昆明理工大学学报(自然科学版),2012,37(6):67-71,75.
[15]Bsso DM,Beattie MS,Bresnahan JC.A sensitive and reliable locomotor rating scale for open field testing in rats[J].JNeurotrauma,1995,12(1):1-21.
[16]Dumont RJ,Okonkwo DO,Verma S,et al.Acute spinal cord injury,part I:pathophysiologic mechanisms[J].Clin Neuropharmacol,2001,24(5):254-264.
[17]Norenberg MD,Smith J,Marcillo A.The pathology of human spinal cord injury:defining the problems[J].J Neurotrauma,2004,21(4):429-440.
[18]Stammers AT,Liu J,Kwon BK.Expression of inflammatory cytokines following acute spinal cord injury in a rodent model[J].JNeurosci Res,2012,90(4):782-790.
[19]Carlson GD,Gorden C.Current developments in spinal cord injury research[J].Spine J,2002,2(2):116-128.
[20]席悦.利用微阵列芯片技术探究脊髓损伤的分子机制[J].中国组织工程研究,2013,17(24):4529-4538.
[21]Choo AM,Liu J,Lam CK,et al.Contusion,dislocation,and distraction:Primary hemorrhage and membrane permeability in distinct mechanisms of spinal cord injury[J].J Neurosurg Spine,2007,6(3):255-266.
[22]Mautes AE,Weinzierl MR,Donovan F,et al.Vascular events after spinal cord injury:Contributionto secondary pathogenesis[J].Phys Ther,2000,80(7):673-687.
[23]Mortazavi MM,Verma K,Harmon OA,et al.The microanatomy of spinal cord injury:a review[J].Clin Anat,2015,28(1):27-36.
[24]Jeong MA,Plunet W,Streijger F,et al.Intermittent fasting improves functional recovery after rat thoracic contusion spinal cord injury[J].JNeurotrauma,2011,28(3):479-492.
[25]刘捷.饮食干预疗法对急性脊髓损伤治疗作用的研究[J].中国骨科临床与基础研究杂志,2012,4(1):75.
[26]Plunet WT,Streijger F,Lam CK,et al.Dietary restriction started after spinal cord injury improves functional recovery[J].Exp Neurol,2008,213(1):28-35.
[27]Plunet WT,Lam CK,Lee JH,et al.Prophylactic dietary restriction may promote functional recovery and increase lifespan after spinal cord injury[J].Ann NY Acad Sci,2010,1198 Suppl 1:E1-E11.
[28]Moghaddam A,Child C,Bruckner T,et al.Posttraumatic inflammation as a key to neuroregeneration after traumatic spinal cord injury[J].Int JMol Sci,2015,16(4):7900-7916.
[29]Yang L,Jones NR,Blumbergs PC,et al.Severity-dependent expression of pro-inflammatory cytokines in traumatic spinal cord injury in the rat[J].J Clin Neurosci,2005,12(3):276-284.
[30]Kwon BK,Stammers AM,Belanger LM,et al.Cerebrospinal fluid inflammatory cytokines and biomarkers of injury severity in acute human spinal cord injury[J].JNeurotrauma,2010,27(4):669-682.
[31]Taylor AR,Welsh CJ,Young C,et al.Cerebrospinal fluid inflammatory cytokines and chemokines in naturally occurring canine spinal cord injury[J].J Neurotrauma,2014,31(18):1561-1569.
[32]UrdzíkováLM,Rùžièka J,LaBagnara M,et al.Human mesenchymal stem cells modulate inflammatory cytokines after spinal cord injury in rat[J].Int J Mol Sci,2014,15(7):11275-11293.
[33]Ishii H,Tanabe S,Ueno M,et al.IFN-γ-dependent secretion of IL-10 from Th1 cells and microglia/macrophages contributes to functional recovery after spinal cord injury[J].Cell Death Dis,2013,4:e710.
[34]Knoblach SM,Faden AI.Interleukin-10 improves outcome and alters proinflammatory cytokine expression after experimental traumatic brain injury[J].Exp Neurol,1998,153(1):143-151.
[35]Bethea JR,Nagashima H,Acosta MC,et al.Systemically administered interleukin-10 reduces tumor necrosis factor-alpha production and significantly improves functional recovery following traumatic spinal cord injury in rats[J].JNeurotrauma,1999,16(10):851-863.
[36]Genovese T,Esposito E,Mazzon E,et al.Absence of endogenous interleukin-10 enhances secondary inflammatory process after spinal cord compression injury in mice[J].JNeurochem,2009,108(6):1360-1372.
[37]Nakamura M,Houghtling RA,Macarthur L,et al.Differences in cytokine gene expression profile between acute and secondary injury in adult rat spinal cord[J].Exp Neurol,2003,184(1):313-325.
[38]Bethea JR,Dietrich WD.Targeting the host inflammatory response in traumatic spinal cord injury[J].Curr Opin Neurol,2002,15(3):355-360.

