单核细胞/高密度脂蛋白胆固醇比值在II型糖尿病患者并发肾病中的临床意义
宋小五
(河南省确山县人民医院 内分泌科,河南 驻马 463200)
糖尿病肾病(diabetic nephropathy, DN)是糖尿病常见的慢性并发症,约40%的糖尿病患者会出现DN[1],其在发达国家是终末期肾病(endstage renal disease, ESRD)的首要病因,在我国也已跃居ESRD的第2位病因,且呈逐年攀升的趋势,DN的发病机制复杂,目前尚不完全清楚,现有的治疗措施只能延缓而不能逆转DN的发展及最终导致的ESRD[1-2]。DN的预防和治疗是当今世界的一大难题[3-4]。研究发现单核细胞/高密度脂蛋白胆固醇比值(monocyte/high density lipoprotein cholesterol ratio, MHR)是一种新型的炎症反应标志物[5],而炎症反应是DN发生的重要因素[6-8],最近有国外研究显示MHR与DN发生有关[9-10],而目前国内尚无这方面的相关研究,因此,本研究的主要目的是分析MHR与白蛋白尿的关系,以及MHR在DN不同阶段的差异,阐释MHR对DN发生发展是否具有预测的价值。
1 资料与方法
软件对数据进行统计学分析。采用Kolmogorov-Smirnov法对数据进行正态性检验;正太分布的计量资料以均数±标准差(±s)表示,非正太分布的计量资料以中位数(四分位数)[M(Q1,Q3)]表示,多组计量资料组间比较采用单因素方差分析,其中两两数据比较采用SNK-q检验;中位年龄组间比较采用非参数秩和检验;计数资料以百分比(%)表示,组间比较采用χ2检验;Pearson法分析MHR与24-hour UAE及肾小球滤过率之间的相关性。P<0.05为差异有统计学意义。
1.1 一般资料
收集2015年1月-2016年11月本院诊治的II型糖尿病患者87例为研究对象,依据24-hour尿蛋白排泄量(urinary albumin excretion, UAE),将患者分为3组:正常组(22例,<30 mg)、微量组(27 例,30~300 mg)和大量组(38例,>300 mg);本研究经患者及家属知情同意,且经本院伦理委员会审议同意;感染、肾病综合征、肿瘤及血液疾病的患者排除出本研究。
1.2 方法
记录患者24 h尿白蛋白排泄量(UAE)和病历资料。病历资料主要包括性别、年龄、病程以及实验室检查数据{[实验室检查数据包括血红蛋白(hemoglobin,Hb)、白细胞计数(white blood cell,WBC)、 血 小 板 计 数(platelet,PLT)、单核细胞计数(monocyte)、血清尿素氮(blood urea nitrogen,BUN)、 肌 酐(creatinine,Cr)、白蛋白(albumin)、糖化血红蛋白A1c水平(hemoglobin A1c,HbA1c)、 总 胆 固 醇(total cholesterol,TC)、高密度脂蛋白胆固醇(highdensity lipoprotein-cholesterol,HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)、总三酰甘油(total triglyceride,TG)、C反应蛋白(C-reactive protein,CRP)、肾小球滤过率(glomerular filtration rate,GFR)和24-hour UAE][其中肾小球滤过率用肌酐清除率(creatinine clearance,CC)来表示]};统计分析3组患者临床病理学参数的差异及MHR与临床病理参数之间的相关性。
1.3 统计学方法
应用SPSS 21.0(IBM Corp., Armonk, NY, USA)
2 结果
2.1 3组患者临床病理学相关参数情况比较
3组患者性别、年龄、病程、BUN、CC、TC、TG、LDL-C、WBC、Hb、PLT、Albumin、CRP、和HbA1c比较差异均无统计学意义(P<0.05);3组患者Cr、单核细胞计数(Mon.)、HDL-C、MHR和24-hour UAE比较差异均有统计学意义(P<0.05)。多重比较结果显示,正常组与大量组Mon.水平比较差异有统计学意义(q=3.450,P<0.05);正常组与微量组Mon.水平比较差异无统计学意义(q=0.804,P>0.05);微量组与大量组Mon.水平比较差异无统计学意义(q=2.754,P>0.05);正常组与大量组高密度脂蛋白胆固醇(HDL-C)水平比较差异有统计学意义(q=5.407,P<0.05);微量组与大量组高密度脂蛋白胆固醇(HDL-C)水平比较差异有统计学意义(q=8.017,P<0.05);正常组与微量组高密度脂蛋白胆固醇(HDL-C)水平比较差异无统计学意义(q=1.982,P>0.05);正常组与微量组MHR值比较差异无统计学意义(q=0.606,P>0.05);正常组与大量组MHR值比较差异有统计学意义(q=45.190,P<0.05);微量组与大量组MHR值比较差异有统计学意义(q=47.400,P<0.05)。见表1。
2.2 87例II型糖尿病患者MHR、24-hour UAE与GFR相关性分析
87例II型糖尿病患者Pearson相关性分析结果显示:MHR与24-hour UAE之间具有正相关性(r=0.397,P<0.0001), 见 图 1;MHR 与 GFR(用CC表示)之间具有负相关性(r=-0.258,P=0.016),见图2;MHR与其它临床病理参数之间无显著的相关性。
表1 3组患者临床病理学相关参数情况比较 (±s)
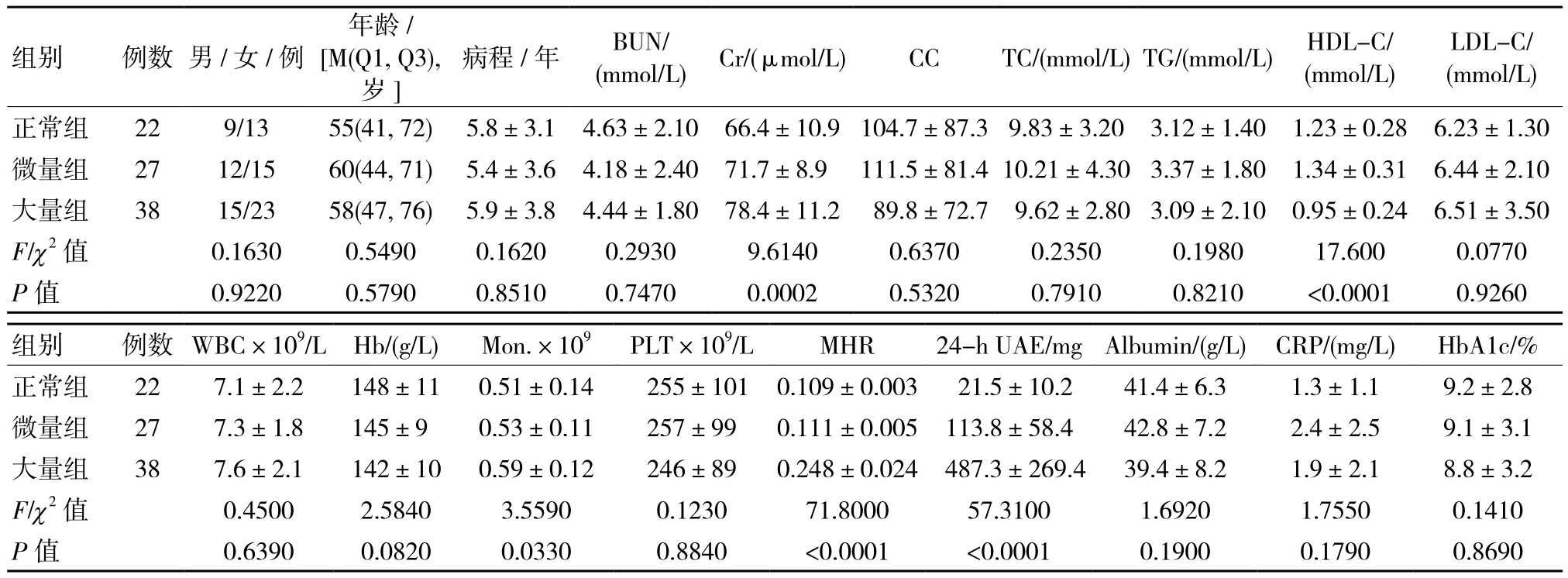
表1 3组患者临床病理学相关参数情况比较 (±s)
组别 例数 男/女/例LDL-C/(mmol/L)正常组 22 9/13 55(41, 72) 5.8±3.1 4.63±2.10 66.4±10.9 104.7±87.3 9.83±3.20 3.12±1.40 1.23±0.28 6.23±1.30微量组 27 12/15 60(44, 71) 5.4±3.6 4.18±2.40 71.7±8.9 111.5±81.410.21±4.303.37±1.80 1.34±0.31 6.44±2.10大量组 38 15/23 58(47, 76) 5.9±3.8 4.44±1.80 78.4±11.2 89.8±72.7 9.62±2.80 3.09±2.10 0.95±0.24 6.51±3.50 F/χ2 值 0.1630 0.5490 0.1620 0.2930 9.6140 0.6370 0.2350 0.1980 17.600 0.0770 P值 0.9220 0.5790 0.8510 0.7470 0.0002 0.5320 0.7910 0.8210 <0.0001 0.9260年龄/[M(Q1, Q3),岁]病程/年 BUN/(mmol/L) Cr/(μmol/L) CC TC/(mmol/L)TG/(mmol/L) HDL-C/(mmol/L)组别 例数 WBC×109/L Hb/(g/L) Mon.×109 PLT×109/L MHR 24-h UAE/mgAlbumin/(g/L) CRP/(mg/L) HbA1c/%正常组 22 7.1±2.2 148±11 0.51±0.14 255±101 0.109±0.003 21.5±10.2 41.4±6.3 1.3±1.1 9.2±2.8微量组 27 7.3±1.8 145±9 0.53±0.11 257±99 0.111±0.005 113.8±58.4 42.8±7.2 2.4±2.5 9.1±3.1大量组 38 7.6±2.1 142±10 0.59±0.12 246±89 0.248±0.024 487.3±269.4 39.4±8.2 1.9±2.1 8.8±3.2 F/χ2 值 0.4500 2.5840 3.5590 0.1230 71.8000 57.3100 1.6920 1.7550 0.1410 P值 0.6390 0.0820 0.0330 0.8840 <0.0001 <0.0001 0.1900 0.1790 0.8690
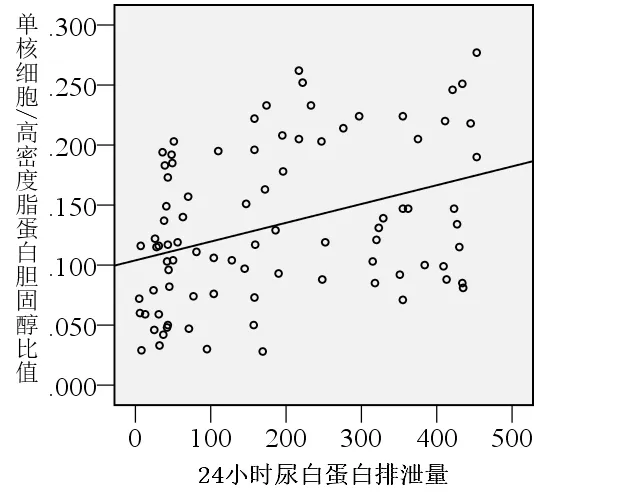
图1 87例II型糖尿病患者MHR与24-hour UAE相关性分析

图2 87例II型糖尿病患者MHR与GFR相关性分析
3 讨论
世界范围内糖尿病的发病率持续增加[11],在我国糖尿病也是一个非常严重的公共健康问题[12-13]。流行病学调查显示,1980年、1986年、流行病学调查显示,血脂异常是慢性肾病发生的危险因素[17-18],高TG和低HDL-C与肾功能不全相关[17]。在慢性肾衰竭患者中,低HDL-C与尿白蛋白排泄量(UAE)增加及肾小球滤过率(GFR)降低相关[19-20]。Ravid等[21]对574名无并发症的II型糖尿病患者的8年追踪研究显示,高血清总胆固醇水平和低血清HDL-C水平是糖尿病肾病发生的危险因素。本研究发现正常组、微组和大量组糖尿病患者血清总胆固醇水平、总三酰甘油水平和LDL-C水平比较均无显著性差异,而3组患者之间HDL-C水平有显著差异,大量白蛋白尿组的患者HDL-C水平显著低于正常白蛋白尿组和微量白蛋白尿组,此结果验证了以往的研究结论。
以往的动物实验研究发现,HDL-C降低可以1994年、2001年、2008年和2010年我国糖尿病的发病率分别为0.9%、1.0%、2.5%、5.5%、9.7%和11.6%,20年间发病率增加10倍[13]。2010年统计我国有1亿1千4百万糖尿病患者,糖尿病前期的发生率更是惊人的达到50.1%,有一半的中国成年人处于罹患糖尿病的风险中[14]。对糖尿病患者来说,微量白蛋白尿可以导致晚期肾病,使心血管疾病死亡率增加2.4倍,微量白蛋白尿是心血管疾病发生率和死亡率的重要危险因素[15]。尽管微量白蛋白尿增加糖尿病患者心血管疾病风险的机制尚未完全清楚,但炎症标志物应该是机制之一[16],研究发现炎症标志物用于评估糖尿病患者预后具有重要意义。本研究关注一个新的炎症标志物单核细胞/高密度脂蛋白胆固醇比值在糖尿病并发肾病中的意义。刺激造血干细胞特别是单核细胞系的生长,促进动脉粥样硬化斑的形成[22-23],在慢性肾衰竭的患者中,单核细胞计数增加[24-25],而HDL-C水平降低是糖尿病肾病的危险因素[21],因此糖尿病肾病患者可能同时出现单核细胞增高和HDL-C水平降低,也即单核细胞/高密度脂蛋白胆固醇比值可能升高。Kanbay等[10]研究慢性肾病的患者心血管疾病发生时首次检测了单核细胞计数与HDL-C的比值,并定义为“MHR”,结果发现作为一种炎症标志物,MHR是慢性肾病患者心血管疾病不良事件发生的独立危险因素,与患者肾小球滤过率呈负相关。本研究中笔者关注MHR在评估糖尿病患者并发肾病风险中的意义,结果表明MHR在尿白蛋白排泄量正常、微量和大量的糖尿病患者之间差异显著,Spearman相关性分析显示MHR与24 小时尿白蛋白排泄量(24-hour UAE)呈正相关,而与肾小球滤过率(GFR)呈负相关,表明MHR升高可用于评估糖尿病患者并发肾病的风险。
综上所述,在糖尿病肾病患者中MHR是一个简便经济的指标,对肾脏疾病的发生具有早期预警价值,但本研究结果还需要进一步大规模前瞻性研究的证实。
[1]张春, 颜晓勇, 杨亦彬. 外泌体与糖尿病肾病的研究进展[J].中国糖尿病杂志, 2016, 24(10): 948-950.
[2]苏宏业, 王乃尊. 糖尿病肾病治疗研究[J]. 医学综述, 2008,14(9): 1376-1378.
[3]冯烨, 张哲, 李成江. 肠促胰素在糖尿病肾病作用的研究进展 [J]. 中华糖尿病杂志, 2014, 6(10): 766-769.
[4]朱珍, 魏丽. 甲状旁腺激素相关蛋白在糖尿病肾病中的研究进展[J]. 中华内分泌代谢杂志, 2014, 30(11): 1009-1011.
[5]Canpolat U, Cetin EH, Cetin S, et al. Association of monocyte-to-HDL cholesterol ratio with slow coronary flow is linked to systemic inflammation[J]. Clin Appl Thromb Hemost, 2016, 22(5): 476-482.
[6]Duran-Salgado MB, Rubio-Guerra AF. Diabetic nephropathy and inflammation[J]. World J Diabetes, 2014, 5(3): 393-398.
[7]Barutta F, Bruno G, Grimaldi S, et al. Inflammation in diabetic nephropathy: moving toward clinical biomarkers and targets for treatment[J]. Endocrine, 2015, 48(3): 730-742.
[8]Reidy K, Kang HM, Hostetter T, et al. Molecular mechanisms of diabetic kidney disease[J]. J Clin Invest, 2014, 124(6): 2333-2340.
[9]Kahraman C, Kahraman NK, Coşgun S. Prognostic value of the monocyte/high density lipoprotein cholesterol ratio in diabetic nephropathy patients[J]. Acta Medica Mediterranea, 2016, 4(32):981-985.
[10]Kanbay M, Solak Y, Unal HU, et al. Monocyte count/HDL cholesterol ratio and cardiovascular events in patients with chronic kidney disease[J]. Int Urol Nephrol, 2014, 46(8): 1619-1625.
[11]Forouhi NG, Wareham NJ. Epidemiology of diabetes[J]. Springer New York, 2014, 92(4): 397-405
[12]Yang W, Lu J, Weng J, et al. Prevalence of diabetes among men and women in China[J]. New England Journal of Medicine, 2010,362(12): 1090-1101.
[13]Ma X, Zhang YL, Ji Q, et al. Diagnostic criteria for diabetes in China: are we pushing too much beyond evidence?[J]. Eur J Clin Nutr, 2017, 71(7): 812-815.
[14]Xu Y, Wang L, He J, et al. Prevalence and control of diabetes in chinese adults[J]. JAMA, 2013, 310(9): 948-959.
[15]Dinneen SF, Gerstein HC. The association of microalbuminuria and mortality in non-insulin-dependent diabetes mellitus. A systematic overview of the literature[J]. Arch Intern Med, 1997, 157(13):1413-1418.
[16]Rodondi N, Yerly P, Gabriel A, et al. Microalbuminuria, but not cystatin C, is associated with carotid atherosclerosis in middle-aged adults[J]. Nephrol Dial Transplant, 2007, 22(4): 1107-1114.
[17]Muntner P, Coresh J, Smith JC, et al. Plasma lipids and risk of developing renal dysfunction: the atherosclerosis risk in communities study[J]. Kidney Int, 2000, 58(1): 293-301.
[18]Schaeffner ES, Kurth T, Curhan GC, et al. Cholesterol and the risk of renal dysfunction in apparently healthy men[J]. J Am Soc Nephrol, 2003, 14(8): 2084-2091.
[19]Sun K, Lin D, Li F, et al. Discordant associations of lipid parameters with albuminuria and chronic kidney disease: a population-based study[J]. Lipids Health Dis, 2015, 14: 152.
[20]Hunsicker LG, Adler S, Caggiula A, et al. Predictors of the progression of renal disease in the modification of diet in renal disease study[J]. Kidney Int, 1997, 51(6): 1908-1919.
[21]Ravid M, Brosh D, Ravid-Safran D, et al. Main risk factors for nephropathy in type 2 diabetes mellitus are plasma cholesterol levels, mean blood pressure, and hyperglycemia[J]. Arch Intern Med, 1998, 158(9): 998-1004.
[22]Yvan-Charvet L, Pagler T, Gautier EL, et al. ATP-binding cassette transporters and HDL suppress hematopoietic stem cell proliferation[J]. Science, 2010, 328(5986): 1689-1693.
[23]Murphy AJ, Akhtari M, Tolani S, et al. ApoE regulates hematopoietic stem cell proliferation, monocytosis, and monocyte accumulation in atherosclerotic lesions in mice[J]. J Clin Invest,2011, 121(10): 4138-4149.
[24]Ganda A, Magnusson M, Yvan-Charvet L, et al. Mild renal dysfunction and metabolites tied to low HDL cholesterol are associated with monocytosis and atherosclerosis[J]. Circulation,2013, 127(9): 988-996.
[25]Ronco C, Rosner MH. Hemodialysis: new methods and future technology. Contrib Nephrol.[M]. Basel: Karger, 2011: 57–61.

