丙酮酸钠促进S-腺苷蛋氨酸 和谷胱甘肽联合高产及其生理机制
徐若烊,王大慧,许宏庆,卫功元
(苏州大学基础医学与生物科学学院,江苏苏州 215123)
S-腺苷蛋氨酸(SAM)和谷胱甘肽(GSH)均为广泛存在于生物体内的含硫小分子活性化合物。SAM由底物L-蛋氨酸和ATP经S-腺苷蛋氨酸合成酶催化合成,参与生物体内40多种生化反应,具有转甲基、转硫和转氨丙基等作用[1-2]。GSH是由谷氨酸、半胱氨酸和甘氨酸反应生成的活性三肽物质,在维持生物体内适宜的氧化还原环境、保护蛋白质的巯基免受氧化、清除细胞内活性氧自由基等方面具有重要作用[3-4]。基于SAM和GSH在细胞内的重要生理功能,这两种含硫化合物在临床医学、运动保健、食品加工和化妆品等诸多领域均具有广泛的应用前景。
目前,SAM和GSH的生产方法主要有化学合成法、酶促转化法和微生物发酵法,其中酵母发酵法是最具有潜力的方法[5-6]。在酵母细胞中,作为L-蛋氨酸代谢途径中的关键节点物质,SAM和GSH可以通过联产发酵的方法进行生产[7-9]。SAM和GSH的生物合成均需要ATP的参与,胞内能量物质的水平是决定SAM和GSH能否联合高产的关键因素[10]。前人研究发现,外源ATP的添加可以有效促进SAM和GSH的高产[11-12],但该方法并不经济。如果能设法提高酵母细胞内源性ATP的含量,则有可能提高SAM和GSH的联产水平。
针对胞内ATP水平的调控,常用的方法为优化分批发酵的供氧水平或添加外源的辅助性能源物质[13]。为了实现SAM和GSH联合高产,前期研究采用了两阶段溶氧控制策略,SAM和GSH联产量比恒定转速条件下提高6.5%[14]。此外,在分批发酵的6 h向发酵液中添加10 g/L柠檬酸钠,SAM和GSH联产量比未添加的对照组提高了13%[15]。然而,这些发酵优化策略促进SAM和GSH联合高产的生理学机制仍有待明确。
丙酮酸钠是一种化学工业中常用的廉价化合物,在好氧发酵过程中可以作为替代碳源或能量辅助物质,进而提高目标产物的高产[16]。为此,本文拟研究丙酮酸钠对SAM和GSH联产发酵的影响,从发酵动力学、关键酶活性和胞内能量物质水平及比率等角度对丙酮酸钠促进SAM和GSH联产发酵的生理机制进行解析。
1 材料与方法
1.1 材料与仪器
产朊假丝酵母(CandidautilisSZU 07-01) 为苏州大学微生物生理与代谢调控研究室保藏;SAM、GSH、烟酰胺腺嘌呤二核苷酸(NADH)、烟酰胺腺嘌呤二核苷酸磷酸(NADPH)、腺嘌呤核苷三磷酸(ATP)、腺嘌呤核苷二磷酸(ADP)、谷胱甘肽还原酶、丙酮酸钠、L-蛋氨酸、蛋白胨和酵母膏等 生工生物工程(上海)股份有限公司;硫酸镁、硫酸铵、磷酸二氢钾和氯化钙 国药集团化学试剂有限公司;γ-谷氨酰半胱氨酸合成酶、己糖激酶检测试剂盒 南京建成生物工程研究所;异柠檬酸脱氢酶检测试剂盒 上海酶联生物科技有限公司;种子培养基 葡萄糖20 g/L,蛋白胨10 g/L,酵母粉10 g/L,pH6.0;发酵培养基 葡萄糖35 g/L,硫酸铵10 g/L,磷酸二氢钾12.3 g/L,蛋氨酸4.6 g/L,硫酸镁0.05 g/L,氯化钙0.05 g/L,pH5.0。
5 L Minifors搅拌式发酵罐 瑞士Infors公司;Waters 1525高效液相色谱仪 美国Waters公司;LD5-2A离心机 北京京立离心机有限公司;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;HZ-2010K摇床 上海欣蕊自动化设备有限公司;SW-CJ-2A超净工作台 吴江市龙宏净化设备有限公司;LDZX-50KB灭菌锅 上海申安医疗器械厂。
1.2 实验方法
1.2.1 种子培养 取-70 ℃冷藏种子活化后接入种子培养基中,摇床培养20 h,温度30 ℃、摇床转速200 r/min。
1.2.2 摇床发酵培养 按10%(v/v)的接种量接种至发酵培养基中,摇床培养30 h,温度30 ℃,摇床转速200 r/min。
1.2.3 丙酮酸钠添加对SAM和GSH联产发酵的影响 在摇床培养条件下,以不添加丙酮酸钠作为对照,分别在0 h、对数生长期中期(6 h)和葡萄糖消耗结束时(12 h)添加1、2、3和4 g/L的丙酮酸钠,培养至30 h,取样测定生物量、SAM和GSH浓度,比较酵母细胞生长、SAM和GSH合成情况,总结丙酮酸钠对SAM和GSH联产发酵的影响规律。
1.2.4 分批发酵培养 按10%(v/v)的接种量将种子接种至装有3 L发酵培养基的发酵罐中,在30 ℃、350 r/min和1 vvm条件下通气培养30 h。pH采用梅特勒电极在位监测,通过自动流加3 mol/L H2SO4或3 mol/L NaOH进行调节,以维持pH变化在5.0±0.02范围内。在分批培养的不同时间定时取样,样品经处理后检测细胞生长、SAM和GSH合成情况。
1.2.5 丙酮酸钠促进SAM和GSH联产发酵生理机制解析 在产朊假丝酵母分批培养条件下,以不添加丙酮酸钠作为对照组,以在摇瓶中优化后的方法进行丙酮酸钠添加作为丙酮酸钠组,定时取样,检测胞内能量物质NADH、NAD+、ATP和ADP含量,测定胞内γ-谷氨酰半胱氨酸合成酶、S-腺苷蛋氨酸合成酶、己糖激酶和异柠檬酸脱氢酶活性,通过比较实验组和对照组胞内能量物质水平和比率以及关键酶活性大小,解析丙酮酸钠促进产朊假丝酵母联产SAM和GSH的生理机制。
1.2.6 酵母生物量和葡萄糖浓度的测定 以细胞干重(DCW)表示酵母生物量。取10 mL发酵液于3500 r/min下离心10 min,蒸馏水洗涤3次,相同转速下离心10 min,收集菌体,70 ℃烘干至恒重;葡萄糖浓度的测定采用3,5二硝基水杨酸法[17]。
1.2.7 胞内SAM、GSH的提取 分别采用0.35 mmol/L硫酸和40%(v/v)乙醇对胞内SAM和GSH进行提取[18]。
1.2.8 代谢物质浓度测定 胞内能量物质如NADH、NAD+、ATP和ADP的定量测定方法,SAM和GSH的定量测定方法,以及胞内SAM含量(ISC)和GSH含量(IGC)的定义及计算方法,参见文献[18]。
1.2.9 酶活测定γ-谷氨酰半胱氨酸合成酶(γ-GCS)、己糖激酶(HK)和异柠檬酸脱氢酶(IDH)采用试剂盒进行测定,操作方法和步骤按照说明书进行;S-腺苷蛋氨酸合成酶(MAT)通过测定酶促反应液中的SAM含量来进行检测[19]。
1.3 数据处理与分析
所有摇瓶实验数据均为三组独立实验样品的平均值,所有分批发酵实验数据均为两次检测结果的平均值。实验数据采用SPSS 17.0软件(IBM公司)进行统计分析,数据的可信度采用t-检验进行分析,当p<0.05时认为有显著影响。

表1 丙酮酸钠添加对SAM和GSH生物合成的影响Table 1 Effect of sodium pyruvate addition on the biosynthesis of SAM and GSH
注:同列中不同小写字母表示差异显著(p<0.05),字母相同代表差异不显著(p>0.05)。
2 结果与讨论
2.1 丙酮酸钠对产朊假丝酵母生物合成SAM和GSH的影响
摇瓶培养条件下,考察丙酮酸钠在C.utilisSZU 07-01生物合成SAM和GSH中的作用,结果如表1所示。可以看出,与不添加丙酮酸钠的空白对照相比,丙酮酸钠添加没有促进酵母细胞的生长,细胞干重变化不大。然而,在酵母细胞生长的前期(如0 h)添加丙酮酸钠有利于SAM和GSH的生物合成,SAM和GSH联产量均有所提高。在0 h添加2 g/L丙酮酸钠时,SAM和GSH联产量达到433.4 mg/L,是对照实验条件下的1.29倍。由此,以下选用0 h添加2 g/L丙酮酸钠作为分批发酵培养条件,深入研究丙酮酸钠对SAM和GSH联产发酵的影响及其生理机制。
2.2 丙酮酸钠在SAM和GSH联产发酵中的作用
在5 L发酵罐中对C.utilisSZU 07-01进行分批培养,根据表1中较优的方法添加丙酮酸钠(即在0 h添加2 g/L丙酮酸钠),考察细胞生长以及SAM和GSH合成情况,结果如图1所示。SAM和GSH联产发酵过程参数比较总结于表2。与摇瓶培养所呈现的结果不同,添加丙酮酸钠在溶解氧充足的情况下,促进了细胞的生长,至18 h时,细胞干重达到最大值,比对照提高了20.5%。在好氧发酵中,酵母细胞代谢丙酮酸钠产生了大量的能量物质,这将大大节约用于能量合成的葡萄糖的消耗,最终有更多的葡萄糖参与细胞生长,进而提高了细胞干重的水平。
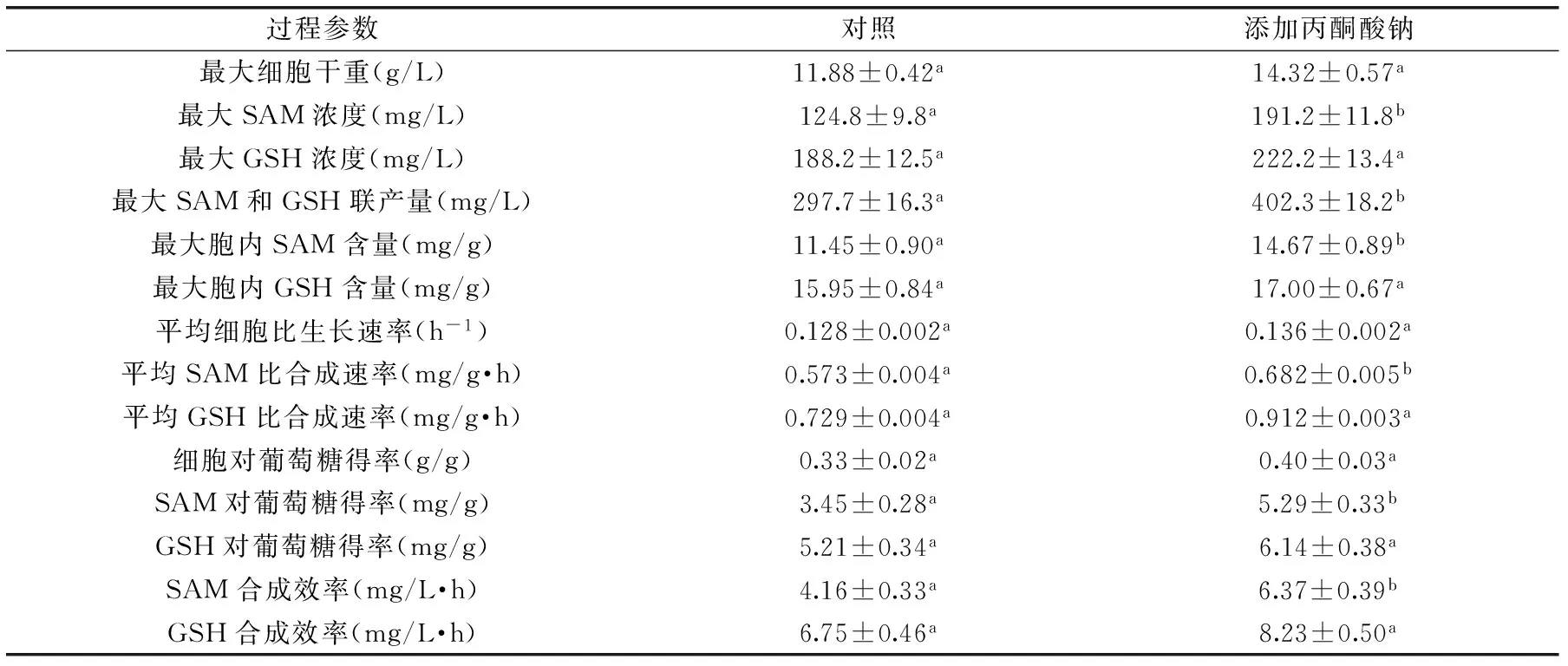
表2 SAM和GSH联产发酵过程参数比较Table 2 Comparison of kinetic parameters involved in batch co-production of SAM and GSH
注:同行中不同小写字母代表差异显著(p<0.05),字母相同代表差异不显著(p>0.05)。
与此同时,丙酮酸钠的添加也提高了SAM和GSH的合成速率,SAM和GSH的产量一直高于对照实验结果(图1B、图1C)。至27 h时,GSH产量达到最大值222.2 mg/L,比对照组提高了18.1%;至30 h时,SAM产量达到最大值191.2 mg/L,比对照组高出53.2%。最终,SAM和GSH联产量在27 h达到最大值402.3 mg/L,比对照提高35.1%(表2)。
进而对不同发酵时间下的酵母胞内SAM和GSH含量进行比较,结果如图2所示。可以发现,丙酮酸钠的添加有利于产朊假丝酵母胞内GSH的过量合成和积累,胞内GSH含量一直高于对照;对于SAM合成,丙酮酸钠添加的影响主要体现在细胞生长的稳定期(12 h之后),胞内SAM含量与对照相比有较大幅度的提高。酵母胞内SAM和GSH含量的高低体现了细胞合成SAM和GSH能力的大小,丙酮酸钠的添加提高了SAM和GSH的联产量,不仅仅是因为促进了C.utilisSZU 07-01细胞的生长,还因为其提升了酵母细胞合成SAM和GSH的能力。以下将分别从酵母胞内SAM和GSH合成的关键酶活性、与能量代谢相关酶活性和物质水平的变化规律等角度对丙酮酸钠促进SAM和GSH合成的生理机制进行探讨。

图2 产朊假丝酵母胞内SAM和GSH含量变化Fig.2 Time-course of intracellular contents of SAM and GSH in C. utilis
2.3 丙酮酸钠促进SAM和GSH联合高产的生理机制
2.3.1 S-腺苷蛋氨酸合成酶和γ-谷氨酰半胱氨酸合成酶活性 S-腺苷蛋氨酸合成酶(MAT)和γ-谷氨酰半胱氨酸合成酶(γ-GCS)分别为酵母细胞内SAM和GSH生物合成途径中的关键限速酶,MAT和γ-GCS的活性与SAM和GSH的合成速率密切相关[5-6]。为此,分别测定了SAM和GSH快速合成期时的MAT酶活(15 h和21 h)和γ-GCS酶活(9 h和15 h),结果如图3所示。可以看出,丙酮酸钠的添加有利于MAT和γ-GCS活性的提高。与对照相比,MAT酶活在15 h和21 h分别提高了8.1%和9.4%,γ-GCS酶活在9 h和15 h分别提高了9.7%和15.0%,这表明C.utilisSZU 07-01在丙酮酸钠存在的情况下具有更高的合成SAM和GSH的内在动力,能实现SAM和GSH的过量合成,并最终进一步提高了SAM和GSH的联产量。

图3 添加丙酮酸钠对MAT和γ-GCS活性的影响Fig.3 Effect of sodium pyruvate addition on the activities of MAT and γ-GCS注:不同小写字母代表差异显著(p<0.05),图4、图5同。
2.3.2 己糖激酶和异柠檬酸脱氢酶活性 己糖激酶(HK)是糖酵解途径中的关键限速酶之一,其活性的高低与葡萄糖的消耗速率有着紧密的关系;异柠檬酸脱氢酶(IDH)是三羧酸循环中的关键酶之一,其活性的提高有助于细胞在有氧环境中产生大量的NADH,进而为细胞代谢提供足够的能量[20-21]。为此,分别测定了分批培养9 h和15 h时的HK和IDH活性,结果如图4所示。可以看出,在细胞的快速生长期(9 h),丙酮酸钠的添加对HK活性几乎没有影响,但在15 h时HK活性比对照提高了近30%,表明丙酮酸钠可以在发酵中后期(15 h)提高酵母细胞对葡萄糖的利用能力。对于IDH来说,丙酮酸钠添加后,其活性在9 h和15 h时均高于对照,分别提高了13.2%和43.9%。IDH活性的提高将有利于线粒体内NADH水平的增加,为能量物质ATP的合成提供更多的底物来源。

图5 添加丙酮酸钠对胞内NADH和ATP含量及NADH/NAD+和ATP/ADP比率的影响Fig.5 Effect of sodium pyruvate addition on intracellular levels of NADH and ATP and ratios of NADH/NAD+ and ATP/ADP

图4 添加丙酮酸钠对产朊假丝 酵母胞内HK和IDH活性的影响Fig.4 Effect of sodium pyruvate addition on the activities of HK and IDH in Candida utilis
2.3.3 胞内能量物质水平及其比率 ATP是生物体内重要的能量物质和辅因子,参与多种生化反应过程[22]。在酵母细胞中,ATP除了为细胞代谢提供能量之外,还是SAM和GSH生物合成的前体物质,因此胞内ATP含量及再生能力对于SAM和GSH联合高产具有决定性的作用[10]。在好氧发酵过程中,ATP是由NADH经电子传递链氧化而形成的,故胞内NADH含量的高低可以作为ATP能否高效合成的一个重要指标。由图1可以看出,在9 h之后SAM和GSH进入快速合成期。为此,分别测定了分批培养9 h和15 h时的胞内能量代谢物质(ATP、ADP、NADH和NAD+),计算出胞内NADH含量(NADH/DCW)和ATP含量(ATP/DCW)以及NADH/NAD+和ATP/ADP比率,结果如图5所示。
可以发现,丙酮酸钠的添加提高了发酵前期(9 h)的胞内NADH和ATP含量,其水平分别是对照的2.57倍和3.36倍。由于此时NADH/NAD+和ATP/ADP比率也明显高于对照,说明丙酮酸钠的存在可以显著增加胞内ATP的供给。至15 h时,虽然丙酮酸钠的存在能继续将胞内NADH维持在更高的水平,但是胞内ATP含量和ATP/ADP比率明显低于对照,说明有更多的ATP被用于细胞代谢以及SAM和GSH的生物合成中。酵母胞内较高的NADH和ATP含量为SAM和GSH的过量合成提供了更加充足的底物保障,并最终实现SAM和GSH的联合高产。
3 结论
通过对不同培养时间添加不同浓度丙酮酸钠的SAM和GSH联产发酵结果进行分析,发现在0 h添加2 g/L丙酮酸钠可以有效地提高产朊假丝酵母生物合成SAM和GSH,分批培养条件下SAM和GSH的联产量比对照提高了35.1%。对分批发酵动力学参数进行比较,发现丙酮酸钠的添加提升了酵母细胞合成SAM和GSH的能力。酵母胞内SAM和GSH合成的关键酶活性、与能量代谢相关酶活性和物质水平的变化规律表明,丙酮酸钠提高了SAM和GSH合成期的HK和IDH酶活性、MAT和γ-GCS酶活性,以及胞内能量代谢物质的水平和比率,最终实现了SAM和GSH的联合高产。该研究结果为类似耗能合成化合物的高效生产提供了一种可行的思路。
[1]Lu S C. S-adenosylmethionine[J]. Internatrional Journal Biochemistry and Cell and Biology,2000,32(4):391-395.
[2]杨静,王曼,韦平和. S-腺苷甲硫氨酸的临床及药理研究进展[J]. 药学进展,2001,25(3):164-167.
[3]Meister A,Anderson M E. Glutathione[J]. Annual Review of Biochemistry,1983,52:711-760.
[4]陈坚,卫功元,李寅,等. 微生物发酵法生产谷胱甘肽[J]. 无锡轻工大学学报,2004,23(5):104-110.
[5]Shiozaki S,Shimizu S,Yamada H. Production of S-adenosyl-l-methionine by Saccharomyces sake [J]. Journal of Biotechnology,1986,4(6):345-354.
[6]Li Y,Wei G,Chen J. Glutathione:a review on biotechnological production[J]. Applied Microbiology and Biotechnology,2004,66(3):233-242.
[7]Brosnan J T,Brosnan M E,Bertolo R,et al. Methionine:a metabolically unique amino acid[J]. Livestock Science,2007,112(1-2):2-7.
[8]邵娜,卫功元,葛晓光,等. 紫外线γ射线复合诱变筛选S-腺苷甲硫氨酸和谷胱甘肽联产发酵菌株[J]. 辐射研究与辐射工艺学报,2010,28(2):107-113.
[9]Liu H,Lin J,Cen P,et al. Co-production of S-adenosyl-L-methionine and glutathione from spent brewer’s yeast cells[J]. Process Biochemistry,2004,39(12):1993-1997.
[10]王玉磊,卫功元,邵娜,等. 基于能量代谢分析的S-腺苷蛋氨酸和谷胱甘肽联合高产方法[J]. 化工学报,2012,63(1):223-229.
[11]Hu H,Qian J,Chu J,et al. Optimization of L-methionine feeding strategy for improving S-adenosyl-L-methionine production by methionine adenosyltransferase overexpressed Pichia pastoris[J]. Applied Microbiol and Biotechnol,2009,83(6):1105-1114.
[12]Liang G,Liao X,Du G,et al. Elevated glutathione production by adding precursor amino acids coupled with ATP in high cell density cultivation of Candida utilis[J]. Journal of Applied Microbiology,2008,105(5):1432-1440.
[13]Zhou J W,Liu L M,Shi Z P,et al. ATP in current biotechnology:regulation,application and perspectives[J]. Biotechnology Advances,2009,27(1):94-101.
[14]王大慧,王玉磊,卫功元,等. 基于代谢通量分析的SAM和GSH联产溶氧控制策略[J]. 高校化学工程学报,2013,27(1):102-107.
[15]王玉磊,朱健,卫功元,等. 柠檬酸钠促进S-腺苷蛋氨酸和谷胱甘肽联合高产[J]. 中国生物工程杂志,2013,33(8):49-54.
[16]申凤丹,刘金龙,吴剑荣,等. 丙酮酸钠对E. coli CCTCC M 208088发酵生产聚唾液酸的影响[J]. 工业微生物,2011,41(2):37-42.
[17]Miller G L. Use of dinitrosalicylic acid reagent for determination of reducing sugar[J]. Analytical Biochemistry,1959,31(3):426-428.
[18]Wang Y,Wang D,Wei G,et al. Enhanced co-production of S-adenosylmethionine and glutathione by an ATP-oriented amino acid addition strategy[J]. Bioresource Technology,2012,107(2):19-24.
[19]姚高峰,秦秀林,储炬,等. 高效液相色谱法分析胞内S-腺苷L-甲硫氨酸含量及其合成酶活性的优化研究[J]. 化学与生物工程,2011,28(6):83-86.
[20]Lin A P,McAlister-Henn L. Isocitrate binding at two functionally distinct sites in yeast NAD+-specific isocitrate dehydrogenase[J]. Journal of Biological Chemistry,2002,277(25):22475-22483.
[21]Hara K Y,Shimodate N,Hirokawa Y,et al. Glutathione production by efficient ATP-regeneratingEscherichiacolimutants[J]. Fems Microbiology Letters,2009,297(2):217-224.
[22]Hara KY,Kondo A. ATP regulation in bioproduction[J]. Microbiol Cell Fact,2015,14(1):198.

