基于宏基因组学技术分析“泡菜老汤” 发酵甘蓝原核微生物群落结构
燕平梅,荆雪娇,李艳琴,*,柴 政,乔宏萍,赵文婧,王 琪
(1.太原师范学院生物系,山西太原 030012;2.山西大学生物学院,山西太原 030031)
发酵蔬菜是蔬菜的冷加工制品,既保持了蔬菜的原滋原味,又因含有乳酸菌等肠道有益菌群而具有保健功能[1-2]。发酵蔬菜产业成为蔬菜加工的主流方向。发酵蔬菜的生产方式一般分为自然发酵和人工接种发酵两种方式。自然发酵是借助于天然附着在蔬菜表面上微生物的作用来进行的,因为蔬菜收获后表面所含的微生物数量大、种类多,包括细菌、酵母和霉菌等[3],发酵时微生物区系复杂,存在发酵启动困难,容易发酵终止、不彻底、结果不可控制以及易产生腐败,食用安全性差,尤其发酵蔬菜中亚硝酸含量的异常增加等缺点[4-7]。人工接种发酵工艺根据接种的菌类分为纯种发酵和混合菌群发酵[8];纯种发酵接种的菌种单一,容易控制,可以缩短发酵周期和提高设备的利用率,但是发酵出来的蔬菜制品,口感和品质不佳[9-11]。混合菌群的发酵沿用“老汤”(以前的发酵液)的企业较多,“老汤”对发酵蔬菜原核微生物群落结构影响的研究基于传统微生物学方法[12-13]。但是,现在已培养的微生物可能不到自然界微生物总量的1%[14],大量未培养的微生物在相应生境中存在种类到底有多少,如何发挥功能,传统微生物学方法已经不能全面解答[15]。
宏基因组学的出现和兴起扩展了人们对微生物群落的认识。基于宏基因组的微生物多样性检测技术如DGGE/TGGE技术[16-17]、克隆文库分析法[18-19]和高通量测序技术[20]等被广泛应用于发酵蔬菜微生物检测中。其中DGGE/TGGE技术具有一些不可替代的优点,能够更加直观地比较和分析微生物群落结构的变化规律[21]。本研究以基于宏基因组的DGGE技术探究“老汤”对发酵蔬菜原核微生物群落结构影响,为阐明“老汤”发酵蔬菜的机理提供参考数据和方法,同时,为改进蔬菜发酵的工艺提供技术支持。
1 材料与方法
1.1 材料与仪器
甘蓝、无碘盐、白砂糖、花椒、大料(八角) 山西省太原市长风街美特好超市;泡菜老汤 四川某饭店DNA提取试剂盒、凝胶回收试剂盒 北京天根生化科技有限公司;X-gal、氨苄(Amp) 北京全式金生物技术有限公司;PCR引物 上海生工生物工程公司。
琼脂糖凝胶电泳仪、PCR仪、变性梯度凝胶电泳仪、NanoDrop2000DNA浓度仪、凝胶成像系统 Bio-Rad公司。
1.2 实验方法
1.2.1 泡菜制作配方及方法 将新鲜的甘蓝清洗干净,自然沥干,切成2 cm的方块,备用。其次,将玻璃泡菜坛子洗净,用开水烫洗两次后,备用。然后,按配方所示(表1),在开水中分别加入无碘盐(2%)、白砂糖(1%)、大料(1%),煮沸10 min,待其冷却后,盛到泡菜坛子中,补无菌水至2500 mL。最后加入已沥干的蔬菜,水封坛子口,且用黑色塑料袋将坛子罩住,闭光发酵,室温发酵,每隔24 h取样。每种处理设3个重复。不加老汤的泡菜水为新汤,是对照实验。

表1 不同泡菜的制作配方Table 1 Different recipes of pickled vegetables
1.2.2 样品采集及DNA的提取 样品的采集:每隔24 h用5 mL无菌移液器从泡菜罐的上、中、下部位各取10 mL发酵液(总量30 mL)于离心管中,以保证样品的代表性。然后在11740 r/min离心10 min,收集菌体。再用PBS buffer 洗涤大离心管中的沉淀物,将菌体收集在1.5 mL的EP管中。将三个平行实验所收集的菌体混合,以备后续实验。泡菜新汤、老汤中DNA的提取按照试剂盒(DNA提取试剂盒)给定步骤进行。
1.2.3 细菌16S rDNA V3可变区PCR扩增 以泡菜新汤、老汤总DNA为模板,Touchdown-PCR扩增16S rDNA V3可变区(338 f~518 r)[22]。以Touchdown-PCR产物为模板,采用带夹子的引物(338 f-GC和518 r),进行Reconditioning-PCR扩增[23]。
1.2.4 变性梯度凝胶电泳(DGGE)及染色 细菌16S rDNA V3区PCR产物进行DGGE分离,应用8%聚丙烯酰胺凝胶,变性剂梯度范围为41%~58%。由于银染法的灵敏度高,但是银离子的残留,不易进行后续的条带回收,故本实验DGGE图谱分析采用银染法,条带回收采用4S RedPlus染色法。4S RedPlus染色法:电泳后将凝胶放入4S RedPlus液(4S RedPlus 120 μL,1×TAE 300 mL)中染色30 min,用UVI凝胶成像系统检测并记录结果,以备后续回收条带使用。
1.2.5 Shannon-Wiener多样性指数和主成分分析方法 DGGE图谱采用Quantity One 软件对每个发酵蔬菜样品的电泳条带的多少、条带密度进行数字化,导出的结果用于多样性分析和主成分分析(PCA)。多样性指数的计算公式如下[24]:
式中,H为Shannon-Wiener多样性指数;Ni为样品DGGE图谱中第i条带灰度;N为该样品所有条带的总灰度;Pi为第i条带灰度占该泳道总灰度的比率。
采用CANOCO排序软件根据不同样品条带亮度和位置的数值对细菌群落结构组成进行主成分分析。
1.2.6 不同发酵阶段泡菜汁的pH测定 每隔24 h,用5 mL无菌枪头取泡菜汁20 mL于50 mL的锥形瓶中,然后用pH计测定,每个样品测三次,取其平均值。
1.2.7 泡菜可滴定酸的测定 每隔24 h,用无菌的镊子,从泡菜坛子中,准确称取发酵蔬菜10.0 g于匀浆机打成浆状研钵中,碾碎,加蒸馏水,8层纱布过滤,最终定容到100 mL容量瓶中。然后加40 mL蒸馏水,用NaOH标准溶液(0.10 mol/L)滴定,酚肽作指示剂(0.5%),滴定至溶液变微红,记下消耗的NaOH体积数[25]。
2 结果与分析
2.1 细菌16S rDNA V3区PCR扩增
2.1.1 Touchdown-PCR扩增产物检测 分别以甘蓝的老汤发酵液和新汤液中微生物总DNA为模板,338F和518R为引物进行第一次PCR,用1.2%的琼脂糖凝胶检测扩增产物,结果依次如图1所示,扩增片段大小为180 bp左右,且无非特异性扩增,故结果可用于后续实验。

图1 甘蓝新汤和老汤第一次PCR扩增产物Fig.1 The first PCR amplification products of new and old soup in cabbage pickles注:1~8代表甘蓝新汤的取样时间:1、2、3、4、5、6、7、8 d;9~16代表甘蓝老汤取样时间: 1、2、3、4、5、6、7、8 d;M为Marker,图2~图5同。
2.1.2 Reconditioning-PCR扩增产物检测 以第一次PCR产物为模板,用带夹子的引物338F-GC和518R进行第二次扩增。产物用1.2%的琼脂糖凝胶检测,结果依次见图2所示。

图2 甘蓝新汤和老汤第二次PCR扩增产物Fig.2 The second PCR amplification products of new and old soup in cabbage pickles
2.2 甘蓝新汤、老汤细菌16S rDNA V3区DGGE结果

图3 甘蓝新汤和老汤的细菌DGGE电泳图谱Fig.3 DGGE analysis of bacteria in new and old soup of cabbage pickle
2.2.1 DGGE图谱分析 甘蓝的新汤和老汤连续8 d的细菌DGGE图谱见图3。可见新汤的DGGE条带数明显多于老汤,说明在新汤发酵体系,细菌的群落结构更为复杂。并且,新汤第1 d条带较少,第2、3、4、5 d条带数及条带亮度均增加,第6 d反而变少,第7、8 d又增多,可以明显的感觉到细菌群落结构存在着动态的变化,而老汤中的条带数就相对一致,说明老汤的细菌群落结构相对稳定。
2.2.2 香农指数分析(Shannon-Wiener index) 香农指数是微生物物种数、细胞数及分布均匀度的综合指标[30]。图4表示了自制甘蓝泡菜的新汤、老汤的原核微生物多样性变化情况。新汤中香农指数随发酵时间的变化规律为低-高-较低。第1 d,香农指数为最低值,可能是由于蔬菜表面的细菌在适应新的环境,处于休眠状态;第2 d,香农指数明显大于第1 d,在第3 d达到顶峰,第4~5 d又有轻微的下降,趋于平稳,可以认为2~5 d为甘蓝泡菜发酵的中期;从第6 d开始,香农指数明显的下降,低于2~5 d,说明很多细菌开始衰亡,到达了衰退期,第7、8 d,虽然香农指数有所回升,但是也已经低于第2~5 d,可以认为6~8 d为甘蓝泡菜发酵后期。

图4 甘蓝新汤和老汤的细菌多样性指数分析Fig.4 Shannon-wiener analysis of bacteria in new and old soup of cabbage pickle
老汤中香农指数随发酵时间的变化规律为高-低-较高。前期相当于新汤的后期,故可以看出老汤第1~2 d香农指数和新汤第8 d大体一致。而老汤中新加了甘蓝,在第3 d,香农指数达到最低,可能是由于原核微生物群落重新构建形成其微生态的过程,即可能是由于老汤中,乳酸菌利用蔬菜发酵形成了乳酸,降低了卤汁的pH,从而抑制了新菜中很多杂菌的生长。在4~8 d,可以认为是达到了发酵的中后期,香农指数回升,但依旧不能达到新汤第2 d的水平,说明老汤中的微生态环境影响了很多微生物的生长。
2.2.3 主成分分析(PCA) 为了更精确的分析发酵过程过中原核微生物群落结构的动态变化,通过数字化的矩阵对DGGE图谱进行了主成分分析。如图5所示:在PC1方向上,甘蓝老汤1~8 d聚合在一起;新汤中除了1 d,其他的也都聚合在一起。在PC2方向上,老汤1~8 d也明显聚合在一起;新汤2~8 d也都聚合在一起,其中2~5 d及6~8 d聚合的更紧密,跟上述香农指数分析结果一致。

图5 甘蓝新汤和老汤的主成分分析(PCA)Fig.5 The principal component analysis of bacteria in new and old soup of cabbage pickles
2.2.4 聚类分析 聚类图谱是显示微生物群落相似度指标(图6)。以50%以上的相似度来看,新汤第8 d与老汤1~8 d的所有样品聚为一类,说明新汤发酵8 d后,其稳定的微生物区系已形成,继续加入蔬菜不会造成其微生物群落结构大的改变。新汤中2~5 d的结果相似度高达66%以上,此结果跟香农指数分析结果新汤第2~5 d可视为发酵中期一致。
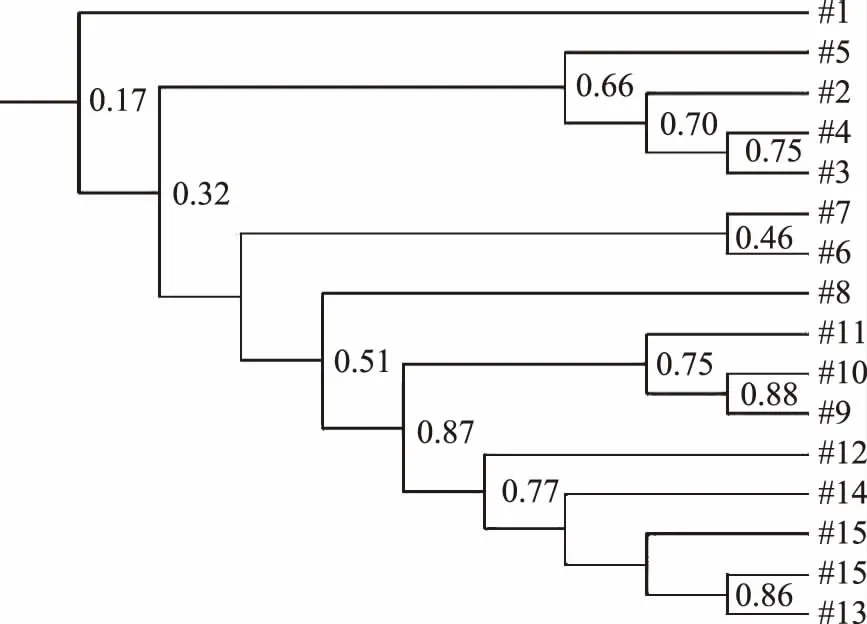
图6 甘蓝新汤和老汤的细菌聚类分析图谱Fig.6 The cluster analysis of bacteria in new and old soup of cabbage pickle注:#1~#8代表新汤取样时间:1、2、3、4、5、6、7、8 d;#9~#16分别对应老汤的取样时间:1、2、3、4、5、6、7、8 d。
2.3 甘蓝泡菜及新汤和老汤的酸度变化
2.3.1 新汤和老汤的pH曲线 由图7可知,甘蓝新汤中,随着发酵时间的增加,pH呈先下降后平稳的趋势,尤其在第1~3 d之内,pH下降尤为明显。老汤中,第1 d的pH与新汤发酵后期的pH一样,虽然pH也呈先下降后平稳的趋势,但下降幅度不大,基本平稳。

图7 甘蓝新老汤发酵过程中pH的变化Fig.7 Changes of pH in new and old soup of cabbage pickles
2.3.2 新老汤泡菜的可滴定酸变化曲线 分别将新老汤腌制的甘蓝研磨过滤,测定其可滴定酸,发酵过程中变化情况如图8所示。新汤甘蓝泡菜在第1 d,酸度最低,第2 d达到最高后回落,第3~5 d小幅下降,第6~8 d小幅回升;老汤发酵过程中,可滴定酸的变化幅度不大,差异不显著,相对平稳。此结果与DGGE法分析的细菌群落结构变化趋势相一致。

图8 新汤和老汤发酵过程中泡菜的可滴定酸变化曲线Fig.8 Changes of pH with cabbage in new and old soup pickles
3 讨论
本团队曾用培养方法和基于PCR-16S rDNA技术的非培养方法研究了泡菜老汤中主要微生物为乳酸菌[12],并通过微生物的计数,说明用泡菜老汤发酵蔬菜能够增强发酵系统中乳酸菌种群优势,形成有利于乳酸菌生长的环境,且能抑制乳酸菌之外的以肠杆菌科为主杂菌的生长[13]。泡菜老汤发酵甘蓝因加入大量的乳酸菌,增强发酵甘蓝中乳酸菌种群优势,形成有利于乳酸菌生长的环境,并且乳酸(可滴定酸)含量增高,pH降低,本实验的研究结果也说明了老汤发酵甘蓝初期pH较新汤发酵低;而乳酸含量较对照发酵高这一事实。
老汤发酵中引入大量的乳酸菌导致发酵初期微生物Shannon-Wiener指数较新汤中高,另一方面,引入大量乳酸菌,导致pH的迅速降低;由于乳酸菌、低pH抑制发酵甘蓝中的其它微生物的出现,如需氧嗜温菌和肠杆菌的减少,导致老汤发酵中期甘蓝中微生物Shannon-Wiener指数较新汤中低。同样的结果也见于其它的发酵产品[26-28]。发酵后期由于耐酸微生物的生长繁殖,老汤发酵甘蓝中微生物Shannon-Wiener指数略有回升。
蔬菜收获后表面所含的微生物数量大,如甘蓝外叶含微生物约13×108个/g,但发酵初期,由于供给微生物生长的甘蓝汁营养物质未成为微生物细胞可用的状态,此时新汤发酵甘蓝中微生物Shannon-Wiener指数较老汤中低。随着甘蓝营养物质向外渗透,其中大量的微生物处于快速增长,新汤发酵甘蓝中微生物Shannon-Wiener指数较老汤中高,乳酸菌同样也快速繁殖,乳酸杆菌是形成酸的主要微生物[29-30],随着酸含量增高,pH降低,低pH和大量的乳酸菌抑制发酵甘蓝中的其它微生物的出现,因此甘蓝发酵后期,新汤发酵甘蓝中微生物Shannon-Wiener指数较老汤中低。
4 结论
以不加“泡菜老汤”的自然发酵甘蓝为对照,研究“泡菜老汤”对发酵甘蓝原核微生物群落结构的影响。研究结果表明,对照组中Shannon-Wiener指数随发酵时间的变化规律为低-高-较低,泡菜老汤中香农指数的随发酵时间的变化规律为高-低-较高,即对照中微生物多样性低于加泡菜老汤;主成分分析说明泡菜老汤发酵甘蓝1~8 d聚合在一起;对照中除了第1 d,其他的也都聚合在一起;聚类图谱显示对照第8 d与泡菜老汤发酵1~8 d的所有样品微生物群落高度相似,表明泡菜老汤发酵的原核微生物群落结构较对照相对稳定,对照发酵第8 d后进入稳定状态。
[1]陈功. 试论中国泡菜的历史与发展[J]. 食品与发酵科技,2010,46(3):2-5.
[2]张玉龙,胡萍,湛剑龙,等. 发酵酸菜的研究及其进展[J]. 食品安全检测学报,2014,5(12):388-403.
[3]施安辉,周波. 乳酸菌分类、生理特性及在食品酿造工业上的应用[J]. 中国调味品,2001,26(11):3-8.
[4]TOSHIROUH.The caue on the abnormai accumulation of nitrite in pickles of chinesecabbage(BrassicapekinesisRupr.)[J].Nippon ShokuhinkuKoga kuKaishi,2001,48(6):409 - 415.
[5]纪淑娟,孟宪军. 大白菜发酵过程中亚硝酸盐消长规律的研究[J]. 食品与发酵工业,2002,27(2):42-46.
[6]张庆芳,迟乃玉,魏毓棠,大白菜腌渍发酵亚硝酸盐含量的研究[J]. 食品工业,2001,23(1):38-39.
[7]燕平梅,薛文通,张惠,等. 不同贮藏蔬菜中亚硝酸盐变化的研究[J].食品科学,2006(6):242-246.
[8]韩国玲,刘安军. 东北酸白菜人工接种发酵工艺及挥发性成分的研究[J]. 食品研究与开发,2010,31(3):126-129.
[9]燕平梅,薛文通,张惠. 纯种发酵技术对发酵甘蓝中亚硝酸盐含量的影响[J].中国农业大学学报,2007,12(3):70-74.
[10]沈国华,卢英,何丁喜,等. 纯菌接种发酵技术在腌渍蔬菜加工上的应用研究(一)[J].中国调味品,2002,2(3):22-25.
[11]沈国华,卢英,何丁喜,等. 纯菌接种发酵技术在腌渍蔬菜加工上的应用研究(二)[J].中国调味品,2002(6):24-31.
[12]燕平梅. 发酵蔬菜中亚硝酸盐含量及优良发酵菌种筛选的研究[D].北京:中国农业大学,2007.
[13]燕平梅,畅晓晖,赵跃平,等.“泡菜老汤”对发酵甘蓝品质的影响[J]. 中国酿造,2009,28(1):103-106.
[14]AmannR I,Ludwig W,Schleifer K H. Phylogenetic identification and in situ detection of individual microbial cells without cultivation[J]. Microbiological Reviews,1995,59(1):143-169.
[15]Jansson JK,Prosser JI.The life beneath our feet[J]. Nature,2013,494(7435):40-41.
[16]Park EJ,Chun J,Cha CJ,et al.Bacterial community analysis during fermentation of ten
representativekinds of kimchi with barcoded pyrosequencing[J]. Food Microbiology,2012,30(1):197-204.
[17]李正国,付晓红,邓伟,等. 传统分离培养结合DGGE法检测榨菜腌制过程的细菌多样性[J]. 微生物学通报,2009,36(3):371-376.
[18]翁佩芳,陈希,沈锡权,等.榨菜低盐腌制细菌群落多样性的分析[J].中国农业科学,2012,45(2):338-345.
[19]沈锡权,赵永威,吴祖芳,等. 冬瓜生腌过程细菌种群变化及其品质相关性[J].食品与生物技术学报,2012,31(4):411-416.
[20]侯强川,郭壮,张家超,等. 俄罗斯卡尔梅克共和国发酵蔬菜中细菌多样性研究[J]. 食品与发酵工业,2014,40(7):16-22.
[21]夏围围,贾仲君. 高通量测序和DGGE分析土壤微生物群落的技术评价[J]. 微生物学报,2014,54(12):89-99.
[22]Don RH,Cox PT,Wainwright BJ,et al. ‘Touchdown’ PCR to circumvent spurious priming during gene amplification[J]. Nucleic Acids Reseach,1991,19(14):4-8.
[23]Zhang J,Zeng G,Chen Y,et al. Effects of physico-chemical parameters on the bacterial and fungal communities during agricultural waste composting[J]. Bioresource Technology,2011,102(3):2950-2956.
[24]程新胜,杨建卿.熏蒸处理对土壤微生物及硝化作用的影响[J]. 中国生态农业学报,2007,15(6):51-53.
[25]Praphailong W,Fleet G H. The effect of pH,sodium chloride,sucrose,sorbate and benzoate on the growth of food spoilage yeasts[J]. Food Microbiology,1997,14(5):459-468.
[26]Ruiz-Barba J L,Cathcart D P,Warner P J,et al. Use ofLactobacillusplantarumLPC010,a bacteriocin producer,as a starter culture in Spanish style green olive fermentations[J]. Appliedand Environmental Microbiology,1994,60(6):2059-2064.
[27]Muyanja B K,Narvhus J A,Treimo J,et al Isolation characterization and identification of lactic acid bacteria from bushera:a Ugandan traditional fermented beverage[J]. International Journal of Food Microbiology,2002,80:201-210.
[28]Nche P F,Nout J R,Rombouts F M,et al.Effect of cowpea supplementation on the quality of kenkey,a traditional Ghanaian fermented maize food[J]. Journal of Cereal Science,1994,19(2):191-197.
[29]Choi S,Beuchat L R,Perkins L M,et al.Fermentation and sensory characteristics of kimchi containing potassium chloride as partial replacement of sodium chloride[J]. International Journal of Food Microbiology,1994,21(4):335-340.
[30]AkinreleI A. Fermentation studies on maize during thepreparation of a traditional Africanstarch-cake food[J]. Journalof Food Agriculture,1970,21(12):619-625.

