猪繁殖与呼吸综合征病毒非结构蛋白2研究进展
赵 军,徐志文,2,朱 玲,2,*
(1.四川农业大学 动物医学院,四川 成都 611130; 2.四川农业大学 动物疫病与人类健康四川省重点实验室,四川 成都 611130)
PRRSV是单股正链RNA病毒,属尼多病毒目动脉炎病毒科(Arteriviridae)、动脉炎病毒属(Arterivirus)。其基因组全长约15.4 kb,包含10个ORFs,分别为ORF1a、1b、2a、2b以及ORF3- 5、ORF5a、ORF6- 7。ORF1a在病毒复制中,先被翻译成ppla多聚蛋白,ORF1b通过核糖体转移码转移成pplab多聚蛋白。之后分别被水解为Nsp1- 8和Nsp9- 12等至少16种非结构蛋白[1-3]。PRRSV感染早期Nsp1β、Nsp2、Nsp4、Nsp7α、Nsp7β、Nsp8定位于细胞核周围,原位标记显示它们共定位的位置为病毒RNA复制场所[4]。
Nsp2基因是PRRSV遗传流行病学监测和演化的重要基因,当前PRRSV多亚型毒株在Nsp2基因区段均有不同程度的基因插入和缺失。所以关于Nsp2蛋白与PRRSV毒力、致病性的关系、对细胞的侵袭能力的研究越来越多,也越来越深入。Nsp2是PRRSV最大的复制蛋白,其基因长度约为2.9 kb,不同毒株序列之间变异明显且基因全长不一。Nsp2保守性最差,美洲型毒株和欧洲型毒株序列比对显示,氨基酸序列同源性仅为32%,抗原表位众多,而表位集中区域容易发生基因变异。
目前已鉴定Nsp2有4个主要功能区:N端的半胱氨酸蛋白酶结构域(PL2);功能尚未清楚的中间高变区;近C端的高亲水性跨膜区;功能尚不明确的C端富含半胱氨酸残基保守区。Nsp2蛋白具有顺式和反式2种酶切活性,所以酶切后能够产生7种Nsp2亚型(Nsp2a、Nsp2b、Nsp2c、Nsp2d、Nsp2e、Nsp2f、Nsp2TF)。其中Nsp2TF是最近发现的能影响PRRSV复制的新亚型(约占Nsp2的2/3)。这些Nsp2使用相同的N末端和不同的C末端[3,5]。Nsp2是一个与病毒相关的PRRSV蛋白,研究表明PRRSV的复制过程中会出现大小不一的Nsp2亚类,它们共享PL2区域的227个氨基酸的N端。产生的这些不同分子量的Nsp2可能存在不同的功能,大分子Nsp2亚型蛋白在感染早期出现,对病毒的早期复制可能发挥着关键作用[6-7]。Nsp2以多个亚型存在于病毒包膜上,在病毒包装时与病毒的包膜融合有关,还存在于细胞突起上,与细胞之间的联系密切相关,其所诱导的体液免疫所产生的抗体与结构蛋白N蛋白形成的免疫水平相当。其N末端具有保守的催化N末端半胱氨酸和组氨酸残基的活性,并被认为具有半胱氨酸蛋白酶的活性[8]。此外,Nsp2还是Nsp4丝氨酸蛋白酶的辅助因子,与细胞和组织嗜性有关,在病毒复制过程中,参与多聚蛋白的装配[9]。
当前,PRRS对养猪业造成的冲击正逐渐加重,特别是2013年以后国内多地相继报道发现Nsp2缺失131aa的NADC30类似毒株,使得国内PRRSV的防控变得更加复杂。Nsp2是不同亚型毒株之间变异最明显也最没有规律的蛋白,当前对地区PRRSV的流行病学调查及毒株遗传进化分析多以Nsp2基因为靶基因。现有的研究结果表明,当前NADC30类似毒株多发现于河北、河南、山东、辽宁等省,南方地区还未见报道,但基于当前交通便利、生猪流动大等现状,NADC30类似毒株何时能传入南方,能造成多大困扰还未可知。因此,针对新流行毒株的检测及其变异后的Nsp2在病毒复制、致病力和参与免疫调控方面的研究是很有必要的。
1 Nsp2的高变异性
Nsp2在非结构蛋白中变异性最大,点突变、插入和缺失是PRRSV Nsp2的常见突变。对中国的PRRSV进行调查分析,Nsp2基因具有广泛的变异性[10]。2006年,我国爆发了高致病性PRRS(HP- PRRS),2008年,美国报道发现一种新亚型的HP- PRRSV(NADC30),通过Nsp2的基因序列比较结果显示,HP- PRRSV和经典PRRSV比较在Nsp2高变区存在30 aa左右的连续缺失[11],而NADC30类型毒株较HP- PRRSV在Nsp2高变区存在131 aa左右的不连续缺失[12-14],从GenBank中收录的HP- PRRSV、经典PRRSV、NADC30类型毒株遗传进化树分析显示,NADC30毒株与国内主流毒株HP- PRRSV、经典PRRSV分属2个大的分支,而HP- PRRSV、经典PRRSV属于同一进化分支(图1)。
野毒株自然缺失时有报道:本实验室毛汐语等[15]2012年分离的SC2012自然减毒株,在aa485~aa498区间连续缺失14个氨基酸;Gao等[16]首次报导了PRRSV Nsp2天然缺失的病毒株HB- 2(SH)/2002,在aa471~aa482区间连续缺失12个氨基酸;Liu等[17]分离的2株欧洲型PRRSV在Nsp2的aa282~aa348区间连续缺失68个氨基酸,同时还分离出4株北美型PRRSV在aa322~aa432、aa483、aa504~aa522区间连续缺失31个氨基酸[18];Ji等[19]分离的GZgy15- 1毒株在Nsp2的aa488~aa516区间缺失29个氨基酸。另外还发现,在FJLYDX04株的aa599~aa603序列中有5个碱基的插入,这是中国第一株报道Nsp2存在插入的病毒株[20]。此外,病毒株HZ- 31的Nsp2区含有59个不连续缺失,分别为aa467~aa474、aa498~aa519和aa533~aa361,但它的481位未像其他HP- PRRSV株一样缺失,在遗传系统中分析,它是独立于JXA1和EM2007的一个单独分支[21]。
表1分离株Nsp2变异情况
Table1Nsp2 variation of isolated strains
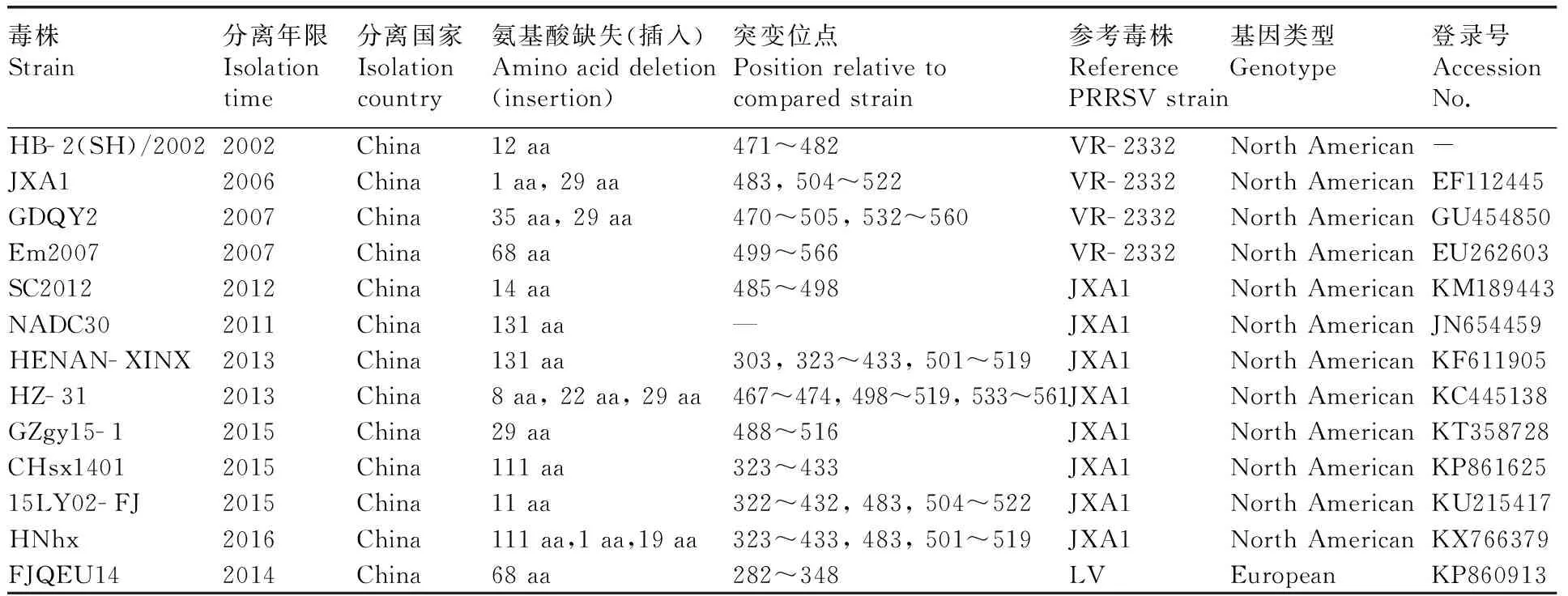
毒株Strain分离年限Isolationtime分离国家Isolationcountry氨基酸缺失(插入)Aminoaciddeletion(insertion)突变位点Positionrelativetocomparedstrain参考毒株ReferencePRRSVstrain基因类型Genotype登录号AccessionNo.HB-2(SH)/20022002China12aa471~482VR-2332NorthAmerican-JXA12006China1aa,29aa483,504~522VR-2332NorthAmericanEF112445GDQY22007China35aa,29aa470~505,532~560VR-2332NorthAmericanGU454850Em20072007China68aa499~566VR-2332NorthAmericanEU262603SC20122012China14aa485~498JXA1NorthAmericanKM189443NADC302011China131aa—JXA1NorthAmericanJN654459HENAN-XINX2013China131aa303,323~433,501~519JXA1NorthAmericanKF611905HZ-312013China8aa,22aa,29aa467~474,498~519,533~561JXA1NorthAmericanKC445138GZgy15-12015China29aa488~516JXA1NorthAmericanKT358728CHsx14012015China111aa323~433JXA1NorthAmericanKP86162515LY02-FJ2015China11aa322~432,483,504~522JXA1NorthAmericanKU215417HNhx2016China111aa,1aa,19aa323~433,483,501~519JXA1NorthAmericanKX766379FJQEU142014China68aa282~348LVEuropeanKP860913
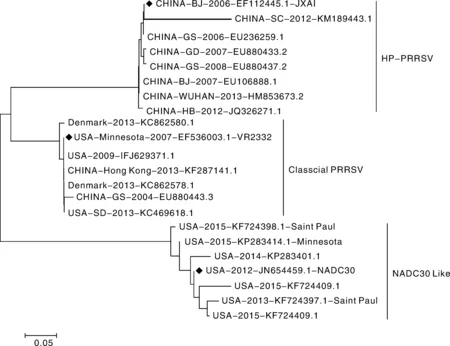
图1 不同基因类型遗传进化分析Fig.1 Genetic evolution analysis of different gene types
2 Nsp2与PRRSV毒力
从经典PRRSV、HP- PRRSV和NADC30类PRRSV的Nsp2变异的情况分析,研究人员们一直怀疑Nsp2的氨基酸缺失导致了HP- PRRSV毒力的增强,但是现已通过多个强、弱毒株基因片段置换试验证明其与毒力并无关联。Zhou等[22]在HP- PRRSV反向遗传操作平台的基础上通过分别置换强毒株JXwn6和弱毒株HB- 1/3.9的相对应的Nsp2区域,然后恢复病毒测定病毒的致病力,动物实验结果表明,互相置换了Nsp2相应区域的恢复毒株与亲本株的致病力无异。
Li等[23]在HP- PRRSV反向遗传操作平台的基础上通过分别置换强毒株JXwn6和弱毒株HB- 1/3.9的5’UTR+ORF1a和ORF1b以及M和N蛋白,然后恢复病毒测定病毒致病力,结果表明置换ORF1a的恢复病毒不管是强毒株还是弱毒株,毒力没有相应减弱或增强。这2个试验充分表明HP- PRRSV的Nsp2连续缺失30 aa并不是其毒力增强的主要原因。
3 Nsp2与PRRSV复制
病毒的复制有时需要利用宿主蛋白,但是自身的一些非结构蛋白也会参与病毒的复制过程。PRRSV是正链RNA病毒,复制过程在细胞质靠近细胞核的双层囊泡中进行,而对Nsp2的亚细胞定位结果显示其定位于细胞核周围,与双层囊泡的位置相一致,是病毒复制和转录的关键区域[24]。王凤雪等[25]通过将HP- PRRSV弱毒株TJM株的Nsp2稳定转染到Marc- 145细胞中,建立了稳定表达Nsp2蛋白的细胞系,通过接种病毒测定病毒含量发现Nsp2蛋白能够促进PRRSV的增殖。在对Nsp2影响PRRSV复制的深入研究中发现,Nsp2的aa323~aa433和aa628~aa747虽不是PRRSV复制的关键位点,但在PRRSV复制过程中起到了重要的作用[26]。进一步通过截断蛋白瞬时表达的方式探索Nsp2中缺失的氨基酸与PRRSV复制是否有关,发现TJM株Nsp2中缺失的120 aa中的aa628~aa727能够抑制病毒的增殖[27]。在对Nsp2的N端的半胱氨酸蛋白酶结构域(PL2)和功能尚不明确的C端富含半胱氨酸残基保守区病毒复制的影响的试验研究发现,在C末端插入EGFP蛋白并不能对病毒的复制造成影响,EGFP蛋白能正常表达,但是对N端的研究表明,PL2的反向切割活性在病毒复制过程中是非常重要的。进一步对其精确的位点的研究发现,PL2的核心域(aa47~aa180)和直接下游区域(aa181~aa323)是病毒复制必不可少的[28-29]。
除Nsp2直接影响病毒的复制以外,还存在其他途径影响病毒增殖,细胞中的一些蛋白质也能通过与Nsp2互作来影响PRRSV的复制,Nsp2招募Bcl2相关抗凋亡基因6(BAG6)蛋白并利用该蛋白帮助NSP2定位于内质网促进双层膜泡的形成[30]。细胞中的14- 3- 3蛋白家族是常见的蛋白家族,通过激光共聚焦和过表达最终确定14- 3- 3蛋白能够作用Nsp2促进PRRSV的增殖[31]。Nsp2利用N端的半胱氨酸蛋白酶的去泛素化酶活性抑制凋亡诱导分子1(AIF1)的泛素化降解,从而促进PRRSV复制过程中胞内ATP的合成[32]。同时也有研究表明病毒复制过程中自身产生的miRNA(微小核糖核酸)能够直接靶向Nsp2基因来抑制病毒的增殖,形成负调控[33]。
总之,通过由简到繁、由全蛋白到关键位点的对Nsp2影响、参与病毒复制的研究表明,Nsp2的高变区域依旧有一些关键位点能够影响病毒的复制,其N- 末端和C- 末端的一部分区域在病毒复制过程中是至关重要的。
4 Nsp2与免疫调控
Nsp2蛋白是病毒蛋白中最大的蛋白,它参与多肽的组合和病毒的复制等复杂的过程,并富含抗原表位[34]。近年来,关于PRRSV对猪免疫抑制的报道主要集中在对各种细胞因子的抑制及促进方面,以间接反映宿主免疫反应情况。Beura等[35]发现,PRRSV的4个非结构蛋白对IFN- β启动子(IRF- 3)的活性起到有效的抑制作用。依据它们的影响大小,排序为Nsp1、Nsp2、Nsp11和Nsp4。Li等[36]证明,Nsp2通过抵抗IFN调节因子3(IRF- 3)的活性进而强烈地抑制由仙台病毒诱导的IFN- β产生。有研究显示,Nsp2蛋白在PRRSV感染细胞的胞质内分布,并与RIG- I信号通路中的一个衔接分子MAVS和能够激活细胞内I型IFN信号通路的信号分子LSml4A共定位,但不影响IRF- 3或NF- κB入核,表明PRRSV对先天免疫的影响可能在细胞核内[6]。Sun等[37]证明,Nsp2的卵巢肿瘤蛋白酶(OTU)区域具有泛素连接酶活性,这个区域可以通过对IκBα聚泛素化而抑制IκBα的降解,而IκBα是NF- κB的抑制因子,从而抑制NF- κB的活性而抑制IFN- I的产生。而Fang等[38]证明,PRRSV WUH3株Nsp2蛋白的过量表达能够诱导IκBα降解,激活NF- κB。并且确定了Nsp2的高变区(aa179~aa782)对于激活NF- κB是不可缺少的,并且它所刺激的活性与Nsp2全长基本一致。非结构蛋白还可以诱导产生IFN- γ和IL- 10。Burgara- Estrella等[39]通过动物试验确定PRRSV Nsp2的非保守多肽(589SLYKLLLEV597)可以引起猪的免疫反应,并产生IFN- γ。Xing等[26]通过缺失多株PRRSV Nsp2高变区的片段研究其对机体免疫诱导的影响,发现缺失aa322~aa434、aa531~aa561和aa531~aa561、aa627~aa748的恢复毒株诱导IL- 1β、IL- 6和TNF- α的能力降低,但aa531~aa561、aa627~aa748缺失株却能强烈诱导IL- 12(P40)的表达。
5 Nsp2的可插入位点与分子标签
Nsp2的非必需区域能够插入表达外源蛋白,目前关于对Nsp2插入外源蛋白的位点和外源蛋白的种类做了很多的研究。同时由于Nsp2的高突变导致其不同亚型之间插入和缺失突变非常严重,能够利用其毒株之间的插入和缺失来区分毒株亚型,同样也起到分子标签的作用[40]。
Kim等[41]通过在Nsp2非关键区进行缺失并插入肽标签,发现拯救病毒株毒力显著降低,并能被特异抗原包被的ELISA试剂盒检测,再次验证了Nsp2是用来发展标记疫苗和弱毒苗的潜在靶基因。Xu等[42]在对疫苗毒HuN4- F112 Nsp2复制非关键区缺失25个氨基酸,并插入新城疫病毒N蛋白免疫显性B细胞表位49个氨基酸作为一种基因标记疫苗,在动物体内能同时产生对抗NDV NP及PRRSV的特异性抗体,而且缺乏针对缺失的25个氨基酸的抗体,免疫猪获得很好的免疫保护,该疫苗可以作为一种有效的对抗PRRSV的基因标记苗。
Yu等[43]利用反向遗传操作平台将猪的粒细胞- 巨噬细胞集落刺激因子(GM- CSF)插入到HuN- F112的ORF1b与ORF2a之间作为分子标记,后续试验表明GM- CSF能够稳定地随着病毒复制而表达,说明在这一区域能够允许外源蛋白的插入。
6 展望
随着对PRRSV Nsp2蛋白的深入研究,Nsp2在病毒复制、致病性、机体相互作用方面的作用也越来越清晰。Nsp2基因在不同亚型中的特征性变异,为PRRSV变异亚型的鉴定提供依据,同时,这些研究也揭示了Nsp2氨基酸的变异不是PRRSV的毒力改变的主要因素,但是Nsp2蛋白在PRRSV的复制、免疫调控等方面扮演着重要的角色。Nsp2 能够直接影响病毒的复制,并且Nsp2也能通过与细胞中的一些蛋白质互作来影响PRRSV的复制。Nsp2对IFN- β启动子(IRF- 3)的活性起到有效的抑制作用,从而抑制病毒诱导宿主产生IFN- β。Nsp2的卵巢肿瘤蛋白酶(OUT)区域可以通过对IκBα聚泛素化而抑制IκBα的降解,从而抑制NF- κB的活性而抑制IFN- I的产生。Nsp2的高变区(aa179~aa782)对于激活NF- κB是不可缺少的。同时,Nsp2非必需区域的高变性为PRRSV作为载体插入外源蛋白和分子标签提供了可能。对Nsp2蛋白的功能研究有助于阐明PRRSV非结构蛋白参与免疫调控网络,同时Nsp2蛋白的遗传变异研究有助于相关重组疫苗的研究和分子标签的应用,为疫苗株和野毒株的鉴定提供参照。
[1] FANG Y, SNIJDER E J. The PRRSV replicase: exploring the multifunctionality of an intriguing set of nonstructural proteins[J].VirusResearch, 2010, 154(1/2):61-76.
[2] FANG Y, TREFFERS E E, LI Y, et al. Efficient- 2 frameshifting by mammalian ribosomes to synthesize an additional arterivirus protein[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2012, 109(43):E2920-E2928.
[3] LI Y, TREFFERS E E, NAPTHINE S, et al. Transactivation of programmed ribosomal frameshifting by a viral protein[J].ProceedingsoftheNationalAcademyofSciencesoftheUnitedStatesofAmerica, 2014, 111(21):2172-2181.
[4] LI Y, TAS A, SNIJDER E J, et al. Identification of porcine reproductive and respiratory syndrome virus ORF1a- encoded non- structural proteins in virus- infected cells[J].JournalofGeneralVirology, 2012, 93(4):829-839.
[5] HAN J, RUTHERFORD M S, FAABERG K S. Proteolytic products of the porcine reproductive and respiratory syndrome virus nsp2 replicase protein[J].JournalofVirology, 2010, 84(19):10102-10112.
[6] 温贵兰, 张涵淞, 扈鸿霞, 等. 猪繁殖与呼吸综合征病毒感染细胞中非结构蛋白Nsp2表达分析[J]. 畜牧兽医学报, 2013, 44(7):1109-1116.
WEN G L, ZHANG H S, HU H X, et al. Analysis of Nsp2 expression in porcine reproductive and respiratory syndrome virus infected cells[J].ActaVeterinariaetZootechnicaSinica, 2013, 44(7):1109-1116. (in Chinese with English abstract)
[7] WANG F X, WEN Y J, YANG B C, et al. Role of non- structural protein 2 in the regulation of the replication of the porcine reproductive and respiratory syndrome virus in MARC- 145 cells: effect of gene silencing and over expression[J].VeterinaryMicrobiology, 2012, 161(1/2):58-65.
[8] KAPPES M A, MILLER C L, FAABERG K S. Highly divergent strains of porcine reproductive and respiratory syndrome virus incorporate multiple isoforms of nonstructural protein 2 into virions[J].JournalofVirology, 2013, 87(24):13456-13465.
[9] FANG Y, KIM D Y, ROPP S, et al. Heterogeneity in Nsp2 of European- like porcine reproductive and respiratory syndrome viruses isolated in the United States[J].VirusResearch, 2004, 100(2):229-235.
[10] LIU J K, WEI C H, YANG X Y, et al. Genetic diversity and evolutionary characterization of Chinese porcine reproductive and respiratory syndrome viruses based on NSP2 and ORF5[J].ArchivesofVirology, 2013, 158(8):1811-1816.
[11] 童光志, 周艳君, 郝晓芳, 等. 高致病性猪繁殖与呼吸综合征病毒的分离鉴定及其分子流行病学分析[J]. 中国预防兽医学报, 2007, 29(5):323-327.
TONG G Z, ZHOU Y J, HAO X F, et al. Identification and molecular epidemiology of the very virulent porcine reproductive and respiratory syndrome virus emerged in China[J].ChineseJournalofPreventiveVeterinaryMedicine, 2007, 29(5):323-327. (in Chinese with English abstract)
[12] HAN J, WANG Y, FAABERG K S. Complete genome analysis of RFLP 184 isolates of porcine reproductive and respiratory syndrome virus[J].VirusResearch, 2007, 122(1/2):175-182.
[13] BROCKMEIER S L, LOVING C L, VORWALD A C, et al. Genomic sequence and virulence comparison of four Type 2 porcine reproductive and respiratory syndrome virus strains[J].VirusResearch, 2012, 169(1):212-221.
[14] CHOI H W, NAM E, LEE Y J, et al. Genomic analysis and pathogenic characteristics of Type 2 porcine reproductive and respiratory syndrome virus nsp2 deletion strains isolated in Korea[J].VeterinaryMicrobiology, 2014, 170(3/4):232-245.
[15] 毛汐语, 周远成, 赵军, 等. 猪繁殖与呼吸综合征病毒四川株的分离鉴定及Nsp2生物信息学分析[J]. 中国兽医科学, 2016(12):1497-1504.
MAO X Y, ZHOU Y C, ZHAO J, et al. Identification of porcine reproductive and respiratory syndrome virus strains from Sichuan and Nsp2 bioinformatics analysis[J].ChineseVeterinaryScience, 2016(12):1497-1504. (in Chinese with English abstract)
[16] GAO Z Q, GUO X, YANG H C. Genomic characterization of two Chinese isolates of porcine respiratory and reproductive syndrome virus[J].ArchivesofVirology, 2004, 149(7):1341-1351.
[17] LIU J K, WEI C H, DAI A L, et al. Complete genomic characterization of two European- genotype porcine reproductive and respiratory syndrome virus isolates in Fujian province of China[J].ArchivesofVirology, 2017, 162(3):823-833.
[18] LIU J K, ZHOU X, ZHAI J Q, et al. Emergence of a novel highly pathogenic porcine reproductive and respiratory syndrome virus in China[J].Transboundary&EmergingDiseases, 2017, 64(6):2059-2074.
[19] JI G, LI Y, TAN F, et al. Complete genome sequence of a Chinese highly pathogenic porcine reproductive and respiratory syndrome virus that has a further deletion in the Nsp2 gene[J].GenomeAnnouncements, 2016, 4(1):e01770-e01715.
[20] 刘建奎, 魏春华, 杨小燕, 等. 福建地区PRRSV分离株Nsp2基因新变异序列鉴定[J]. 中国预防兽医学报, 2013, 35(4): 271-275.
LIU J K, WEI C H, YANG X Y, et al. Genetic variation of Nsp2 genes of porcine reproductive and respiratory syndrome virus isolated in Fujian province[J].ChineseJournalofPreventiveVeterinaryMedicine, 2013,35(4):271-275. (in Chinese with English abstract)
[21] SHEN J, YAN X, DONG J, et al. Complete genome sequence of a novel deletion porcine reproductive and respiratory syndrome virus strain[J].GenomeAnnouncements, 2013, 1(4):e00486.
[22] ZHOU L, ZHANG J, ZENG J, et al. The 30- amino- acid deletion in the Nsp2 of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China is not related to its virulence[J].JournalofVirology, 2009, 83(10):5156-5167.
[23] LI Y, ZHOU L, ZHANG J, et al. Nsp9 and Nsp10 contribute to the fatal virulence of highly pathogenic porcine reproductive and respiratory syndrome virus emerging in China[J].PLoSPathogens, 2014, 10(7):e1004216.
[24] MUSIC N, GAGNON C A. The role of porcine reproductive and respiratory syndrome (PRRS) virus structural and non- structural proteins in virus pathogenesis[J].AnimalHealthResearchReviews, 2010, 11(2):135-163.
[25] 王凤雪, 刘准, 温永俊, 等. 表达PRRSV强弱毒Nsp2的Marc- 145细胞系的建立及Nsp2蛋白对PRRSV复制的影响[J]. 西北农业学报, 2012, 21(3):1-6.
WANG F X, LIU Z, WEN Y J, et al. The construction of Marc- 145 cell lines expressing Nsp2 gene of PRRSV and Nsp2 protein effect on PRRSV replication[J].ActaAgriculturaeBoreali-OccidentalisSinica, 2012, 21(3):1-6. (in Chinese with English abstract)
[26] XING L, BAI J, WANG H, et al. Effect of amino acids residues 323- 433 and 628- 747 in Nsp2 of representative porcine reproductive and respiratory syndrome virus strains on inflammatory responseinvitro[J].VirusResearch, 2015, 208:13-21.
[27] LIU Y, WANG F X, WEN Y J, et al. Effect of nonstructural protein 2 hypervariable regions in the replication of porcine reproductive and respiratory syndrome virus in Marc- 145 Cells[J].Intervirology, 2015, 58(5):288-296.
[28] KIM D Y, CALVERT J G, CHANG K O, et al. Expression and stability of foreign tags inserted into nsp2 of porcine reproductive and respiratory syndrome virus (PRRSV)[J].VirusResearch, 2007, 128(1/2):106-114.
[29] HAN J, RUTHERFORD M S, FAABERG K S. The porcine reproductive and respiratory syndrome virus nsp2 cysteine protease domain possesses both trans- and cis- cleavage activities[J].JournalofVirology, 2009, 83(18):9449-9463.
[30] WANG L, ZHOU L, ZHANG H, et al. Interactome profile of the host cellular proteins and the nonstructural protein 2 of porcine reproductive and respiratory syndrome virus[J].PLoSOne, 2014, 9(6):e99176.
[31] XIAO Y, WU W, GAO J, et al. Characterization of the interactome of the porcine reproductive and respiratory syndrome virus nonstructural protein 2 reveals the hyper variable region as a binding platform for association with 14- 3- 3 proteins[J].JournalofProteomeResearch, 2015, 15(5):1388-1401.
[32] 王丽. PRRSV Nsp2与宿主细胞蛋白BAG6和AIF1相互作用的分子机制[D]. 北京:中国农业大学, 2014.
WANG L. Molecular mechanisms of the interaction of PRRSV Nsp2 with host cellular proteins BAG6 and AIF1 [D]. Beijing: China Agricultural University, 2014.
[33] LI N, YANG Y, ZHANG A, et al. MicroRNA- like viral small RNA from porcine reproductive and respiratory syndrome virus negatively regulates viral replication by targeting the viral nonstructural protein 2[J].Oncotarget, 2016, 7(50):82902-82920.
[34] 马玲, 李广兴, 洪琴, 等. 猪繁殖与呼吸综合征病毒HH08株NSP2蛋白多克隆抗体的制备及其生物学功能的研究[J]. 中国兽医科学, 2013(4):377-383.
MA L, LI G X, HONG Q, et al. Preparation and biological function of polyclonal antibodies against NSP2 porcine reproductive and respiratory syndrome virus HH08 strain[J].ChineseVeterinaryScience, 2013(4):377-383. (in Chinese with English abstract)
[35] BEURA L K, SARKAR S N, KWON B J, et al. Porcine reproductive and respiratory syndrome virus nonstructural protein 1β modulates host innate immune response by antagonizing IRF3 activation[J].JournalofVirology, 2010, 84(3):1574-1584.
[36] LI H, ZHENG Z, ZHOU P, et al. The cysteine protease domain of porcine reproductive and respiratory syndrome virus non- structural protein 2 antagonizes interferon regulatory factor 3 activation[J].JournalofGeneralVirology, 2010, 91(12):2947-2958.
[37] SUN Z, CHEN Z H, LAWSON S R, et al. The cysteine protease domain of porcine reproductive and respiratory syndrome virus nonstructural protein 2 possesses deubiquitinating and interferon antagonism functions[J].JournalofVirology, 2010, 84(15):7832-7846.
[38] FANG Y, FANG L, WANG Y, et al. Porcine reproductive and respiratory syndrome virus nonstructural protein 2 contributes to NF- κB activation[J].VirologyJournal, 2012, 9(1):1-10.
[39] BURGARA- ESTRELLA A, DIAZ I, RODRGUEZGMEZ I M, et al. Predicted peptides from non- structural proteins of porcine reproductive and respiratory syndrome virus are able to induce IFN- γ and IL- 10[J].Viruses, 2013, 5(2):663-677.
[40] YOSHII M, OKINAGA T, MIYAZAKI A, et al. Genetic polymorphism of the nsp2 gene in North American type- porcine reproductive and respiratory syndrome virus[J].ArchivesofVirology, 2008, 153(7):1323-1334.
[41] KIM D Y, KAISER T J, HORLEN K, et al. Insertion and deletion in a non- essential region of the nonstructural protein 2 (nsp2) of porcine reproductive and respiratory syndrome (PRRS) virus: effects on virulence and immunogenicity[J].VirusGenes, 2009, 38(1):118-128.
[42] XU Y Z, ZHOU Y J, ZHANG S R, et al. Stable expression of foreign gene in nonessential region of nonstructural protein 2 (nsp2) of porcine reproductive and respiratory syndrome virus: applications for marker vaccine design[J].VeterinaryMicrobiology, 2012, 159(1/2):1-10.
[43] YU L, ZHOU Y, JIANG Y, et al. Construction and in vitro evaluation of a recombinant live attenuated PRRSV expressing GM- CSF[J].VirologyJournal, 2014, 11(1):201.

