可吸收肋骨内固定装置的研究现状
王宇飞 郭占林
肋骨骨折是最常见的胸部创伤,单根肋骨骨折一般经保守治疗可治愈,但多根或多处肋骨骨折并伴有严重移位,会影响呼吸循环功能的多需要手术固定。目前,肋骨固定的装置种类较多,包括钢丝及丝线固定、记忆金属环抱器、可吸收肋骨髓内钉、钢板、钛合金环抱器等。各类材料均有各自的特点和不足,理想的肋骨固定装置应该是可吸收且并发症少,有较好机械性能的材料。
一、 可吸收材料发展背景
生物可降解聚合物早在1965年随着合成可吸收缝合线[1]的首次出现而为人们所知,但是由于被生物体完全吸收需要数年的时间而迟迟没有市场化。在此之前,仅有的可吸收材料为自然界存在的肠衣和胶原纤维,其他合成材料随着市场需要逐渐被开发出来。1970年的聚二乙炔(polydiacetylene,PDA) 缝合线[2];1973年出现的由聚乙醇酸和聚乳酸(PGA&PLA)组成的缝合线[3];20世纪80年代初的聚二氧六环酮(polydioxanone,PDS)[4];1985年作为骨骼固定的PDS钉子首先以Ethipin的命名在欧洲市场化[5]。金属类可降解材料镁金属类合金[6-9]自21世纪初成为研究的热点,2013年第一种可以在人体植入的镁合金类材料(MAGNEZIX screw)已经通过相关部门的批准。新一代基于蚕丝的可降解材料在温度高于170 ℃时仍可以保持结构的稳定性和耐酸碱性[10]。迄今为止,还没有使用这些材料而导致过敏或者癌变的证据。目前,很多研究[11-16]都集中在寻找新的材料(新的聚合物或者调配共聚物的比例)上,主要通过动物实验(鼠,兔、猪等)考察其实际效果。
二、 常用的可降解材料及其性质
金属类材料固定骨骼的方法在临床应用中仍旧占主导地位,通常包括不锈钢、金属钛以及钛合金等材料制成。金属类固定装置固然非常有效,但会引起局部移位、断裂或组织发炎,也可能会引起局部骨质疏松,限制儿童骨骼生长。另外,体内有金属类异物会导致射线无法穿透,妨碍需要相应治疗的患者。可降解材料在骨折区域的固定已经成为目前发展的一个趋势,可吸收材料目前多用于需要承重较小的部位,如颌骨、颅骨[17-19]。可吸收材料可以被生物体逐步吸收,逐渐导致机械压力从内部固定装置到周边软组织的转移,可吸收装置的应力会逐渐减小[20,21]。在几种可吸收内部固定装置中,目前最成功的聚合物材料是由阿尔法聚酯组成。使用最普遍的可降解固定材料有:聚乙醇酸[polyglycolic acid (Biofix)][22])、聚乙醇酸和PLA的共聚物(polyglactin 910)[23]以及聚对二氧环己酮[poly-paradioxanone(Orthosorb)][24];聚左旋乳酸(poly-L-lactide,PLLA)是在医疗器械中应用最广的可吸收材料。
对于可吸收材料来说,降解速度和生物相容性是要考虑的两个关键因素[25-30]。聚合物降解是一个复杂的过程,会受到一系列因素的影响,如聚合物的晶形、手性、分子量、尺寸、形状和处理条件。加入无机相会增加聚合物降解的复杂性[31],加入有生物活性的玻璃会相较纯聚合物促进吸水性的增加和重量的减少。降解速度受很多因素的影响,包括聚合物的化学成分、分子量分布、晶体/无定形的比例、植入的尺寸和形状、聚合物的处理方法、植入位点,以及患者的年龄和新陈代谢情况[32-34]。
临床所用内部固定骨材料的性能比较见表1。

表1 临床所用内部固定骨材料的性能比较
注:①包括金属镁和镁合金;②包括聚乳酸、聚乙醇酸和聚L-谷氨酸
三、 市场化的可吸收材料的组成及临床效果
聚合物的降解速度从 PGA 和poly(para-dioxanone) 的数月到PLLA的数年时间[35-36]。在一段时间里,单一成分聚合物在市场中占主导地位;后来共聚物由于通过对成分和比例的调节,使额外对于性质的调控成为可能,应用逐渐广泛。PLA主要以两种形态存在:PLLA和左右旋混合聚乳酸[poly(D,L-lactide)],改变调节两者比例形成的共聚物可以决定强度、可塑性以及假体的降解等特性。可吸收材料与软组织、骨头、外围神经的生物相容性也是很多工作的研究重点。常用的高分子可吸收材料及其组成见表2。
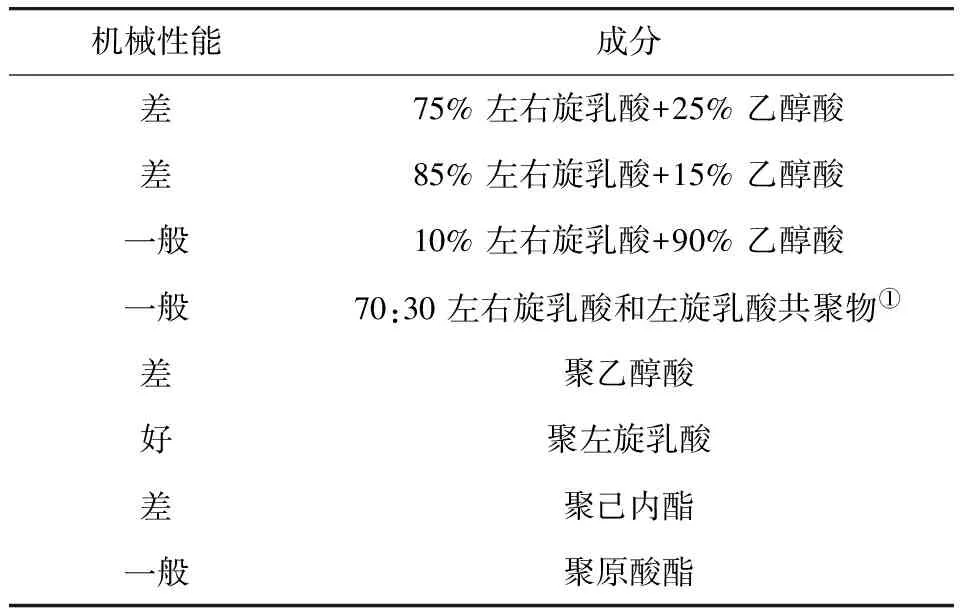
表2 常用的高分子可吸收材料及其组成
注:①可吸收固定板使用前在60 ℃热水中放置15 s,根据需要冷却固定塑形,并在体温中保持稳定。
大多数共聚物的降解速度介于 PGA 和 PLLA之间。降解太慢的PLLA可能导致很长一段时间仍然可以从体外触摸到,必要时需要手术介入。共聚物聚L-谷氨酸(poly L-glutamic acid,PLGA)是由羟基酸经由熔体聚合反应在双相催化剂作用下得到,这类共聚物的熔点随谷氨酸(glutamic acid,GA)成分的增加而减少,也随着消旋作用程度的增加而降低[37]。聚合物通过水解反应逐步降解,酯键与水反应断裂形成带羟基和羧酸的单体,直至到H2O和CO2。
在体内植入可吸收骨固定材料应该比相应的金属类装置体积稍大些,来抵消其由于被吸收而减弱的机械性能[38]。可吸收材料有两大主要优点:当材料被生物体吸收后,承重会逐渐重新转移到骨骼上,但金属装置由于比骨骼本身更加坚硬反倒会阻碍断裂处的愈合。已经用在临床骨头固定的可吸收装置包括骨钉、骨盘、螺丝用来固定裂纹;用在十字韧带上的界面骨钉;辅助半月板修复,各类钉子或缝合线用来辅助软组织以及骨的固定[39-42];螺钉、网格板用作颅骨颌面的固定。
另外,由于金属类材料具有良好的机械强度,对于其可降解性的探索和研究一直备受关注。镁及金属材料具有良好的综合力学性能,与骨组织接近的密度和弹性模量,可降低植入体内产生的应力屏蔽效应[43,44]。基于镁的金属材料(纯镁及镁合金)自21世纪初成为金属植入材料中的研究热点。镁是人体中含量较高的金属元素,因此,镁类材料除了具有可降解特性外,还具有良好的生物相容性。其具备的特异生物活性,可以促进骨细胞的增殖以及分化。这类装置多由纯镁或者合金组成,其他与镁组合的金属包括锶、锌、钙、钇、稀土金属等,或表面涂层的方法。镁类材料在研究之初遇到了不耐腐蚀的问题,而且会在皮下形成水肿,存在的气体孔削弱了其机械强度[45-47]。通过粉末冶金处理的镁金属(镁含量>90%),其拉伸强度>250 MPa。降解实验发现前6周质量减少在10%,而且拉出力也在几周后增强。经过一年的跟踪试验未发现由于气孔产生对骨头的腐蚀问题,2013年MAGNEZIX(MgYREZr)也被批准在人体内植入,长度为10~40 mm,降解速度因装置在皮质骨、骨髓部分还是肌肉部分不同而不同。目前已经对可降解镁及金属的体内外降解特性、生物学效应(促进骨、抗菌)、生物安全性等进行了深入和系统研究,相信很快会设计和制造出多种骨科及心血管支架等临床应用产品。
从已有的临床数据来看,即使是使用可吸收材料有些因素也会增加潜在风险的[48-52]:①植入的装置过大;②材料降解太快或者释放无法降解的聚合物晶体;③含有芳香环的材料;④患者年龄>40岁;⑤使用在血管新生较差的区域。因此,有研究人员建议将金属装置与可吸收装置两者结合使用。
四、 临床使用肋骨固定材料的结构和尺寸
当肋骨遇到强大外力损伤时,易多发肋骨骨折。多处肋骨骨折会导致胸壁坍塌,影响心肺功能,导致循环系统障碍,因此一般需要内固定手术治疗。肋骨钉属于髓内轴向固定模式,与肋骨弯曲弧度吻合,不干扰骨膜生长;而且肋骨钉侧面有防滑侧纹,有助于减少呼吸对固定效果的影响。可吸收骨钉常用材料为聚左旋乳酸螺钉(poly-L-lactic acid screws, PLLAs)[53],左旋乳酸由于已经获得美国食品药品管理局(Food and Drug Administration,FDA)批准而被广泛应用于临床。其具有操作简便、固定牢靠、胸廓外形恢复良好等优点;另外还有聚乙丙交酯[54],由PLA和羟基乙酸无规聚合而成,无毒,具有良好的生物相容性以及成囊、成膜性能。聚乙丙交酯是无定型聚合物,玻璃化温度40 ℃~60 ℃。与PLA相比,根据GA含量不同可控制聚合物降解时间,不同的单体比例可制备出不同类型的PLGA。肋骨钉长度一般在27~38 mm,宽度和厚度在 2~3 mm之间,但价格昂贵,固定牢固性较差,有引起骨髓感染的风险。
表3总结了临床使用的固定肋骨的几种装置,这些装置多在形状上做改变。固定肋骨最常用的为金属,很多时候需要固定板、骨钉、线等多种方式的混合使用。其中用的比较普遍的一个体系,由锁定板、螺钉和髓内夹板三部分组成[55,56]。设计不需要去除骨膜保证了最大程度上对骨骼的血液供应。三部分都是由钛合金制作,锁定板根据肋骨的弧度设计,厚度为1.5 mm;髓内夹板宽度3~5 mm,为进行微创手术提供了可能。

表3 临床常用的几种肋骨固定装置
可吸收的胸腔壁的生物桥板(biobridge chest wall plate)、PLA混合物提供了理想的稳定性和可吸收性间的平衡[57-59]。可以根据长度需要自由剪切;根据肋骨的弧度调整塑形;也可以叠在一起使用增加刚性。这类平板类材料在6个月内仍可以保持强度,24个月内被身体代谢。另一个常用装置是肋骨爪,在治疗多处骨折较传统方法有优势,减少了肺扩张不全、气胸等并发症发生的情况,主要由钛金属制造。
U型固定方式是通过结合U型板与螺丝锁定,板和螺丝都是由钛金属制成[57,58]。螺丝的直径为2.7 mm,需用4个螺丝来固定。 固定板有50、75、115、155、215 mm的长度选择,固定板和U型夹的最小距离为5 mm。U型装置的优点在于不依赖于骨质,从前面与后面分别锁定,可以根据骨头的厚度自由调节,不需要根据患者特别定制。在胸骨的愈合过程中,会承受多个维度比较复杂的作用力,固定线的使用使力量通过金属桩从边缘到胸骨的前部在板上分散,因而提供了更大的稳定性。
固定肋骨还有以下几个因素需要注意:①需要比较大的切口来实现固定;②肋骨比较窄,使得比较可靠的固定充满挑战;③固定后的肋骨必须要承受25 000个呼吸循环,以及相对剧烈的呼吸性反射动作;④对神经血管束破坏的风险[59,60]。
五、 展望
可吸收固定装置目前已经广泛应用于医学的各个领域,但是在肋骨固定中应用甚少,仅有由左旋乳酸制成的可吸收肋骨髓内钉获得FDA批准而被广泛应用于临床,但其缺点显而易见,不仅价格昂贵、固定牢固性较差,而且有引起骨髓感染的风险。因此,研究出更多具有力学性能优化、表面改性涂层等特点的可吸收肋骨固定装置是胸外科工作者追求的目标。期待更多新的肋骨固定器尽快进入临床,为患者带来福音。
1 Middleton JC, Tipton AJ. Synthetic biodegradable polymers as orthopedic devices [J]. Biomaterials, 2000,21(23):2335-2346.
2 Vihtonen K. Fixation of rabbit osteotomies with biodegradable polyglycolic acid thread[J]. Acta Orthop Scand 1988, 59(3): 279-283.
3 Vihtonen K, Vainionpaa S, Mero M, et al. Fixation of experimental osteotomies of the distal femur in rabbits with bone cement and cyanoacrylate[J]. Arch Orthop Trauma Surg, 1986, 105(3):133-136.
4 Plaga BR, Royster RM, Donigian AM, et al. Fixation of osteochon-dral fractures in rabbit knees. A comparison of Kirschner wires, fibrin sealant, and polydioxanone pins[J]. J Bone Joint Surg Br, 1992,74(2): 292-296.
5 Beiser IH, Kanat IO. Biodegradable internal fixation. A literature review[J]. J Am Podiatr Med Assoc, 1990, 80(2): 72-75.
6 Bondarenko A, Angrisani N, Meyer-Lindenberg A, et al. Magnesium-based bone implants: immunohistochemical analysis of peri-implant osteogenesis by evaluation of osteopontin and osteocalcin expression[J]. J Biomed Mater Res A, 2014,102(5):1449-1457.
7 Reifenrath J, Angrisani N, Erdmann N, et al. Degrading magnesium screws ZEK100: biomechanical testing, degradation analysis and soft-tissue biocompatibility in a rabbit model[J]. Biomed Mater, 2013, 8(4): 045012.
8 Seitz JM, Durisin M, Goldman J, et al. Recent advances in biodegradable metals for medical sutures: a critical review[J]. Adv Healthc Mater, 2015, 4(13):1915-1936.
9 Windhagen H, Radtke K, Weizbauer A, et al. Biodegradable magnesium-based screw clinically equivalent to titanium screw in hallux valgus surgery: Short term results of the first prospective, randomized, controlled clinical pilot study[J]. BioMed Eng Online, 2013, 12: 62.
10 Shi C, Pu X, Zheng G, et al. An antibacterial and absorbable silk-based fixation material with impressive mechanical properties and biocompatibility[J]. Sci Rep, 2016, 6: 37418.
11 Thormann U, Alt V, Heimann L, et al. The biocompatibility of degradable magnesium interference screws: an experimental study with sheep[J]. BioMed Res In, 2015: 943603.
12 Huang KN, Xu ZF, Sun JX,et al. Stabilization of multiple rib fractures in a canine model[J]. J Surg Res,2014,192(2): 621-627.
13 Al Salamah L, Babay N, Anil S, et al. Guided bone regeneration using resorbable and non-resorbable membranes: a histological study in dogs[J]. Odontostomatol Trop, 2012, 35(138): 43-50.
14 Hamada Y, Fujitani W, Kawaguchi N, et al. The preparation of PLLA/calcium phosphate hybrid composite and its evaluation of biocompatibility[J]. Dent Mater J, 2012, 31(6): 1087-1096.
15 Chen CC, Chueh JY, Tseng H, et al. Preparation and characterization of biodegradable PLA polymeric blends[J]. Biomaterials, 2003, 24(7): 1167-1173.
16 Yang C, Unursaikhan O, Lee JS, et al. Osteoconductivity and biodegradation of synthetic bone substitutes with different tricalcium phosphate contents in rabbits[J]. J Biomed Mater Res B Appl Biomater, 2014, 102(1) : 80-88.
17 Zelen CM, Young NJ. Alternative methods in fixation for capital osteotomies in hallux valgus surgery[J]. Clin Podiatr Med Surg, 2013, 30(3): 295-306.
18 Sukegawa S, Kanno T, Nagano D, et al. The clinical feasibility of newly developed thin flat-type bioresorbable osteosynthesis devices for the internal fixation of zygomatic fractures: Is there a difference in healing between bioresorbable materials and titanium osteosynthesis?[J] J Craniofac Surg, 2016, 27(8): 2124-2129.
19 Rodriguez-Chessa J, Olate S, Netto HD, et al. In vitro resistance of titanium and resorbable (poly L-co-DL lactic acid) osteosynthesis in mandibular body fracture[J]. Int J Oral Maxillofac Surg, 2014, 43(3): 362-366.
20 Oyamatsu H, Ohata N, Narita K. New technique for fixing rib fracture with bioabsorbable plate[J]. Asian Cardiovasc Thorac Ann, 2016, 24(7): 736-738.
21 Hasegawa S, Ishii S, Tamura J, et al. A 5-7 year in vivo study of high-strength hydroxyapatite/poly(L-lactide) composite rods for the internal fixation of bone fractures[J]. Biomaterials, 2006, 27(8): 1327-1332.
22 Ya’ish F, Bailey CA, Kelly CP, et al. Bioabsorbable fixation of scaphoid fractures and non-unions; analysis of early clinical outcomes[J]. Hand Surg, 2013, 18(3):343-349.
23 Bostman O, Vainionpaa S, Hirvensalo E, et al. Biodegradable internal fixation for malleolar fractures: a prospective randomisedtrial[J]. J Bone Joint Surg Br, 1987, 69(4): 615-619.
24 Tormala P, Vainionpaa S, Kilpikari J, et al. The effects of fibre reinforcement and gold plating on the flexural and tensile strength of PGA/PLA copolymer materials in vitro[J]. Biomaterials, 1987, 8(1): 42-45.
25 Felfel RM, Ahmed I, Parsons AJ, et al.Invitrodegradation, flexural, compressive and shear properties of fully bioresorbable composite rods[J]. J Mech Behav Biomed Mater, 2011,4(7): 1462-1472.
26 Shin SI, Herr Y, Kwon YH, et al. Effect of a collagen membrane combined with a porous titanium membrane on exophytic new bone formation in a rabbit calvarial model.[J] J Periodontol, 2013, 84(1): 110-116.
27 Annunziata M, Nastri L, Borgonovo A, et al. Poly-D-L-lactic acid membranes for bone regeneration[J]. J Craniofac Surg, 2015, 26(5): 1691-1696.
28 Arat A, Daglioglu E, Akmangit I, et al. Bioresorbable vascular scaffolds in interventional neuroradiology[J]. Clin Neuroradiol, 2017. doi: 10.1007/s00062-017-0609-5. Ahead of Print.
29 Athanasiou KA, Agrawal CM, Barber FA, et al. Orthopaedic applications for PLA-PGA biodegradable polymers[J]. Arthroscopy, 1998,14(7):726-737.
30 Eppley BL, Reilly M. Degradation characteristics of PLLA-PGA bone fixation devices[J]. J Craniofac Surg,1997, 8(2): 116-120.
31 Vergnol G, Ginsac N, Rivory P, et al.Invitroandinvivoevaluation of a polylactic acid-bioactive glass composite for bone fixation devices[J]. J Biomed Mater Res B: Applied Biomater, 2016,104B(1): 180-191.
32 Kounis NG, Koniari I, Roumeliotis A, et al. Thrombotic responses to coronary stents, bioresorbable scaffolds and the Kounis hypersensitivity-associated acute thrombotic syndrome[J]. J Thorac Dis, 2017, 9(4):1155-1164.
33 Bostman OM. Intense granulomatous inflammatory lesions associated with absorbable internal fixation devices made of polyglycolide in ankle fractures[J]. Clin Orthop Relat Res, 1992, (278):193-199.
34 Nguyen DC, Woo AS, Farber SJ, et al. Comparison of resorbable plating systems: complications during degradation[J]. J Craniofac Surg, 2017, 28(1): 88-92.
35 Edwards RC, Kiely KD, Eppley BL. Resorbable PLLA-PGA screw fixation of mandibular sagittal split osteotomies[J]. J Craniofac Surg,1999,10(3):230-236.
36 Pietrzak WS. Heat adaptation of bioabsorbable craniofacial plates: a critical review of science and technology[J]. J Craniofac Surg, 2009, 20(6): 2180-2184.
37 Hutmacher DW. Scaffolds in tissue engineering bone and cartilage[J]. Biomaterials 2000, 21(24): 2529-2543.
38 Tashjian RZ, Kolz CW, Suter T, et al. Biomechanics of polyhydroxyalkanoate mesh-augmented single-row rotator cuff repairs[J]. Am J Orthop (Belle Mead NJ), 2016, 45(7): E527-E533.
39 Athanasiou KA, Agrawal CM, Barber FA, et al. Orthopaedic applications for PLA-PGA biodegradable polymers[J]. Arthroscopy,1998,14(7):726-737.
40 Böstman OM, Pihlajam?ki HK, Partio EK, et al. Clinical biocompatibility and degradation of polylevolactide screws in the ankle[J]. Clin Orthop Relat Res, 1995,(320):101-109.
41 Kim JS, Cho HK, Young KW, et al. Effectiveness of headless bioabsorbable screws for fixation of the scarf osteotomy[J]. Foot Ankle Int, 2016, 37(11): 1189-1196.
42 Bergsma JE, de Bruijn WC, Rozema FR, et al. Late degradation tissue response to poly(L-lactide) bone plates and screws[J]. Biomaterials 1995, 16(1): 25-31.
43 Berglund IS, Dirr EW, Ramaswamy V, et al. The effect of Mg-Ca-Sr alloy degradation products on human mesenchymal stem cells[J]. J Biomed Mater Res B Appl Biomater, 2018, 106(2):697-704.
44 Liu J, Zheng B, Wang P, et al. Enhancedinvitroandinvivoperformance of Mg-Zn-Y-Nd alloy achieved with APTES pretreatment for drug-eluting vascular stent application[J]. ACS Appl Mater Interfaces, 2016, 8(28): 17842-17858.
45 Bose D, Eggebrecht H, Haude M, et al. First absorbable metal stent implantation in human coronary arteries[J]. Am Heart Hosp J, 2006, 4(2): 128-130.
46 Noh JH, Roh YH, Yang BG, et al. Outcomes of operative treatment of unstable ankle fractures: a comparison of metallic and biodegradable implants[J]. J Bone Joint Surg Am, 2012, 94(22): e166.
47 Leno MB, Liu SY, Chen CT, et al. Comparison of functional outcomes and patient-reported satisfaction between titanium and absorbable plates and screws for fixation of mandibular fractures: a one-year prospective study[J]. J Craniomaxillofac Surg, 2017, 45(5): 704-709.
48 Balestro JC, Young A, Maccioni C, et al. Graft osteolysis and recurrent instability after the Latarjet procedure performed with bioabsorbable screw fixation[J]. J Shoulder Elbow Surg, 2015, 24(5): 711-718.
49 Loubignac F, Lecuire F, Rubini J, et al. Troublesome radiologic changes after reconstructive fixation of the anterior cruciate ligament with resorbable interference screws[J]. Acta Orthop Belg, 1998, 64(1): 47-51.
50 Gonzalez-Lomas G, Cassilly RT, Remotti F, et al. Is the etiology of pretibial cyst formation after absorbable interference screw use related to a foreign body reaction? [J] Clin Orthop Relat Res, 2011, 469(4):1082-1088.
51 Van der Eng DM, Schep NW, Schepers T. Bioabsorbable versus metallic screw fixation for tibiofibular syndesmotic ruptures: a meta-analysis[J]. J Foot Ankle Surg, 2015, 54(4): 657-662.
52 Clanton TO, Betech AA, Bott AM, et al. Complications after tendon transfers in the foot and ankle using bioabsorbable screws[J]. Foot Ankle Int, 2013, 34(4): 486-490.
53 Zhang P, Wu H, Lu Z, et al. RGD-conjugated copolymer incorporated composite of poly(lactide-co-glycotide) and oly(L-lactide)-grafted nanohydroxyapatite for bone tissue engineering[J]. Biomacromolecules, 2011, 12(7): 2667-2680.
54 Lim LT, Tsuji H, Auras RA, et al. Poly (lactic acid): synthesis, structures, properties, processing, and applications[M]. Hoboken: Wiley, 2010.
55 Simon JA, Ricci JL, DiCesare PE. Bioresorbable fracture fixation in orthopaedics: a comprehensive review. Part I. Basic science and preclinical studies[J]. Am J Orthop, 1997, 26(10): 665-671.
56 Athanassiadi K, Kalavrouziotis G, Rondogianni D, et al. Primary chest wall tumors: early and long-term results of surgical treatment[J]. Eur J Cardiothorac Surg, 2001, 19(5): 589-593.
57 Coonar AS, Qureshi N, Smith I, et al. A novel titanium rib bridge system for chest wall reconstruction[J]. Ann Thorac Surg, 2009, 87(5): e46-e48.
58 Chai X, Lin Q, Ruan Z, et al. The clinical application of absorbable intramedullary nail and claw plate on treating multiple rib fractures[J]. Minerva Chir, 2013, 68(4): 415-420.
59 Lionelli GT, Korentager RA. Biomechanical failure of metacarpal fracture resorbable plate fixation[J]. Ann Plast Surg, 2002, 49(2): 202-206.
60 Nirula R, Diaz Jr J, Trunkey D, et al. Rib fracture repair: technical issues, and future directions[J]. World J Surg, 2009, 33(1):14-22.

