绵羊凝血酶敏感因子1(TSP-1)基因的克隆及在不同生长时期卵泡中的表达
李晓林,陈 莹,吴阳升,林嘉鹏,汪立芹,黄俊成,贾 斌
(1.新疆维吾尔自治区畜牧科学院 生物技术研究所/农业部草食家畜遗传育种与繁殖重点开放实验室,新疆 乌鲁木齐 830000;2.石河子大学 动物科技学院,新疆 石河子 832003)
卵泡从原始卵泡发育成为排卵前卵泡的过程中,卵泡的表面积和直径随之增加。卵母细胞从这些卵泡库中小批量、周期性的生长,并经历一系列的分裂和成熟过程,最终排卵。经卵泡刺激素(FSH)处理一月龄羔羊后,可导致比成年羊多10倍以上的卵泡发育[1]。故以羔羊为供体可以为胚胎体外生产提供大量的卵母细胞资源,从而缩短世代间隔。对卵泡发育相关基因的筛选与功能研究对于绵羊的育种具有重要科学意义和应用前景。课题组在比较激素诱导羔羊和成年羊激素诱导后发育卵泡颗粒细胞转录组差异时,鉴定300多个基因的转录水平有显著差异。其中FSH诱导后羔羊TSP-1的表达显著下调,而成年羊在激素诱导前后则无显著变化[2]。故推测羔羊卵泡颗粒细胞中存在与成年羊不同的TSP-1信号通路,该通路可能与羔羊卵泡的超数发育数量有关,即与卵泡的募集有关。
凝血酶敏感蛋白1(thrombospondin1,TSP-1)是一种最早分离于血小板膜中的基质细胞蛋白[3]。从结构上来看,TSP-1包括一个肝素结合球形的N末端,3个类型的重复序列,一个RGDA序列及一个C末端[4]。其中N末端可以与低密度脂蛋白受体相关蛋白以及肝素硫酸蛋白多糖及一些整合素结合进而调节蛋白酶活性和对血管生成产生重要作用[5]。TSP-1具有多种生物学功能,可以与多种配体结合在血管生成、脂代谢、动脉粥样硬化、肿瘤抑制和卵泡发育等方面发挥作用[6-8]。研究表明TSP-1广泛分布于人的心、肺、脑[9],牛的卵巢和羊的肺泡等组织中[10-11],但关于该基因在绵羊除肺泡外各个组织中的分布和表达还没有报道。
本文以新疆阿勒泰羊为研究对象,利用PCR扩增TSP-1 CDS区全长,对克隆的TSP-1的理化性质,二级结构,功能域等进行生物信息学分析,同时构建分子系统进化树。在mRNA水平上分析TSP-1在不同组织和不同发育时期卵泡中表达差异,以期为后续深入研究TSP-1基因的功能提供理论依据。
1 材料和方法
1.1 材料
阿勒泰羊选自新疆畜牧科学院绵羊繁育基地,在1周岁时选取5头健康绵羊进行屠宰,取7个组织样(心、肝、脾、肺、肾、肌肉、卵巢),现场放于RNA保护剂中,4 ℃过夜保存,提取RNA。母羊屠宰后立即剪取卵巢并置于37 ℃生理盐水中(含青、链霉素双抗),1~2 h内运至实验室。根据有腔卵泡直径大小用剪刀和镊子分离卵泡(<3 mm,小卵泡;3~5 mm,中卵泡;>5 mm,大卵泡),用2 mL注射器抽取不同直径卵泡中卵泡液[2]。每组有3个重复,每个重复包含来自3~5头绵羊的卵泡混合成一个池(小有腔卵泡一般用10~15个卵泡做一个池;大有腔卵泡一般用3~5个卵泡做一个池)。
1.2 引物设计
根据GenBank中绵羊TSP-1基因(XM_015096929.1)采用Primer 5.0软件设计了3对引物(2对用于扩增TSP-1基因的CDS序列,1对为实时荧光定量引物)。以GAPDH基因作为内参基因(登录号:AF017079.1),序列见表1。所有引物自行设计后由上海生物技术服务有限公司合成。

表1 TSP-1基因的PCR扩增及实时荧光定量PCR引物
1.3 总RNA提取及cDNA合成
利用Trizol酚-氯仿法抽提绵羊各个组织和不同直径卵泡总RNA。2%凝胶电泳后于凝胶自动成像仪(Gene)中成像。利用核酸测定仪检测总RNA的纯度和浓度,-80 ℃保存备用。
以各个组织和不同直径卵泡RNA为模板,利用反转录试剂盒(北京全式金生物技术有限公司)进行cDNA合成。反应体系20 μL:5xTransScriptAll-in-One SuperMix for qPCR 4 μL,gDNA Remover 1 μL,总RNA 1 ng,加ddH2O至20 μL。
1.4 克隆测序
以绵羊第1条cDNA链为模板进行PCR扩增,体系为25 μL:cDNA 2 μL,2x Master SupermixTaq酶(北京全式金有限公司)12.5 μL,上下游引物各1 μL,ddH2O 8.5 μL。PCR反应条件:95 ℃ 5 min,95 ℃ 30 s,58 ℃ 45 s,72 ℃ 90 s,35个循环,72 ℃延伸10 min,10 ℃保存。PCR产物采用DNA柱式胶回收试剂盒(北京全式金)纯化后与pMD19-T载体连接。挑取单克隆菌落,接种于含AMP的0.5 mL LB培养基,37 ℃,200 r/min振荡3~4 h。根据菌液PCR结果,挑选阳性克隆送测序(上海生工)。
1.5 实时荧光定量PCR
以2 μL不同组织cDNA为模板,25 μL体系另外包括:Green qPCR SuperMix 12.5 μL,上下游引物各1 μL,RNase-free H2O 9 μL。PCR反应条件为:95 ℃预变性30 s;然后95 ℃ 5 s,引物特异Tm 15 min,55 ℃ 3 min,循环40次。熔解曲线分析:95 ℃ 1 min,55 ℃ 1 min,然后以0.5 ℃/10 s的速率从55 ℃缓慢递增到95 ℃。反应在Rochol LightCycler 480 II荧光定量PCR仪上进行,每次每一板上设置标准品(重复3次)和1个阴性对照。
1.6 统计分析
基因的mRNA表达定量采用相对Ct(ΔCt)法:目标基因Ct-GAPDHCt.ΔCt值在进行样品间比较(ΔΔCt):样品2ΔCt-样品1ΔCt。实时荧光定量PCR的最终结果计算公式为2-ΔΔCt。
1.7 系统进化树分析
根据克隆得到的TSP-1基因序列和从GenBank下载的基因序列核苷酸序列,使用Mega6.0中的邻接法(NJ)构建进化树。不同物种GenBank登录号见表2。
表2 不同物种GenBank登录号
1.8 生物信息学分析
利用DNAMAN软件将TSP-1的核苷酸序列翻译成氨基酸,通过DNAStar等生物信息学分析软件和在线分析软件预测蛋白的一级结构、理化性质、亲/疏水性和信号肽、二级结构等,预测所要使用的方法见表3。

表 3 蛋白质结构功能预测方法(软件或网址)
2 结 果
2.1 TSP-1基因PCR扩增

M:BM2000DNA Marker;1,2:片段1,2 PCR扩增结果;3:阴性对照M:BM2000DNA Marker;1,2:Results of 1,2 PCR amplification;3:Negative control图1 TSP-1基因PCR扩增产物Fig.1 PCR amplification product of TSP-1 gene
利用引物TSP-1-1和TSP-1-2,扩增阿勒泰羊组织cDNA中的TSP-1基因CDS区序列,琼脂糖凝胶电泳检测得到片段长度分别为1 714 bp和2 200 bp,条带单一,片段长度与预期大小相符(图1)。
2.2 TSP-1基因CDS区序列及蛋白功能位点分析
经测序和拼接后,得到3 519 bp的CDS区全长,共编码1 172个氨基酸(图2)。与GenBank上Texel羊序列(登录号:XM_015096929.1)相比,TSP-1的编码区序列在737 bp和2 113 bp处分别有一个C→T和A→G的突变,氨基酸分析显示均为无义突变。
2.3 蛋白结构与功能分析
利用在线软件分析,TSP-1蛋白分子式为C5482H8612N1712O1557S54,原子总量为17 541,分子量约为129.48 ku,带正电荷和负电荷的氨基酸残基数分别为184和119个,其理论等电点pI为4.72;经计算TSP-1蛋白不稳定系数为41.24(>40),脂肪指数为58.87,最大疏水性位于第9位氨基酸(Score:2.433),最大亲水性位于744位氨基酸(Score:2.878);整体来看亲水性区域大于疏水性区域,总平均亲水性为-0.713(<0)(图3);信号肽分析结果显示TSP-1蛋白原裂解位点(C值)在和联合裂解位点(Y值)在氨基酸19位评分最高(0.572和0.707),信号肽存在于氨基酸的1~18位(图4);跨膜区分析TSP-1蛋白不存在跨膜螺旋结构;二级结构分析TSP-1蛋白含13个α螺旋(alpha helix),42个β折叠延伸链(extended strand),103个转角(turn)和86个无规则卷曲(random coil)(图5)。

图2 绵羊TSP-1基因的核苷酸序列及翻译的氨基酸序列Fig.2 Nucleotide sequence and translated amino acid sequence of TSP-1 gene in sheep
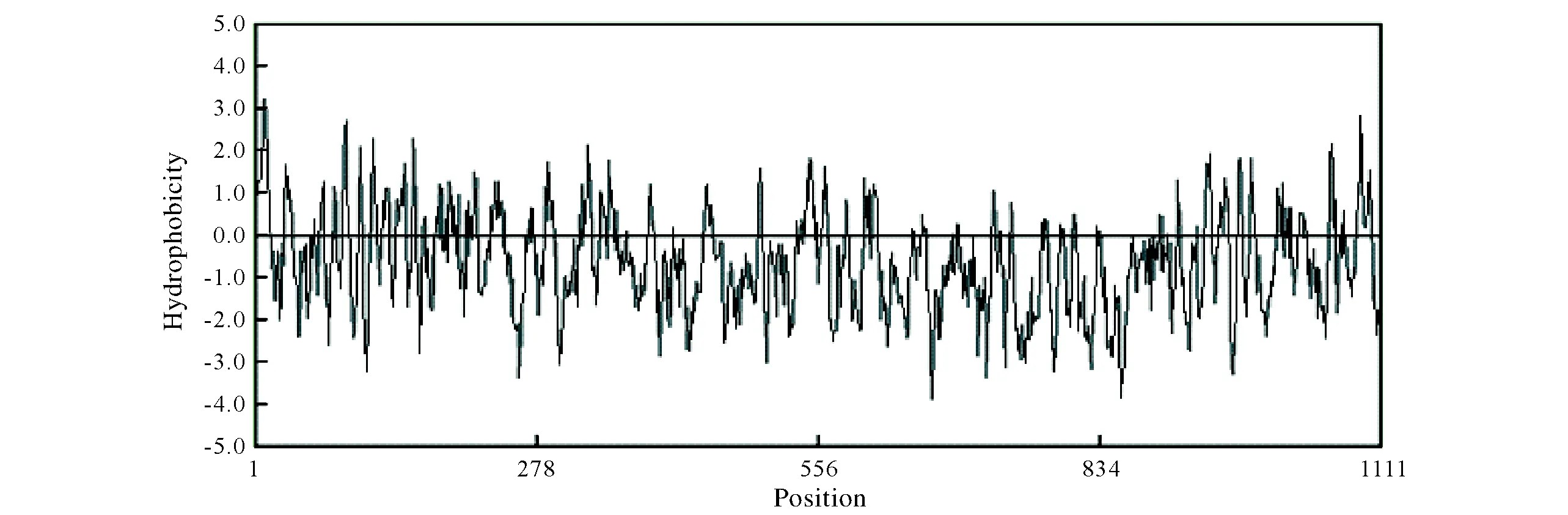
图3 绵羊TSP-1蛋白的亲/疏水性分析Fig.3 Hydrophilic/hydrophobic analysis of TSP-1protein in sheep

图4 绵羊TSP-1蛋白信号肽分析Fig.4 Signal peptide analysis of TSP-1 protein in sheep

图5 绵羊TSP-1蛋白二级结构分析Fig.5 The secondary structure analysis of TSP-1 protein in sheep
利用在线软件分析TSP-1蛋白的功能位点发现,可能存在6个N-糖基化位点,其中位于249,361,1 053位氨基酸的位点潜在值大于0.5(0.672 8、0.706 3和0.558 8);该蛋白还存在44个潜在的磷酸化位点,包括25个Ser,10个Thr和9个Tyr(图 6)。

图6 TSP-1蛋白存在的N-糖基化和磷酸化位点Fig.6 N-glycosylation and phosphorylation sites in TSP-1 protein
利用NCBI的CDD数据库分析TSP-1蛋白的功能结构域,结果发现TSP-1蛋白与TSP-3蛋白含有2个长重复区、3个短重复区、6个C型Ga离子结合位点和一个N型Ga离子结合位点(图7)。

图7 TSP-1蛋白的功能结构域Fig.7 Functional domain of TSP-1 protein
2.4 系统进化树分析
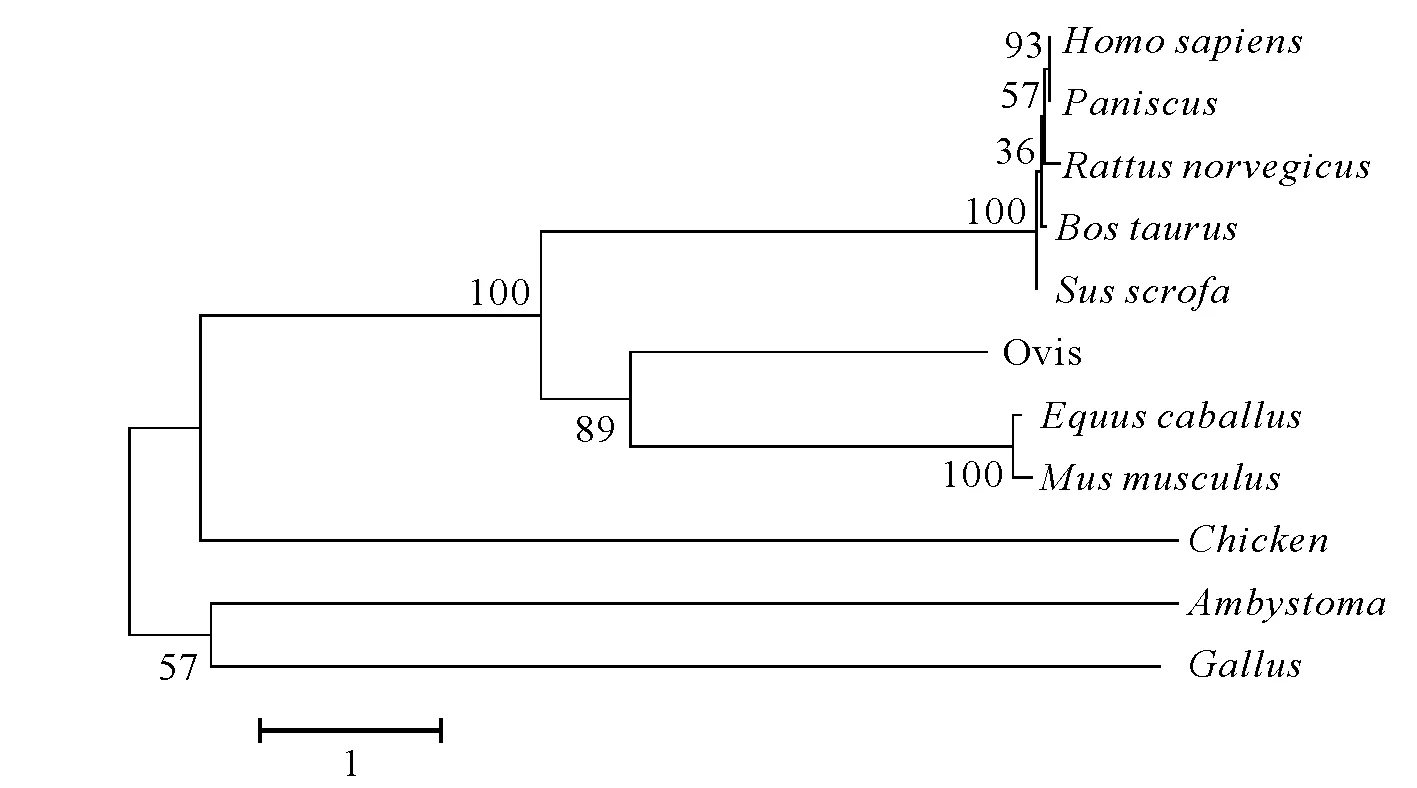
图8 NJ法构建系统进化树Fig.8 Phylogenetic tree constructed by NJ method
利用 Mega 6.0软件构建物种间分子系统进化树,其中人与黑猩猩聚为一类,野马和小鼠聚为一类,家鸡与其他物种的遗传距离较远,绵羊与牛,野猪的遗传距离较近(图8)。
2.5 TSP-1基因在绵羊7个组织中的表达谱检测
通过实时荧光定量PCR检测了TSP-1基因在5头阿勒泰羊心脏、肝脏、脾脏、肺脏、肾脏、肌肉、子宫中表达变化。结果发现TSP-1基因在这7个组织中都有表达,其中在肝脏、肺脏和肾脏中高表达,在脾脏和子宫中中等表达,在心脏和肌肉中低表达。其中肝脏和肺中表达量与心脏相比差异极显著(P<0.01),肾脏与心脏表达量相比差异显著(P<0.05)(图9)。

1:心脏;2:肌肉;3:卵巢;4:脾脏;5:肾脏;6:肝脏;7:肺脏 1:Heart;2:Muscle;3:Uterus;4:Spleen;5:Kidncy;6:Liver;7:Lung图9 TSP-1基因在绵羊组织中表达情况Fig.9 The tissues expression profile of TSP-1 gene in sheep

图10 TSP-1基因在绵羊不同生长期卵泡中表达情况Fig.10 Different growth stages expression of TSP-1 gene in sheep
2.6 TSP-1基因在绵羊不同生长时期卵泡中表达情况
通过实时荧光定量PCR检测了TSP-1基因在不同生长时期卵泡中表达变化。结果显示,随着卵泡直径的增大,TSP-1基因的表达也逐渐升高。其中,大、小卵泡表达量差异显著(P<0.05)(图10)。
3 讨 论
卵母细胞的成熟离不开卵泡液和颗粒细胞,卵泡液是前者发育成熟的重要场所,而颗粒细胞分泌的蛋白和激素则调节卵母细胞的发育[12]。研究表明,TSP-1在多种动物卵巢组织中表达且对卵泡发育有一定作用,如小鼠TSP-1基因的敲除,可导致卵巢卵泡发育数量显著增高,而排卵数则显著受到抑制。James等[13]认为TSP-1在卵巢上直接抑制了VEGF的表达从而调控血管的发生与卵泡的发育。TSP-1在大鼠窦状卵泡早期和黄体期的颗粒细胞中均有表达,但对FSH不敏感。同时TSP-1可促进大鼠体外培养的颗粒细胞凋亡,但不依赖于血管发生的信号通路[14-15]。与大鼠颗粒细胞对FSH敏感性不同的是,FSH的刺激牛颗粒细胞可诱导TSP-1的表达[16]。作为最早发现的血管生成抑制因子[17],近年来TSP-1在肿瘤中的表达与预后关系研究中研究较多,已经明确的是TSP-1的生物学功能受多种因子的调控,如:生长因子、细胞因子、癌基因等[18-20]。通过超排后转录组数据分析比较推测,TSP-1基因可能在绵羊卵泡发育中具有调控作用。
本研究通过两次PCR扩增获得TSP-1基因CDS区序列。与NCBI上的预测序列对比发现两个突变位点,翻译成氨基酸比对发现均为无义突变。系统进化树分析表明绵羊与牛,野猪的遗传距离较近。将克隆到的核苷酸序列及翻译成的氨基酸进行生物信息学分析发现,TSP-1蛋白整体带正电荷,结构不稳定,整体来看亲水性区域大于疏水性区域。对其跨膜结构和信号肽进行分析后发现,TSP-1蛋白不存在跨膜结构,在氨基酸的1~18位有一个信号肽。若蛋白质序列含有跨膜区表明其可能是以膜受体的形式发挥作用,也可能是定位于膜上的锚定蛋白或离子通道蛋白,信号肽则是引导新合成的蛋白质向分 泌通路转移的短肽链。故本研究的结果表明,TSP-1蛋白能与其他的配体相互作用进而发挥其生物学作用。糖基化和磷酸化都是生物体内蛋白质翻译后重要的修饰方式,通过在线软件分析后发现,TSP-1蛋白可能存在6个N-糖基化和50个潜在O-糖基化位点,以及44个潜在的磷酸化位点。结果表明TSP-1蛋白在翻译后中有丰富的修饰。同时分析发现TSP-1蛋白与TSP-3蛋白含有2个长重复区、3个短重复区、6个C型Ga离子结合位点和一个N型Ga离子结合位点。
研究表明,TSP-1在小鼠,大鼠,牛等动物的各个组织中均有表达。但在绵羊各个组织中的表达和分布报道较少[21]。本试验研究表明TSP-1基因在心脏、肝脏、脾脏、肺脏、肾脏、肌肉、子宫这7个组织中都有表达,其中在肝脏、肺脏和肾脏中高表达,在脾脏和子宫中中等表达,在心脏和肌肉中低表达。随着卵泡直径的增大,TSP-1基因的表达也逐渐升高。这在一定程度上反映了TSP-1基因可能在绵羊卵泡发育中具有重要作用。
4 结 论
本研究利用PCR扩增和克隆测序获得了TSP-1基因CDS全长为3 519 bp,共编码1 172个氨基酸。TSP-1蛋白为脂溶性亲水蛋白,结构不稳定,没有跨膜螺旋结构,在氨基酸1~18位存在1个信号肽,存在6个N-糖基化和44个潜在的磷酸化位点,包括25个Ser,10个Thr和9个Tyr。系统进化树分析显示,绵羊与牛的亲缘关系较近,与人、小鼠和鸡等亲缘关系较远。检测不同组织和不同直径卵泡中TSP-1基因发现:TSP-1基因在这7个组织中都有表达。同时随着卵泡直径的增大,TSP-1基因的表达也逐渐升高。本研究初步探讨了TSP-1基因的结构和功能,但该基因在卵泡发育过程中的作用和机制需进一步研究。
[1] Scaramuzzi R J,Baird D T,Campbell B K,et al.Regulation of folliculogenesis and the determination of ovulation rate in ruminants[J].Reprod Fertil Dev,2011,23(3):444-467.
[2] Wu Y S,Lin J P,Li X L,et al.Transcriptome profile of one-month-old lambs’ granulosa cells after superstimulation[J].Asian-Australas J Anim Sci,2016,30(1):20-33.
[3] Michael J,Mark W H,John G C,et al.Purification of normal cellular prion protein from human platelets and the formation of a high molecular weight prion protein complex following platelet activation[J].Biochemical and Biophysical Research Communications,2005,335(1):48-56.
[4] Paul B.Thrombospondins function as regulators of angiogenesis[J].J Cell Commun Signal,2009,3(3/4):189-200.
[5] Yao M,Roberts D D,Isenberg J S.Thrombospondin-1 inhibition of vascular smooth muscle cell responses occurs via modulation of both cAMP and cGMP[J].Pharmacol Res,2011,63(1):13-22.
[6] Roberts D D.Regulation of tumor growth and metastasis by thrombospondin-1[J].Feseb Journal Official Publication of the Federation of American Societies for Experimental Biology,1996,10:1183-1191.
[7] Grimbert P,Bouguermouh S,Baba N,et al.Thrombospondin/CD47 interaction:a pathway to generate regulatory T cells from human CD4+ CD25-T cells in response to inflammation[J].J Immunol,2006,177(6):3534-3541.
[8] Isenberg J S,Frazier W,Robert D D.Thrombospondin-1:a physiological regulator of nitricoxide signaling[J].Cell Mol Life Sci,2008,65(5):728-742.
[9] Lawer J.The functions of thrombospondin-1 and-2[J].Curr Opin Cell Biol,2000,12(5):634-640.
[10] Foula S,Stuart B,Hooper,et al.Thrombospondin-1 expression and localization in the developing ovine lung[J].J Physiol,2007,10:625-635.
[11] Svetlana F and Rina M.Thrombospondin-1 affects bovine luteal function via transforming growth factor-beta1-dependent and independent actions[J].Biology of Reproduction,2015,94(1):1-9.
[12] 吴阳升,林嘉鹏,汪立芹,等.绵羊小卵泡与中卵泡转录组差异特征分析[J].江苏农业学报,2016,32(4):832-842.
Wu Y S,Lin J P,Wang L Q,et al.Transcriptome analysis of small follicles and medium follicles in sheep[J].Jiangsu Journal of Agricultural,2016,32(4):832-842.
[13] James G,Jack L,Roger M,et al.Thrombospondin-1 inhibits vegf levels in the ovary directly bybinding and internalization via the low density lipoproteinreceptor-related protein-1(LRP-1)[J].J Cell Physiol,2007,210(3):807-818.
[14] Greenway J,Henkin J,Lawler J,et al.ABT-510 induces tumor cell apoptosis and inhibits ovarian tumor growth in an orthotopic,syngeneic model of epithelial ovarian cancer[J].Mol Cancer Ther,2009,8(1):64-74.
[15] Mcgry A J,Gingerich T,Peteik J,et al.Rapid insulin-like growth factor-1-induced changes in granulosa cell thrombospondin-1 expression in vitro[J].J Reprod Dev,2011,57(1):76-83.
[16] Craig J M,Orisaka H,Wang S,et al.Gonadotropin and intra-ovarian signals regulating follicle development and atresia:the elicate balance between life and death[J].Front Biosci,2007,12(12):3628-3639.
[17] Ruel-A-Arispe M L,Luque A,Lee N.Thrombospondin modules and angiogenesis[J].Int J Biochem Cell Biol,2004,36(6):1070-1078.
[18] Pal S K,Nguyen C T,Morita K I,et al.THBS1 is induced by TGFB1 in the cancer stroma and promotes invasion of oral squamous cell carcinoma[J].J Oral Pathol Med.2016,45(10):730-739.
[19] Torres A,Gubbiotti M A,Iozzo R V.Decorin-inducible Peg3 evokes beclin 1-mediated autophagy and thrombospondin 1-mediated angiostasis[J].Journal of Biological Chemistry,2017,292:5055-5069.
[20] Pellerin S,Croizet K,Rabilloud R,et al.Regulation of the three-dimensional organization of thyroid epithelial cells into follicle structures by the matricellular protein,thrombospondin-1[J].Endocrinology,1999,140(3):1094-103.
[21] Solo F,Hooper S B,Wallace W J.Thrombospondin-1 expression and localization in thedeveloping ovine lung[J].Journal of Physiology,2007,584(2):625.

