肉牛源毛孢子菌Trichosporon loubieri的分离鉴定与药敏试验
钟 锐,姜尧章,马晓平,*,左之才,黄小丽,邓俊良,沈留红,余树民
(1.四川农业大学 动物医学院,四川 成都611130; 2.四川农业大学 动物科技学院,四川 成都 611130)
毛孢子菌(Trichosporonspp.)可引起人和动物毛孢子菌病。该菌属于半知菌门、芽生菌纲、隐球酵母目、隐球酵母科的酵母样真菌[1]。毛孢子菌引起浅表感染称为白毛结节,为白色、棕黑色或绿色颗粒状纺锤状小结节,包围毛干并呈不规则分布,多见于男青年,特别是生殖器周围。也可引起侵袭性感染,主要包含真菌血症、单个器官感染和播散性毛孢子菌病。播散性毛孢子菌病是一种致死性的机会性感染,常发生于免疫低下的病人,尤其是因患有血液病或化疗而出现中性粒细胞减少的患者[2]。在恶性血液病患者中,毛孢子菌属已成为除念珠菌属外致人类播散性感染第二位的酵母菌[3]。
毛孢子菌的生态适应性较广,既可见于环境中、腐败物中、寄生于水和植物中,也可分离于人体的特定部位(消化道、呼吸道、泌尿道和皮肤)。1992年,Gueho等人将毛孢子菌分为19个种,至少6个种对人类有致病意义,分别为阿萨希毛孢子菌(Trichosporonasahii)、粘质毛孢子菌(Trichosporonmucoides)、星形毛孢子菌(Trichosporonasteroids)、皮瘤毛孢子菌(Trichosporoninkin)、皮肤毛孢子菌(Trichosporoncutaneum)及卵形毛孢子菌(Trichosporonovoides),其中T.asahii最为常见。近年出现了少见毛孢子菌引发的感染,如Trichosporondermatis和T.loubieri[4]。这些致病毛孢子菌不仅可导致浅部感染,更重要的是可导致免疫低下或免疫功能抑制患者的深部感染[2],主要表现为真菌血症及皮肤、脏器的播散性感染[2]。有报道称毛孢子菌也会引起哺乳动物白毛结节病[5],还可以引起猫的系统性感染[6]。本试验从自然发病肉牛体表分离到了一株真菌,对其进行形态学与分子生物学相结合的鉴定,发现其为T.loubieri,并对该菌进行了小鼠致病性和药敏试验。
1 材料与方法
1.1 病料
患皮肤病肉牛(自然发病)的皮屑和被毛采集自四川某地肉牛养殖场。
1.2 主要试剂和仪器
放线菌酮购自Amresco公司。氯霉素购自北京索莱宝科技有限公司。酵母基因组DNA提取试剂盒(离心柱型)等其他分子生物学试剂均购自成都擎科梓熙生物技术有限公司。GreenView(EB最新替代品)购自成都博瑞克生物技术有限公司。内转录间隔区(internal transcribed spacer, ITS)通用引物和IGS区通用引物由成都擎科梓熙生物技术有限公司合成。伏立康唑、氟康唑、克霉唑等药敏纸片由丹麦Rosco公司提供。
含放线菌酮和氯霉素的沙氏葡萄糖蛋白胨培养基、沙氏葡萄糖蛋白胨培养基(SDA)、尿素琼脂培养基均按文献报道的方法配制[7]。
试验用主要仪器包括上海琅玕RQX-300B智能型人工气候箱、日本尼康NIKON ECLIPSE CI正置光学显微镜和Nikon DS-U3成像系统、德国Thermo Fisher离心机、美国BIO-RAD公司PCR扩增仪PTC200 NDA Engine Cycler、德国莱卡RM2016切片机。
1.3 病牛皮肤真菌病的诊断
1.3.1 病牛皮肤真菌病的诊断
用无菌手术刀片取患处病健结合部皮屑,毛发数根,置于载玻片上,滴加100 g·L-1KOH溶液2滴,盖上盖玻片,静置10 min后,镜检观察是否存在菌丝、孢子,及其形态、排列等,可做出初步诊断[8]。
1.4 真菌的分离纯化
1.4.1 病料的采集
在确诊为皮肤真菌病的患部用75%乙醇消毒,再用灭菌镊子在病健结合部取毛15~20根;然后用灭菌刀片刮取皮屑至微微出血,将样本装入灭菌试管内,20 g·L-1碘酊对取样处消毒[9]。将采集的样本放入4 ℃的保温箱,送实验室分离培养。
1.4.2 分离培养与纯化
将样品接种到加有放线菌酮和氯霉素的SDA中。25 ℃恒温培养,每2 d观察1次。1周后,将单菌落接种到SDA培养基纯化,25 ℃培养,用以进行形态学和分子生物学鉴定、致病性试验以及药敏生化试验。
1.4.3 形态学鉴定
取单菌落接种于新的SDA培养基中观察菌落特征。用铜圈法[10]制作菌株小培养以观察菌丝和孢子形态。待接种的菌株产孢子后,轻轻取下盖玻片并置于载玻片上,棉兰染色镜检、拍照。
1.5 分子生物学鉴定
1.5.1 引物
ITS区通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)[11],由成都擎科梓熙生物技术有限公司合成。
IGS1区特异性引物26SF(5′-ATCCTTTGCAGACGACTTGA-3′)和5SR(5′-AGCTTGACTTCGCAGATCGG-3′)[12],由成都擎科梓熙生物技术有限公司合成。
1.5.2 真菌DNA的提取
按照天根生化科技有限公司试剂盒说明书提取纯化菌落的DNA。
1.5.3 ITS区的PCR扩增
采用50 μL反应体系:2×T5 Super PCR Mix 25 μL,上、下游引物(10 μmol·L-1)各2 μL。DNA模板2 μL,Deionized water补足至50 μL;扩增反应条件:95 ℃ 3 min,95 ℃ 30 s,55 ℃ 3 s,72 ℃ 1 min,35个循环;72 ℃ 10 min结束反应,16 ℃保存。
1.5.4 IGS区的PCR扩增
采用50 μL反应体系:2×T5 Super PCR Mix 25 μL,上、下游引物(10 μmol·L-1)各2 μL。DNA模板2 μL,Deionized Water补足至50 μL;扩增反应条件:98 ℃ 3 min,95 ℃ 30 s,57 ℃ 3 s,72 ℃ 1 min,35个循环;72 ℃ 10 min;结束反应,4 ℃保存。
1.5.5 PCR产物的电泳鉴定
取8 μL扩增产物和10 μL 12 000 bp DNA Ladder Marker,在含EB的10 g·L-1琼脂糖凝胶的点样孔中点样,电压120 V,电流80 mA,电泳60 min,以凝胶成像系统分析扩增结果。
1.5.6 序列分析
由成都擎科梓熙生物技术有限公司进行测序。把已测定序列提交GenBank,获得序列号。在NCBI中用BLAST程序与GenBank数据库中的序列进行相似性比较,用MEGA 7.0软件进行多重序列比较,并用最大简约法(maximum parsimony)构建种系发生树,并通过1 000次自展分析(bootstrap)对树进行置信度检测。
1.6 动物致病性试验
刮取SDA培养基上25 ℃培养5 d的分离株菌落,并用灭菌生理盐水混匀制成菌悬液备用,菌悬液浓度为1×107cfu·mL-1。将27只体况相近的6~8周龄健康小鼠(雌雄不限)随机分为A、B、C三组,每组9只。A组为免疫抑制组,B组为非免疫抑制组,C组为空白对照组。饲养1周消除应激反应后,A组用环磷酰胺和青霉素钠进行免疫抑制,腹腔注射环磷酰胺50 mg·kg-1和青霉素钠15 mg·只-1,隔天注射一次,连续3次。A、B、C三组再分别分为皮肤涂擦组A1、B1、C1,皮下注射组A2、B2、C2和腹腔注射组A3、B3、C3,每小组3只。A1、B1组小鼠试验前剪除背部毛发,约3 cm×2 cm。接种时消毒后,用无菌粗砂纸轻轻磨破小鼠背部皮肤至点状渗血为宜,涂布菌悬液,A2、B2组小鼠皮下注射菌悬液0.1 mL,A3、B3组小鼠腹腔注射0.1 mL菌悬液。C1组小鼠皮肤涂擦生理盐水,C2组小鼠皮下注射0.1 mL生理盐水,C3组小鼠腹腔注射0.1 mL生理盐水。观察接种处皮肤红斑、脱屑、结痂和毛发生长变化。若小鼠出现严重症状提前导致死亡,则将该小鼠解剖并取小鼠患部被侵害组织进行逆培养,并取真菌菌体提取DNA进行分子生物学鉴定。感染后第7天,处死并解剖小鼠,肉眼观察主要器官的病变,并取接种处皮肤,用100 mL·L-1福尔马林固定,制作切片,进行HE染色,PAS染色[13]并在光学显微镜下进行病理组织学观察及拍照。
1.7 药敏试验
1.7.1 培养基的制备
按照标准对试验菌株纯度检测用沙氏葡萄糖蛋白胨培养基(SDA)进行配制[7]。
1.7.2 接种菌液的配置
将待测菌株接种于SDA培养基,挑取菌株用无菌水配制成菌悬液,在530 nm波长,用分光光度计调整浓度为0.5麦氏比浊管透光度,约为5×105cfu·mL-1,再用生理盐水1∶1稀释[14]。
表1小鼠致病性试验的分组
Table1The grouping in pathogenicity test of mice
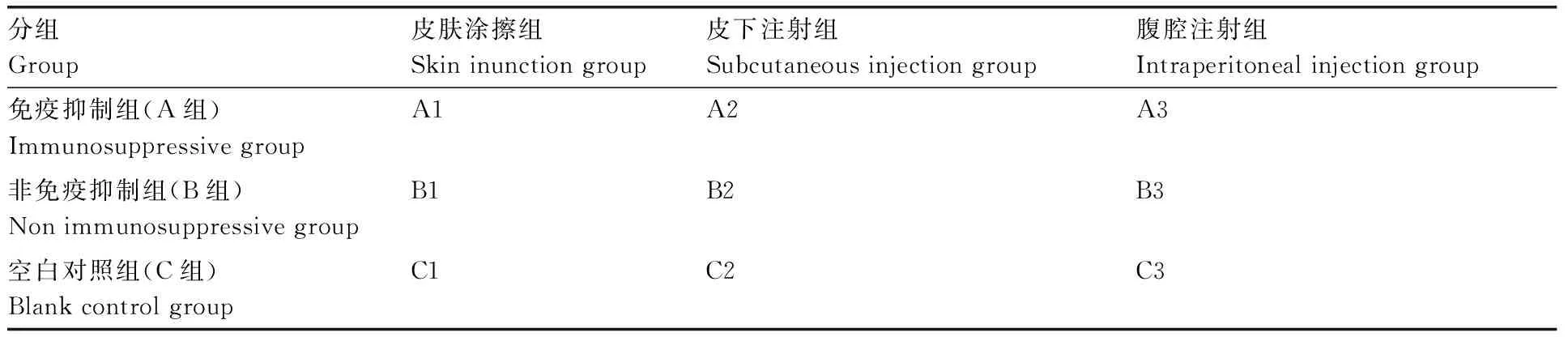
分组Group皮肤涂擦组Skininunctiongroup皮下注射组Subcutaneousinjectiongroup腹腔注射组Intraperitonealinjectiongroup免疫抑制组(A组)ImmunosuppressivegroupA1A2A3非免疫抑制组(B组)NonimmunosuppressivegroupB1B2B3空白对照组(C组)BlankcontrolgroupC1C2C3
按丹麦Rosco真菌药敏纸片扩散法标准,取0.5 mL接种液倾注于9 cm平皿表面,将菌悬液涂布均匀,吸去多余的液体,25 ℃干燥10 min,贴药片。在25 ℃中培养18~24 h后立即测量[15]。3人共3次分别测量抑菌圈直径。将9次测量结果取平均值即为最终抑菌圈直径大小。抑菌圈直径≥20 mm的记为敏感;抑菌圈直径在11~20 mm范围内的记为中介;抑菌圈直径≤11 mm的记为耐药。
2 结果与分析
2.1 实验室诊断
在显微镜下观察到菌丝和孢子,结合病牛患部被毛大面积脱落,皮肤角质层增厚有大量鳞屑的临床表现(图1-A-B),初步诊断该肉牛患真菌性皮肤病。
2.2 分离培养
从皮屑和毛发样本中分离到3株真菌,经形态学观察,菌落形态和菌丝、孢子形态一致,均为图2中菌落(图2-A)和显微特征(图2-B-C),故将各个分离株合并为一个菌株,将其编号为zrfg01。
2.3 形态学特征
菌落特征:25 ℃ SDA培养基上生长良好,菌落早期较湿润,后渐干燥,菌落呈乳白色,类酵母型菌落,边缘不整齐,可见伸入培养基的假菌丝(图2-A)。
显微特征:关节孢子呈柱状至椭圆形,可见大量呈藕节状的假菌丝和呈竹节状的菌丝(图2-B,C)。
2.4 分子生物学鉴定
经PCR方法扩增菌株zrfg01的ITS区,成功获得目的基因片段514 bp。序列提交GenBank,获得序列号MF401392.1。用BLAST程序与GenBank数据库中收录的序列比对,获得菌株ITS区序列与序列号为KC254110.1的T.loubieri相似性达99%。选择同属多个菌株做种间发生树,发现各种间分枝混乱,多数种支持率不高,ITS区不适合于Trichosporon属内的种间鉴定(图3)。

图1 肉牛体表病变Fig.1 Pathological changes of beef cattle

A, 在SDA培养基上的菌落特征;B, 显微镜下孢子和菌丝的形态(200 ×); C, 显微镜下孢子和菌丝的形态(400×)。A, Colony characteristics of SDA medium; B, Morphology of spores and hyphae under microscope (200 ×); C, Morphology of spores and mycelium under microscope (400×).图2 Trichosporon. loubieri的形态特征Fig.2 Morphological characteristics of Trichosporon. loubieri
经PCR方法扩增菌株zrfg01的IGS区,成功获得目的基因片段542 bp。序列提交GenBank,获得序列号MF401393.1。用BLAST程序与GenBank数据库中收录的序列比对,获得菌株IGS区序列与序列号为KT936593.1的T.loubieri相似性达100%,构建种系发生树显示两者以100%支持率聚在同一分支。故将zrfg01菌株鉴定为T.loubieri(图4)。
2.5 致病性试验
2.5.1 临床症状
涂擦菌悬液1周后,实验组精神食欲较差,被毛杂乱无光。对照组精神食欲没有明显变化。免疫抑制皮下注射组A2注射处形成肉芽组织,中央凹陷,出现溃烂结痂(图5-B)。健康皮下注射组B2有一小鼠出现小脓肿(图5-D),其余没有明显变化。涂擦组A1、B1涂擦部位没有明显变化,外伤基本痊愈,毛发开始生长。
2.5.2 剖检变化
A1组有一只小鼠患部出现脓汁(图5-A),其余无明显变化。A2组皮下注射部形成肉芽肿,肉芽肿内包裹着黏稠的脓汁(图5-B-C)。A3组小鼠皮肤表面无明显变化,腹腔中肝、肠、胃出现黏连,肝脏上出现脓肿坏死灶(图5-D-E)。B3组无明显变化。
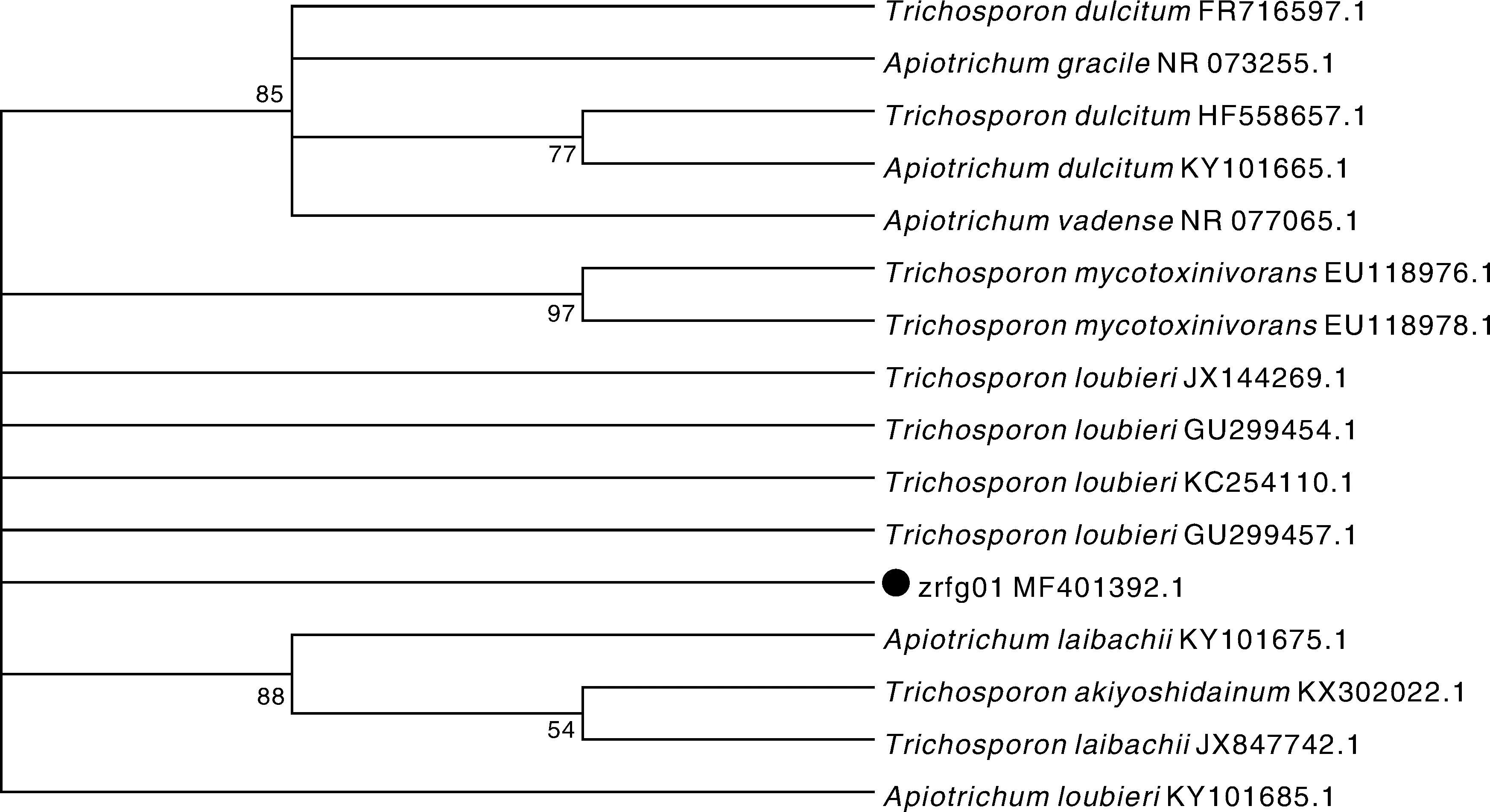
图3 ITS区种系发生树Fig.3 Phylogenetic tree on ITS sequence of Trichosporon. loubieri

图4 IGS区种系发生树Fig.4 Phylogenetic tree on IGS sequence of Trichosporon. loubieri

A, 脓汁;B, 肉芽肿外部症状;C, 肉芽肿内脓汁;D, 肝脏和肠道粘连;E, 肝脏上的脓肿坏死灶。A, Pus;B, External symptoms of granuloma;C, Pus in the granuloma;D, Liver adhesion with intestinal tract;E, An abscess necrotic foci on the liver.图5 小鼠剖解病变Fig.5 Pathological changes of mice
2.5.3 病理组织学变化
皮肤及脏器组织病理变化主要为感染性肉芽肿,HE染色的病理切片可见肝脏轻度小血管扩张、病灶呈现中性粒细胞为主的炎性细胞浸润,肝细胞增生、变形不明显(图6-A)。肌肉坏死(图6-B)。皮肤病变处细胞坏死,有成纤维细胞和大量炎性细胞浸润(图6-C)。PAS染色在感染组织中可见形态各异的菌丝及圆形或卵圆形真菌孢子堆积(图6-D)。


A, 肝脏血管周围以中性粒细胞为主的炎性浸润(400×);B, 肌肉坏死(200×);C, 真皮层坏死处炎性细胞浸润(200×);D, 病灶处PAS染色的孢子和菌丝(400×)。A, Liver vessels are surrounded by inflammatory infiltration neutrophils(400×);B, Musclenecrosis(200×);C, Inflammatory cell infiltration in the demis necrosis (200×);D, Spore and hypha of PAS staining in lesion(400×).图6 组织病理变化Fig.6 Histopathological change
2.5.4 逆培养结果
逆培养3 d后菌落形态为乳白色,黏稠,中等大小,边缘可见伸入培养基的假菌丝。镜检可见大量关节孢子和真假菌丝,与分离株zrfg01的相关特征相符。经测序,与分离株zrfg01为同一菌株。
2.6 药敏试验
试验结果表明分离株T.loubieri对特比萘芬和氟胞嘧啶表现为耐药,对伊曲康唑和酮康唑表现为中度敏感,对克霉唑、咪康唑、两性霉素B、氟康唑和伏立康唑均表现为敏感。药敏试验结果归纳于表1。
表1T.loubieri对九种抗真菌药物敏感性
Table1Susceptibility ofT.loubierito nine antifungal drugs

药物名称Drug抑菌圈直径平均值Averagediametersofinhibitionzone/mm结果Results克霉唑CTRIM24.0S咪康唑MICOZ19.3S伊曲康唑ITRAC16.8I特比萘芬TERBI10.0R两性霉素BAMPHO22.0S酮康唑KETOC18.3I氟胞嘧啶FLU-110.0R氟康唑FLUCZ22.7S伏立康唑VOR-122.7S
S为敏感(≥20 mm);I为中度敏感(11~20 mm);R为耐药(≤11 mm)。
S, Sensitivity;I, Intermediate sensitivity;R, Resistance.
3 讨论
随着烈性传染病被控制,一些少发病逐渐显现出来。目前对阿萨希毛孢子菌病研究较多,对T.loubieri、T.dermatis等研究较少,但也有报道称某些动物对这些少见的毛孢子菌易感。T.montevideense造成狗的肉芽肿性脑膜炎[16]。T.beigelii导致奶牛乳腺炎[17]。本试验首次发现T.loubieri导致肉牛身体皮肤癣菌病。目前国内对于T.loubieri研究很少,国外有报道称该菌感染猫,引起全身多处溃疡,剖解可见胸腔淋巴结,肺、胸膜上有多处白色结节病灶区[6]。多囊肾病患者在肾切除术后被该菌感染[18]。之后陆续有报道T.loubieri引起人的肺炎[19]、真菌血症、肝脏损伤[20]等。
真菌核糖体RNA(rRNA)基因是串联重复排列的结构,每个重复结构编码18S、5.8S和26S基因,在两个不同的区域间存在内部转录间隔区(ITS)和基因间隔区(IGS)[21]。ITS具有准确、快速、引物通用性强、便于高通量测序与分析等优点,因此被广泛应用于真菌系统发育、种间和种内遗传多样性研究[22]。近年,真菌rDNA ITS区测序后BLAST分析用于菌种的分子鉴定已广泛应用,相似性超过98%的菌株可认定为同一菌种[22],但根据本试验ITS区构建的系统发生树的结果不能确定该毛孢子菌的种,与夏志宽等[21]的报道一致。
IGS(intergenic spacer)是rDNA中变异最快的区域,且各重复单位间具有同步进化的特点,因此被广泛用于同属真菌不同种间、种内不同群体间、近缘类群、杂交类群等关系的比较研究[23]。毛孢子菌属各菌种间形态、生理、生化特点均较接近,单靠表型特征不易区别。根据本试验研究结果,发现ITS区不能有效进行毛孢子菌的种间鉴定,而IGS区能清晰鉴定毛孢子菌分离株。
近年来,随着免疫低下宿主的增多,临床上真菌感染的发生越来越普遍。除念珠菌外,毛孢子菌、镰刀菌、接合菌等引发的感染呈日渐增多趋势[24]。早有报道阿萨希毛孢子菌、头状地霉菌、皮毛孢子菌以及皮瘤毛孢子标准株对于伊曲康唑、特比萘芬及两性霉素B均不敏感[25]。也有报道称毛孢子菌引起的感染对于临床常见抗真菌药物的反应均不是很好,应用两性霉素B以及氟康唑治疗失败的事件时有报道[26]。而本试验结果表明T.loubieri对两性霉素B和氟康唑敏感,对伊曲康唑中度敏感。临床上对毛孢子菌抗真菌药物敏感性研究十分有限,不同种的毛孢子菌对抗真菌药物的敏感性有一定的差异,如阿萨希毛孢子菌对两性霉素B敏感,而皮肤毛孢子菌对其耐药[27-28]。由于耐药性的产生,大多数毛孢子菌感染人类和其他动物在临床上的治疗效果甚微。因此将毛孢子菌鉴定到种,对不同种的菌株进行体外药敏试验,对于临床上选择敏感药物治疗毛孢子菌感染具有重要的意义。
[1] 夏志宽,杨蓉娅. 毛孢子菌病[J]. 实用皮肤病学杂志,2010,3(4):215-217, 220.
XIA Z K, YANG R Y. Trichosprosis[J].PracticalJournalofDermatology, 2010, 3(4):215-217, 220. (in Chinese with English abstract)
[2] 郝震锋, 敖俊红. 毛孢子菌病治疗研究进展[J]. 中国医师杂志,2004,6(1):141-142.
HAO Z F, AO J H. Research progress in the treatment of Trichosprosis[J].JournalofChinesePhysician, 2004, 6(1):141-142. (in Chinese)
[3] 聂建巍. γ-干扰素增强RAW264.7巨噬细胞吞噬、杀伤阿萨希毛孢子菌的实验研究[D].合肥:安徽医科大学,2012.
NIE J W. Enhancement effect of IFN-γ on the phagocytosis, killing activity of RAW264.7 macrophages againstTrichosporonasahii[D]. Hefei: Anhui Medical University, 2012. (in Chinese with English abstract)
[4] 郭莉娜,徐英春,窦红涛,等. 临床相关毛孢子菌感染的研究现状[J]. 中国真菌学杂志,2010,5(1):53-56.
GUO L N, XU Y C, DOU H T, et al. Research status in clinical infection caused by Trichosporon[J].ChineseJournalofMycology, 2010, 5(1):53-56. (in Chinese)
[5] WALSH T J, MELCHER G P, LEE J W, et al. Infections due to Trichosporon species: new concepts in mycology, pathogenesis, diagnosis and treatment[J].CurrentTopicsinMedicalMycology, 1993, 5:79-113.
[6] RISSI D R, KIRBY K D, SANCHEZ S. Systemic Trichosporon loubieri infection in a cat[J].JournalofVeterinaryDiagnosticInvestigation, 2016, 28(3):350-353.
[7] 王端礼. 医学真菌学实验室检验指南[M]. 北京:人民卫生出版社,2005.
[8] 张悦天,马晓平,古玉,等. 大熊猫源石膏样小孢子菌的分离鉴定与致病性研究[J]. 中国兽医科学,2015(6):551-559.
ZHANG Y T,MA X P,GU Y,et al.Identification and pathogenicity ofMicrosporumgypseumisolated fromAiluropodamelanoleuca[J].VeterinaryScienceinChina, 2015(6):551-559. (in Chinese with English abstract)
[9] 秦曼,向奇,马晓平,等. 四川家兔源万博节皮菌的分离鉴定及其致病性研究[J]. 中国兽医科学,2016(9):1079-1086.
QIN M, XIANG Q, MA X P, et al. Identification and pathogenicity ofArthrodermavanbreuseghemiiisolated from rabbit in Sichuan[J].VeterinaryScienceinChina, 2016(9):1079-1086. (in Chinese with English abstract)
[10] 宋秋荷,周会祥,赖雪花. 铜圈小培养鉴定真菌菌种的临床应用[J]. 九江学院学报(自然科学版),2013,28(1):76-77.
SONG Q H, ZHOU H X, LAI X H. The clinical application of small copper ring culture for the identification of fungi[J].JournalofJiujiangUniversity(NaturalSciences), 2013, 28(1):76-77. (in Chinese)
[11] 马晓平,古玉,刘小敏,等. 大熊猫源枝孢样枝孢霉的分离鉴定[J]. 中国兽医科学,2013 (12):1217-1223.
MA X P, GU Y, LIU X M, et al. Isolation and identification ofCladosporiumcladosporioidesfromAiluropodamelanoleuc[J].VeterinaryScienceinChina, 2013 (12):1217-1223. (in Chinese with English abstract)
[12] 夏志宽,王文岭,杨蓉娅. 国内临床分离阿萨希毛孢子菌3个新基因型分析[J]. 中华医院感染学杂志,2012,22(14):2988-2990.
XIA Z K, WANG W L, YANG R Y. Three new genotypes ofTrichosporonasahiistrains isolated from Chinese patients[J].ChineseJournalofNosocomiology, 2012, 22(14):2988-2990. (in Chinese with English abstract)
[13] 曾秋林,陈灵敏,闵志刚. PAS染色显示真菌在临床上的应用[J]. 检验医学与临床,2010,7(21):2425.
ZENG Q L,CHEN L M,MIN Z G. The clinical application of PAS staining the fungi.[J].LaboratoryMedicineandClinics, 2010, 7(21):2425. (in Chinese)
[14] 尹琦,陆贞妮,刘和艳,等. 5种抗真菌药物对常见感染酵母菌的抗菌活性分析[J]. 广西医科大学学报,2008,25(5):786-787.
YI Q, LU Z N, LIU H Y, et al.The antifungal activity analysis of five antifungal agents to common infection of yeast[J].JournalofGuangxiMedicalUniversity, 2008, 25(5):786-787. (in Chinese)
[15] 马晓平, 杨秋霞, 李长城, 等. 发情期大熊猫阴道真菌的分离鉴定及酵母菌药敏试验[J]. 中国兽医科学, 2016(10):1233-1240.
MA X P, YANG Q X, LI C C, et al. Isolation and identification of fungi from the vagina of estrus giant panda and drug sensitive tests of the isolated yeasts[J].VeterinaryScienceinChina, 2016(10):1233-1240. (in Chinese with English abstract)
[16] BRYAN L K, PORTER B F, WICKES B L, et al. Meningoencephalitis in a dog due toTrichosporonmontevideense[J].JournalofComparativePathology, 2014, 151(2):157-161.
[17] GONZALEZ R N, WILSON D J, SICKLES S A, et al. Outbreaks of clinical mastitis caused byTrichosporonbeigeliiin dairy herds[J].AmericanVeterinaryMedicalAssociationJournal, 2001, 218(2):238-242.
[18] PADHYE A A, VERGHESE S, RAVICHANDRAN P, et al.Trichosporonloubieriinfection in a patient with adult polycystic kidney disease[J].JournalofClinicalMicrobiology, 2003, 41(1):479-482.
[19] BHASKARAN A, OBEID K M, ARBEFEVILLE S, et al.Trichosporonloubierifungemia in a 39-year-old caucasian woman with B-cell lymphoblastic leukemia[J].LaboratoryMedicine, 2016, 47(3):255-258.
[20] MARTY F M, BAROUCH D H, COAKLEY E P, et al. Disseminated trichosporonosis caused byTrichosporonloubieri[J].JournalofClinicalMicrobiology, 2003, 41(11):5317-5320.
[21] 夏志宽,赵逊,王文岭,等. rRNA基因序列分析在阿萨希毛孢子菌鉴定中的应用[J]. 中国真菌学杂志, 2008, 3(3):186-188.
XIA Z K, ZHAO X, WANG W L, et al. The application of rRNA gene sequence analysis in the identification ofTrichosporonasahii[J].ChineseJournalofMycology, 2008, 3(3):186-188. (in Chinese)
[22] 张宇,郭良栋. 真菌DNA 条形码研究进展[J]. 菌物学报,2012,31(6):809-820.
ZHANG Y, GUO L D. Progress of fungal DNA barcode[J].Mycosystema, 2012, 31(6):809-820. (in Chinese with English abstract)
[23] 曾莉莎,吕顺,郑芝波,等. 不同地区荷花腐败病菌生物学特性及IGS序列分析[J]. 热带作物学报,2017,38(1):136-143.
ZENG L S, LYU S, ZHENG Z B, et al.Biological characteristics and IGS sequence analysis of pathogen strains causing lotus rhizome rot(Fusariumcommune) from different regions[J].ChineseJournalofTropicalCrops, 2017, 38(1):136-143. (in Chinese with English abstract)
[24] 郭莉娜,徐英春,窦红涛,等. 临床相关毛孢子菌的鉴定及体外药物敏感性研究[J]. 中国真菌学杂志,2009(2):82-86.
GUO L N,XU Y C,DOU H T, et al. Identification and in vitro antifungal susceptibility of medically importantTrichosporonspecies[J].ChineseJournalofMycology, 2009(2):82-86. (in Chinese with English abstract)
[25] 李厚敏,刘伟,万哲,等. 临床相关毛孢子菌生物学特性的研究[J]. 中华检验医学杂志,2005(6):613-616.
LI H M,LIU W,WAN Z, et al.Microbiological characteristics of medically importantTrichosporonspecies[J].ChineseJournalofLaboratoryMedicine, 2005(6):613-616. (in Chinese)
[26] MORETTI-BRANCHINI M L, FUKUSHIMA K, SCHREIBER A Z, et al.Trichosporonspecies infection in bone marrow transplanted patients[J].DiagnosticMicrobiologyandInfectiousDisease, 2001, 39(3):161-164.
[27] TAWARA S,IKEDA F,MAKI K et al. In vitro activities of a new lipopeptide antifungal agent, FK463, against a variety of clinically important fungi[J].AntimicrobialAgentsandChemotherapy, 1999, 44(1):57-62.
[28] 吕雪莲. 人类致病相关毛孢子菌表型和种系发生特征及种间鉴定方法的比较研究[D]. 北京:中国协和医科大学,2009.
LYU X L. A comparative study on the phenotypic and phylogenetic characteristics of human pathogenic related species and the identification methods of the species [D]. Beijing: Peking Union Medical College, 2009. (in Chinese)

