转G10eve基因棉花的获得及草甘膦抗性初探
陆国清 ,王春玲 ,郝宇琼 ,郭惠明 ,黄英金 ,程红梅 *
(1.江西农业大学农学院/作物生理生态与遗传育种教育部重点实验室,南昌330045;2.中国农业科学院生物技术研究所,北京100081)
棉花作为1种重要的经济作物和油料作物,在全球被广泛种植,但棉花整个生育期内易受到各种生物和非生物因素的胁迫。其中,杂草直接与棉花争水、争肥、争光照,严重影响其产量和质量,造成严重的经济损失[1]。随着农业劳动力价格的不断提高,人工除草费时费力,以及田间管理的成本持续加大,这都提高了棉花种植和管理成本,生产实际中对高效、低毒和广谱除草剂的需求更加迫切。草甘膦是1种内吸性灭生型除草剂,能够特异性的抑制植物中5-烯醇式丙酮酰莽草酸-3-磷酸合酶(5-enolpyruvylshikimate-3-phosphate synthase,EPSPS)的生物活性[2-3],阻断芳香族氨基酸的合成,扰乱植物的正常代谢而使植株死亡[4-5]。由于低残留、易被分解、价格便宜等优点,草甘膦被广泛用于田间化学除草。草甘膦是目前市场上销售量最大,使用最广泛的化学除草剂[6-7]。利用草甘膦进行杂草防治省时省力,但草甘膦属于广谱型除草剂,对绿色植物没有选择性,严重损害农作物。因此要实现棉田的大面积化学除草,需要培育出抗草甘膦的新品种以满足市场需求。
草甘膦被广泛使用以来,科学家对抗草甘膦农作物的研究不断深入,而通过转基因方式获得草甘膦抗性农作物仍然是目前最有效的途径之一。自1987年获得第1株转基因棉花[8],棉花的遗传转化研究就进入飞速发展阶段,抗虫[9-10]、抗除草剂[11-12]转基因棉花相继问世。抗除草剂棉花最早由孟山都公司研究并在美国商业化种植,而在国内有关抗草甘膦转基因棉花的报道虽然很多,都是处于实验研究阶段,我国也一直未引进美国的转基因抗草甘膦棉花。因此,研究具有自主知识产权的抗草甘膦棉花新品种,为我国抗草甘膦转基因棉花的培育提供种质资源。
基因工程可使农作物直接获得目的性状,大大缩短育种年限,在农业育种上的应用已非常广泛。G10基因来源于Deinococcus radiodurans R1,与EPSPS家族的ClassⅠ和ClassⅡ同源性很低,是1种新型的抗草甘膦EPSPS基因,具有较好的开发应用潜力。研究表明在玉米[13]、大豆[14]中过表达EPSPS基因能有效提高作物的草甘膦抗性,其中转基因玉米的草甘膦抗性水平和孟山都开发的抗性相同,具有产业化应用的前景。本实验以棉花下胚轴作为材料,通过农杆菌介导法将G10eve基因转化棉花,获得了抗草甘膦的转基因棉花。在高于田间使用浓度的草甘膦处理下,转基因植株叶片未产生药害,为培育高抗除草剂棉花品种提供了新的育种材料。
1 材料与方法
1.1 材料
供试材料为常规陆地珂字棉312(Coker 312,文中简称 C312)。
G10基因是浙江大学克隆的抗草甘膦基因,对该基因进行突变改良得到的基因命名为G10eve。转化用农杆菌菌株为LBA4404,用于转化的载体及质粒由浙江大学沈志成教授提供,包含2个草甘膦抗性基因G10eve,分别由木薯叶脉花叶病毒 (Cassava vein mosaic virus,CsVMV)的PCVs启动子和花椰菜花叶病毒(Cauliflower mosaic virus,CaMV)的35S启动子表达,选择标记基因为NPTⅡ,载体如图1所示。植物DNA、RNA提取试剂盒购自于天根生化科技 (北京)有限公司。反转录、荧光定量PCR(Polymerase Chuin reaction)相关试剂盒购自于北京全式金生物技术有限公司。草甘膦购自美国孟山都公司(农达,41%草甘膦异丙胺盐水剂,马来西亚)。
1.2 方法
1.2.1 生物信息学初步分析。将G10eve基因序列在https://blast.ncbi.nlm.nih.gov/Blast.cgi进行比对,并根据比对结果构建进化树。将其氨基酸序列在https://www.ncbi.nlm.nih.gov/Structure/cdd/w rpsb.cgi预测该基因的蛋白保守区,通过预测其蛋白质3D结构。
1.2.2 棉花的遗传转化。采用商品化培养基,操作步骤参照常规转化方法[15],以C312下胚轴为外植体,卡那霉素(Kanamycin,Kan)为筛选抗性,获得转基因再生植株。

图1 G10eve基因载体示意图Fig.1 Schematic of G10eve gene expression vector
转化率(%)=阳性胚性愈伤组织数/总胚性愈伤组织数×100%;
分化率 (%)=分化出阳性苗胚性愈伤组织数/总胚性愈伤组织数×100%。
1.2.3 DNA提取及PCR分子检测。利用DNA提取试剂盒,提取棉花胚性愈伤组织及再生T0和T1代棉花叶片总DNA。以质粒为阳性对照,C312棉花总DNA为阴性对照,利用特异性引物G10F/G10R(表1)进行PCR扩增,检测目的基因是否整合到棉花基因组中。反应程序为94℃5 m in;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35 个循环;72℃10 min。扩增产物大小为452 bp。1%琼脂糖凝胶电泳检测,凝胶成像分析系统拍照并保存。
1.2.4 RNA提取及荧光定量RT-PCR分析。C312及T4转基因植株,在幼苗期提取叶片总RNA,电泳检测质量后反转录成cDNA,-20℃保存备用。
根据目的基因序列,设计荧光定量特异性引物Target-F/Target-R (表1)扩增G10eve基因,UBQ-F/R(表1)为内参基因引物。荧光定量RT-PCR按照试剂盒说明书进行扩增,反应程序为 94 ℃ 30 s; 94 ℃ 5 s,60 ℃ 15 s,72 ℃ 10 s,40个循环。反应在ABI 7500 real-time system(Applied Biosystems,美国)荧光定量PCR仪上进行,3次重复,采用2-△△Ct方法进行分析。
1.2.5 转基因棉花草甘膦筛选。在花盆中种植转基因及对照组棉花,待棉花两片子叶完全展开(两叶一心期)时,分别用体积浓度 0、2、5、8 m L·L-1的草甘膦农药喷施棉花幼苗 (棉花大田推荐使用浓度为稀释 200 倍,即 5 m L·L-1)。10 d 后观察喷施草甘膦对植株的损伤情况,每种浓度处理1盆,每盆不少于10株植株。
1.2.6 莽草酸含量的测定。草甘膦处理72 h后采集叶片,根据巩元勇等[16]方法提取并在380 nm下测定莽草酸的吸光值。每个样品测定3次。

表1 引物序列Table 1 The sequence of primers
2 结果与分析
2.1 G10eve基因初步分子生物信息学分析
将G10eve基因核苷酸序列在NCBI中进行比对分析,12条序列与其具有一定程度的同源性。在进化树中可以发现,其与现有的EPSPS基因同源性很低,亲缘关系较远(图2A)。对G10eve基因编码的氨基酸进行功能及保守区预测,结果表明其具有类似于EPSPS的功能保守结构域,与草甘膦抗性基因aroA编码的蛋白同源性较高(图2B)。在NCBI-PDB中进行比对,结果显示G10eve与霍乱弧菌(Vibrio Cholerae)的 3-Phosphoshikimate 1-Carboxyvinyltransferase序列相似度最高 (E值:1.554E-36, 一致性:28%)。 通过Cn3D软件分析可知,G10eve蛋白三维结构含有11个α-螺旋和24个β-片层结构(图2C)。
2.2 抗草甘膦基因转化棉花及植株再生
本研究以C312无菌苗下胚轴为外植体,农杆菌浸染后,通过体细胞胚胎发生途径,经过抗性愈伤诱导、胚性愈伤诱导及植株再生获得转基因植株。利用50 mg·L-1Kan对下胚轴进行抗性筛选,下胚轴在抗性愈伤诱导培养基上培养7 d后,两端开始膨大,45 d后即可获得大量愈伤组织。选取浅绿色或黄绿色愈伤组织进行增殖培养,待抗性愈伤组织约1 cm3大小时,移至无外源激素的培养基上进行分化培养。根据愈伤组织状态的不同,观察质地疏松、淡黄色的胚性愈伤的产生。在分化培养基上铺垫滤纸,可减少三角瓶内水珠凝聚,也有利于愈伤组织及胚状体的继代操作,最重要的是对胚性愈伤组织适度的胁迫诱导,有利于正常植株的再生。外植体在诱导培养后8个月,开始出现再生苗。本研究发现,对愈伤组织进行培养长达2 a,仍可诱导出具有真叶的再生植株。
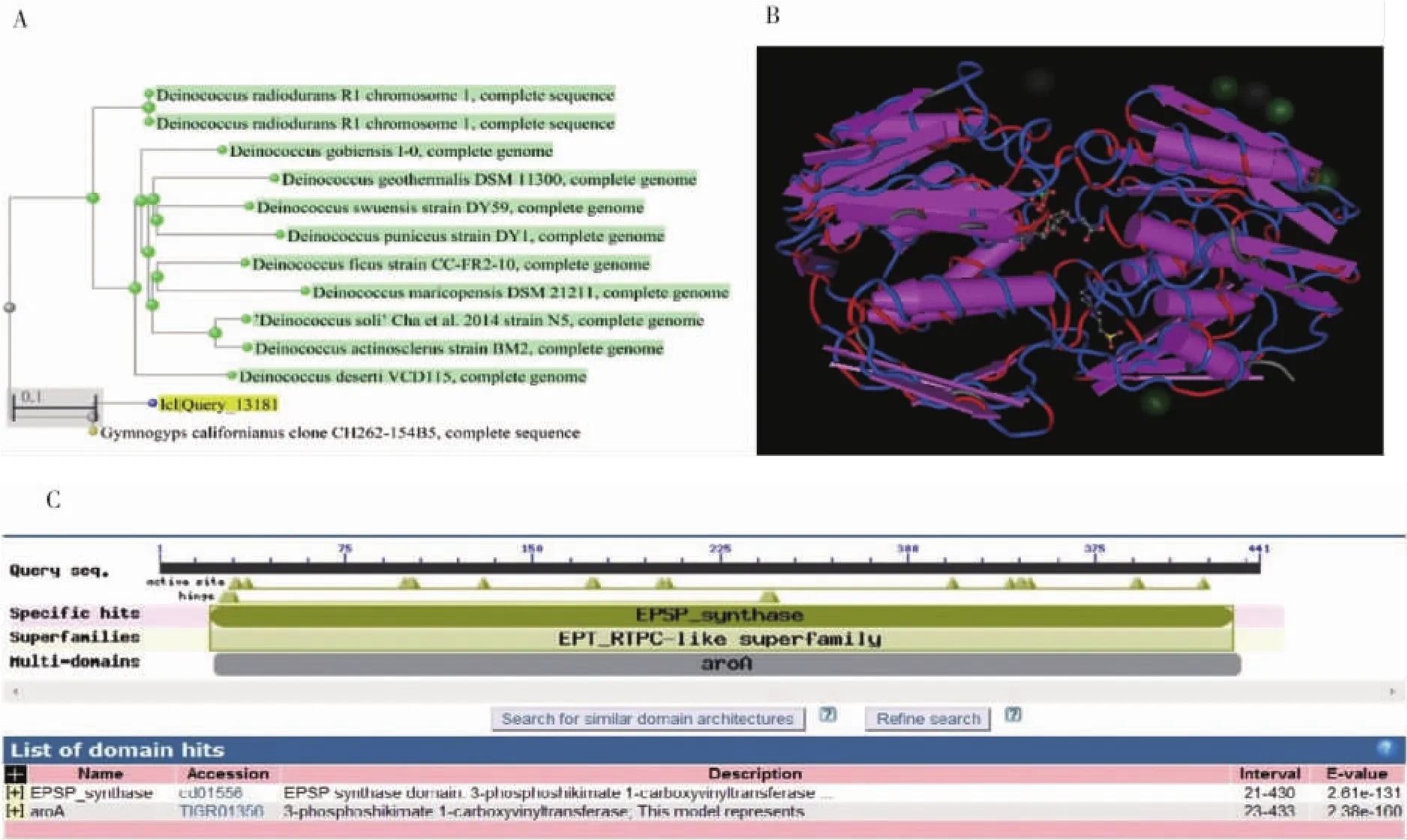
图2 G10eve基因的生物信息学分析Fig.2 Bioinformatics analysis of G10eve gene
2.3 胚性组织及转基因植株的分子检测
2.3.1 胚性愈伤的PCR检测。通过抗性愈伤组织筛选诱导,共获得69个胚性愈伤系,经PCR验证,其中34个为阳性的愈伤系,转化率49.3%。图3为部分独立转化愈伤系PCR检测结果,初步确定通过农杆菌转化,已将G10eve基因转入到棉花材料中。
2.3.2 转基因植株检测。通过对胚性愈伤进行分子检测,及时处理掉未转化成功的愈伤系,并对剩余阳性愈伤系进行再生苗分化诱导。对嫁接成活的85棵棉花T0植株进行PCR检测,其中28个独立愈伤系的59棵单株扩增出目的条带,再生植株阳性分化率为40.6%。图4为部分转基因嫁接苗检测结果,初步证明目的基因已经整合进棉花基因组中。鉴定的阳性嫁接苗在温室中继续培养,直至种子成熟。最终共收获12个愈伤系中的19棵阳性单株的种子。将阳性植株的部分种子种植在温室中,对T1幼苗进行PCR检测,结果表明:在19个植株中,有15株T1植株中能够检测到目的基因条带,4个单株基因组DNA中未检测到目的条带。
2.3.3 转基因棉花植株不同株系间G10eve基因相对表达量分析。选择能够稳定遗传的T4种子的L91、L152两个株系进行荧光定量PCR分析。结果表明,G10eve基因在这2个株系中能够转录表达(图5),且在2个株系中表达量差异明显,L91株系中基因相对表达量约是L152株系中表达量的6.96倍。
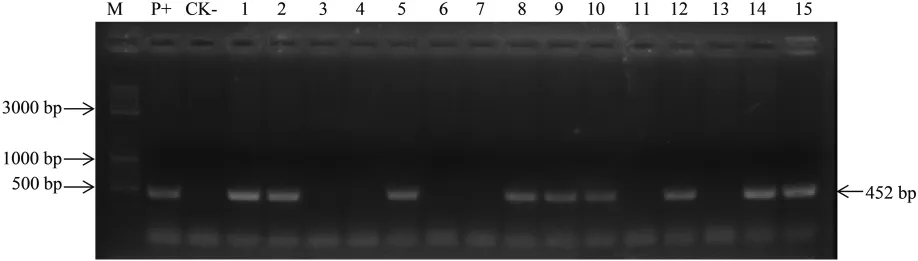
图3 转基因愈伤系PCR鉴定Fig.3 PCR analysis of transgenic calli
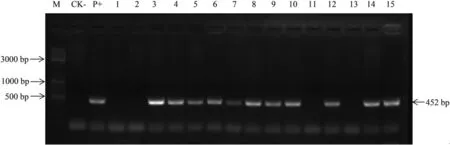
图4 转基因嫁接植株PCR鉴定Fig.4 PCR analysis of transgenic grafted plants
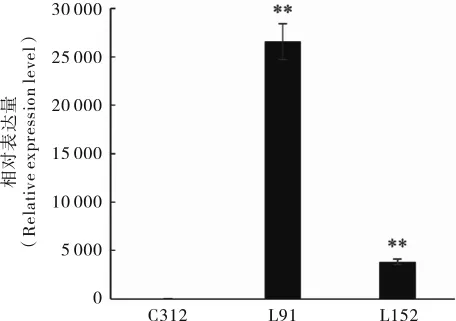
图5 G10eve基因在转基因棉花株系中的表达分析Fig.5 The relative expression of G10eve gene in defferent lines of transgenic cotton
2.4 转基因植株的草甘膦检测
为确定过表达G10eve基因的L91株系草甘膦抗性水平,采用盆栽实验,在子叶期喷施不同浓度的草甘膦(图6)。在不喷施草甘膦的情况下,L91转基因株系及受体C312棉花植株均可正常生长。喷施2 m L·L-1草甘膦农药10 d后,C312棉花生长受到抑制,生长点坏死,子叶边缘有明显枯斑,叶片失绿、萎蔫;而转基因植株生长正常进入两叶期,且叶片无枯斑出现。5 m L·L-1草甘膦喷施处理后,对照C312植株生长点坏死,部分小苗已经干枯死亡,药害明显;而转基因棉花生长正常,未产生明显枯斑,进入真叶期。8 m L·L-1草甘膦喷施处理后,C312植株全部死亡;转基因L91株系部分植株子叶出现枯斑,但植株整体绿色,能够正常进入两叶期。根据草甘膦喷施实验,叶片对草甘膦的敏感程度及枯萎现象,可以确定过表达G10eve基因确实能够提高棉花对草甘膦的抗性。

图6 草甘膦处理10 d后对棉花叶片的影响Fig.6 The effect of glyphosate treatment after 10 days on cotton leaves

图7 不同浓度草甘膦处理下棉花叶片莽草酸相对含量Fig.7 The relative contents of shikimic acid in cotton leaves with different glyphosate treatment
2.5 莽草酸含量的测定
莽草酸含量是判定植株对草甘膦抗性的重要生理指标。2 m L·L-1草甘膦处理后,C312棉花植株叶片中莽草酸相对含量较正常生长条件下提高2倍左右;随着草甘膦浓度的增加,C312叶片中莽草酸相对含量逐渐增加,8 m L·L-1草甘膦处理下,叶片中莽草酸相对含量最高(图7)。而不同浓度的草甘膦处理转基因阳性株系L91,L91叶片中莽草酸含量变化不大(图7)。说明过表达G10eve转基因植株具有草甘膦抗性,与喷施草甘膦的抗性表型一致。
3 讨论与结论
目前,用于棉花遗传转化的方法主要有基因枪[17-18]、花粉管通道技术[19-20]和农杆菌介导转化[21-22]。农杆菌介导转化法目前被大多数实验室采用[23]。虽然棉花遗传转化技术比较成熟,但其转化受菌株、受体基因型、激素、培养条件等多种因素限制[24-26],流程比较复杂和困难,转化周期长,导致很多实验室很难开展棉花遗传转化工作。本研究以C312为受体,使用商品化培养基,通过对愈伤及嫁接苗的检测,转化效率和分化效率可达到40%以上。商品化培养基在遗传转化中的有效使用,对程序化、标准化、规模化的棉花遗传转化体系的建立提供了有利条件。在棉花遗传转化过程中通过检测愈伤,提前确定阳性愈伤系,可有效降低实验工作强度,有效提高继代培养效率。胚性愈伤通常认为来源于单细胞分化,体积小,可快速分裂并在短时间内获得大量材料,是1种比较理想的转化受体材料[23]。以胚性愈伤为遗传转化受体材料,在海岛棉[27]、陆地棉[28]中已经应用并成功获得再生苗,有效的缩短了转化周期。本研究发现,对胚性愈伤组织进行再生诱导,在第8~24个月内均可不断获得转化植株,证明胚性愈伤潜在再生能力很强,这为开展以胚性愈伤为受体材料的棉花遗传转化工作提供了基础。
草甘膦是灭生型除草剂,喷施后药效明显,见效快。近年,国外抗除草剂农作物种植量逐年增加,而国内研究相对滞后,缺乏竞争力。为满足市场需求,加快获得抗草甘膦的作物,培育具有自主知识产权的作物新品种迫在眉睫。抗草甘膦基因在育种过程中不仅可以作为目标性状基因,也可以作为抗性筛选基因,而且更高效更安全,具有很高的研究价值。本研究在棉花中过表达草甘膦抗性基因G10eve获得了大量阳性转基因材料,为抗草甘膦转基因棉花的培育提供了种质资源。外源基因在受体中的表达和自身繁殖后代过程中的稳定遗传直接影响转基因植物的应用。实验中在对T1植株进行检测时发现,G10eve基因在4株后代材料中未能检测到阳性植株,这可能是因为T0植株在温室中收获的种子量偏少,有个别材料仅收获到1粒种子,而外源基因在遗传过程中发生分离,后代检测样本量不足所致;也可能是基因在传代过程中丢失或表达沉默所致。外源基因的整合和遗传比较复杂。外源基因可随机插入到受体材料基因组中。基因插入位点的不同,甲基化、多拷贝、转录后共抑制等因素均可造成转基因沉默或基因表达量下降[29-30],这可能也是造成转基因株系间G10eve基因表达量差异较大的原因,但具体原因需要进一步的实验验证。
利用农杆菌介导的遗传转化方法,成功获得了转G10eve基因棉花,转化效率和分化效率分别高达49.3%、40.6%。子叶期喷施不同浓度梯度草甘膦,发现转基因株系植株获得对草甘膦的抗性,可耐受 8 m L·L-1草甘膦。
[1]孟灵真,陈全家,杨婷,等.农杆菌介导的bar基因和Bt基因的遗传转化研究[J].新疆农业科学,2013,50(12):2189-2196.Meng Lingzhen,Chen Quanjia,Yang Ting,et al.Studies on genetic transformation of Agrobacterium-mediated bar gene and Bt gene[J].Xinjiang Agricultural Sciences,2013,50(12):2189-2196.
[2]Am rhein N,Deus B,Gehrke P,et al.The site of the inhibition of the shikimate pathway by glyphosate:II.Interference of glyphosate with chorismate formation in vivo and in vitro[J].Plant Physiology,1980,66(5):830-834.
[3]Woodburn A T.Glyphosate:Production,pricing and use worldw ide[J].Pest Management Science,2000,56(4):309-312.
[4]Duke S O,Pow les S B.Glyphosate:A once-in-a-century herbicide[J].Pest Management Science,2008,64(4):319-325.
[5]Tan S,Evans R,Singh B.Herbicidal inhibitors of amino acid biosynthesis and herbicide-tolerant crops[J].Am ino Acids,2006,30(2):195-204.
[6]Beckie H J.Herbicide-resistant weed management:Focus on glyphosate[J].Pest Management Science.2011,67(9),1037-1048.
[7]陈世国,强胜,毛婵娟.草甘膦作用机制和抗性研究进展[J].植物保护,2017,43(2):17-24.Chen Shiguo,Qiang Sheng,Mao Chanjuan.Mechanism of action of glyphosate and research advances in glyphosate resistance[J].Plant Protection,2017,43(2):17-24.
[8]Umbeck P,Johnson G,Barton K,et al.Genetically transformed cotton(Gossypium hirsutum L.)plants[J].Nature Biotechnology,1987,5(3):263-266.
[9]Perlak F J,Deaton R W,Armstrong T A,et al.Insect resistant cotton plants[J].Nature Biotechnology,1990,8(10):939-943.
[10]Thomas J C,Adams D G,Keppenne V D,et al.Protease inhibitors of manduca sexta expressed in transgenic cotton[J].Plant Cell Reports,1995,14(12):758-762.
[11]Bayley C,Trolinder N,Ray C,et al.Engineering 2,4-D resistance into cotton[J].Theoretical and Applied Genetics,1992,83(5):645-649.
[12]Keller G,Spatola L,M ccabe D,et al.Transgenic cotton resistant to herbicide bialophos[J].Transgenic Research,1997,6(6):385-392.
[13]李京.新型转基因抗草甘膦玉米的培育及转基因玉米安全控制技术的研究[D].杭州:浙江大学,2013.Li Jing.Research on the novel glyphosate-resistant corn and the selectively term inable strategy[D].Hangzhou:Zhejiang University,2013.
[14]谭苗苗.转g10evo基因抗草甘膦大豆的研究[D].杭州:浙江大学,2016.Tan Miaom iao.The study of g10evo glyphosate-resistant transgenic soybean[D].Hangzhou:Zhejiang University,2016.
[15]李燕娥,朱桢,陈志贤,等.豇豆胰蛋白酶抑制剂转基因棉花的获得[J].棉花学报,1998,10(5):237-243.Li Yan’e,Zhu Zhen,Chen Zhixian,et al.Obtaining transgenic cotton plants with cow pea trypsin inhibitor gene[J].Acta Gossypii Sinica, 1998, 10(5): 237-243.
[16]巩元勇,郭书巧,束红梅,等.1株抗草甘膦棉花突变体草甘膦抗性的初步鉴定[J].棉花学报,2014,26(1):18-24.Gong Yuanyong,Guo Shuqiao,Shu Hongmei,et al.Prelim inary identification of glyphosate resistance of a new cotton mutant[J].Cotton Science,2014,26(1):18-24.
[17]M ccabe D E,Martinell B J.Transformation of elite cotton cultivars via particle bombardment of meristems[J].Nature Biotechnology,1993,11(5):596-598.
[18]Zapata C,Park S H,EIzik K M,et al.Transformation of a Texas cotton cultivar by using Agrobacterium and the shoot apex[J].Theoretical and Applied Genetics,1999,98(2):252-256.
[19]刘锡娟,刘昱辉,王志兴,等.转5-烯醇式丙酮酰莽草酸-3-磷酸合酶(EPSPS)基因抗草甘膦烟草和棉花的获得[J].农业生物技术学报,2007,15(6):958-963.Liu Xijuan,Liu Yuhui,Wang Zhixing,et al.Generation of glyphosate-tolerant transgenic tobacco and cotton by transformation with a 5-enolpyruvyl-shikimate-3-phosphate synthase(EPSPS)gene[J].Journal of Agricultural Biotechnology,2007,15(6):958-963.
[20]燕树锋,祝水金,刘海芳,等.转EPSPS基因抗草甘膦棉花的遗传分析[J].华北农学报,2015,30(3):54-57.Yan Shufeng,Zhu Shuijin,Liu Haifang,et al.Genetic analysis of transgenic glyphosate resistance cotton with EPSPS gene[J].Acta Agriculturae Boreali-Sinica,2015,30(3):54-57.
[21]Gould J H,Magallanes-Cedeno M.Adaptation of cotton shoot apex culture to Agrobacterium-mediated transformation[J].Plant Molecular Biology Reporter,1998,16(3):1-10.
[22]Jin Shuangxia,Zhang Xianlong,Nie Yichun,et al.Identification of a novel elite genotype for in vitro culture and genetic transformation of cotton[J].Biologia Plantarum,2006,50(4):519-524.
[23]Jin Shuangxia,Zhang Xianlong,Liang Shaoguang,et al.Factors affecting transformation efficiency of embryogenic callus of upland cotton(Gossypium hirsutum)with Agrobacterium tumefaciens[J].Plant Cell,Tissue and Organ Culture,2005,81(2):229-237.
[24]Sunilkumar G,Rathore K S.Transgenic cotton:Factors influencing Agrobacterium-mediated transformation and regeneration[J].Molecular Breeding,2001,8(1):37-52.
[25]孙英坤,代其林,龚元亚,等.农杆菌介导的棉花遗传转化过程中诸因素对出愈率的影响[J].四川大学学报(自然科学版),2012,49(2):431-435.Sun Yingkun,Dai Qilin,Gong Yuanya,et al.Effects of some factors on callus rate in the process of cotton genetic transformation mediated by Agrobacterium tumefaciens[J].Journal of Sichuan University(Natural Science Edition),2012,49(2):431-435.
[26]罗晓丽,吴家和,肖娟丽,等.非珂字棉系统陆地棉的转化效率[J].棉花学报,2002,14(6):365-367.Luo Xiaoli,Wu Jiahe,Xiao Juanli,et al.Transformed efficiency of non-Coker upland cotton(Gossypium hirsutum L.)cultivars[J].Cotton Science,2002,14(6):365-367.
[27]周丽容,陈全家,贺雅婷,等.农杆菌介导海岛棉胚性愈伤高效遗传转化体系的研究[J].新疆农业大学学报,2011,34(4):317-320.Zhou Lirong,Chen Quanjia,He Yating,et al.Research on high efficient genetic transformation system of agrobacterium Gossypium barbadense L.embryogenic calli[J].Journal of Xinjiang Agricultural University,2011,34(4):317-320.
[28]谢德意,金双侠,郭小平,等.棉花胚性愈伤组织的转化及转基因胚状体的有效萌发与成苗技术研究[J].作物学报,2007,33(5):751-786.Xie Deyi,Jin Shuangxia,Guo Xiaoping,et al.Genetic transformation of cotton with embryogenic calli as explants and efficient transgenic somatic embryoid germ ination and plant recovery[J].Acta Agronom ica Sinica,2007,33(5):751-786.
[29]夏兰芹,王远,郭三堆.外源基因在转基因植物中的表达与稳定性[J].生物技术通报,2000(3):8-12.Xia Lanqin,Wang Yuan,Guo Sandui.The stability of the expression of foreign genes in transgenic plants[J].Biotechnology Information,2000(3):8-12.
[30]吴才君,范淑英.植物转基因沉默[J].江西农业大学学报,2004,26(1):154-158.Wu Caijun,Fan Shuying.Gene silence in transgenic plants[J].Acta Agriculturae Universitatis Jiangxiensis,2004,26(1):154-158.

