大丽轮枝菌致病缺陷型T-DNA插入突变体的筛选与鉴定
崔伟业,周雷,单柳颖,张君,戴小枫,郭维
(中国农业科学院农产品加工研究所,北京100193)
大丽轮枝菌(Verticillium dahliae K leb.)属于半知菌类轮枝孢属真菌,寄主范围极广,可引起200多种双子叶植物的黄萎病;由其引起的棉花黄萎病是制约我国棉花生产的主要因素之一[1-2]。虽然目前棉花黄萎病的侵染过程比较清楚,土壤中存活的微菌核或分生孢子受到棉花根系分泌物的刺激后萌发产生菌丝侵染寄主的根部,然后进入维管组织破坏寄主水分运输,产生萎蔫和维管束褪绿褐化等症状[3];但是由于大丽轮枝菌的微菌核在土壤中存活时间长、抗病育种滞后、缺乏环境友好且防治效果好的杀菌剂等因素导致目前尚无有效的防治手段[4-8]。因此,研究大丽轮枝菌的致病机理是制定防治策略的基础性工作。
遗传转化技术的发展为深入研究基因功能提供了强有力的工具,自1973年M ishra和Tatum首次成功实现粗糙脉孢菌的遗传转化以来[9],目前已通过PEG介导的原生质体遗传转化(Polyethylene glycol-mediated protoplast transformation)、转座子介导的遗传转化(Transposon-mediated transformation)、限制性内切酶介导的遗传转化(Restriction enzyme mediated integration,REM I)和农杆菌介导的遗传转化 (Agrobacterium tumefaciens-mediated transformation,ATMT) 等技术对100多种丝状真菌实现了遗传转化[10-11]。以ATMT为基础的T-DNA突变体库的开发与应用已经成为鉴定和分析致病相关基因的有效途径之一。目前通过对大丽轮枝菌的T-DNA突变体库筛选已经获得了一些致病相关基因的信息,如:VdEg1(Endoglucanase 1)、VdHMGS (Hydroxyl-methyl glutaryl-CoAsynthase)、VdMFS1(Major facilitator superfamily 1) 和 VdCYP1 (Cytochrome P450 monooxygenase 1)等[12-14]。
本研究以本实验室建立的强致病力落叶型大丽轮枝菌Vd991的T-DNA突变体库为基础[15],从中随机选取了294个转化子进行致病力测定,经过2轮筛选共获得了9个致病缺陷型突变体。初步明确了这些突变体的生物学性状和插入位点侧翼序列特征,为大丽轮枝菌致病机理研究提供了候选基因。
1 材料和方法
1.1 菌株的活化和培养
落叶型大丽轮枝菌菌株Vd991的T-DNA插入突变体初次活化采用王新艳等[16]的方法,分离单孢后在培养瓶中25℃避光培养7 d并保存甘油菌。初步筛选到致病力下降的突变体后,将候选突变体和野生型 Vd991 在含有 50 μg·m L-1卡那霉素和 100 μg·m L-1氨苄青霉素的 PDA 培养基上再次活化,25℃恒温避光培养7 d。在菌落生长边缘处取直径5 mm菌碟接种于查比克液体培养基中,180 r·m in-1,25 ℃,避光恒温摇床培养 7 d。用四层无菌纱布过滤孢子,调节孢子浓度至1×107m L-1备用。过滤后的菌丝用锡箔纸包裹后置于-80℃冰箱保存,用于提取基因组DNA。
1.2 菌株致病力测定
初次致病力筛选参考王新艳等[16]的大丽轮枝菌致病性相关突变体快速筛选方法,在培养瓶中加入20 m L无菌水,洗脱孢子,准备孢子悬浮液。以野生型菌株Vd991为对照,采用蘸根接菌法将大丽轮枝菌接种到感病陆地棉品种军棉1号的根部,20 d后观察统计发病情况。在初步筛选获得致病力下降突变体的基础上再采用朱荷琴等[17]的蛭石沙土无底纸钵定量接种菌液的方法,每个突变体分别接种16株棉花用于病情指数调查,以野生型菌株Vd991和H2O为对照,在棉花第1片真叶完全展开时每株棉花接种20 m L浓度为1×107m L-1的孢子悬浮液。接菌后每天观察统计1次病情指数。病情指数=100×∑(各级病株数×相应病级)/(调查总样本数×最高病级)。棉花感染大丽轮枝菌后病级的划分标准为:0级:子叶和真叶无病状;1级:1至2片子叶发病;2级:2片子叶和1片真叶发病;3级:子叶和2片及2片以下真叶发病;4级:3片及3片以上真叶发病。接种后棉花的病情指数用SPSS 17.0进行分析。
1.3 菌株生物学特性测定
1.3.1 菌株生长速率测定。取Vd991和突变体分别接种至CM培养基[18]上活化,25℃恒温避光培养15 d后,用直径为5 mm的打孔器在菌落边缘处取菌碟再次置于9cm的CM培养基中央。25℃避光培养10 d后观察菌落形态和测量菌落直径大小。每个菌株设置5个重复。
1.3.2 菌株产孢量测定。分别取Vd991和突变体的2粒菌碟接种至25 m L查比克液体培养基中培养7 d后收集不同菌株的分生孢子,用无菌水调节孢子浓度至1×106m L-1,然后取1 μL接种于 50 m L 查比克液体培养基,180 r·m in-1,25 ℃避光恒温摇床培养5 d后用血球计数板测定孢子产量。每个菌株设3次重复,菌株的产孢量取3次重复的平均值。

图1军棉1号接种大丽轮枝菌野生型Vd991,致病缺陷型突变体和水(阴性对照)后第25天的症状Fig.1 Sympotoms of G.hirsutum cv.Junmian 1 innoculated with Vd991,pathogeniciy defective T-DNA mutants and H2O(negative control)at 25 days post-inoculation
1.4 致病缺陷型突变体的分子验证
1.4.1 潮霉素抗性标记的PCR检测。采用CTAB法[6]提取不同菌株的基因组DNA。以Vd991为对照,通过 PCR(Polymerase chain reaction)扩增检测突变体中是否含有潮霉素抗性基因(Hygromycin gene,Hyg),扩增引物为HygF和HygR(表1)。PCR反应条件为95℃预变性5 min,95℃变性 30 s,55 ℃复性 30 s,72 ℃延伸 2 m in,共30个循环;循环结束后72℃继续延伸10 m in。
1.4.2 T-DNA插入拷贝数检测。取野生型Vd991和其它突变体基因组DNA 30 μg,分别用Bam HI 37℃单酶切过夜。酶切完后加入20 μL 10 mM的EDTA溶液终止反应并将DNA抽提浓缩至30 μL后进行电泳。探针为随机标记的Hyg片段。Southern杂交具体步骤参照Roche试剂盒提供的方法进行。
1.5 致病缺陷型突变体T-DNA插入位点侧翼序列的克隆与分析
利 用 hiTAIL-PCR (high-efficiency thermal asymmetric interlaced PCR)方法用兼并引物LAD1,LAD2,LAD3,LAD4,LAD5 和特异引物 RB1 进行第一轮PCR(表1),随后取第一轮PCR产物为模板,特异引物AC1和RB2进行第二轮PCR,最后以第二轮PCR产物为模板,特异引物RB3和AC1进行第三轮PCR。扩增得到插入T-DNA片段的RB(Right boder)端与大丽轮枝菌基因组之间的邻接序列。hiTAIL-PCR参考刘耀光等[19]的方法进行,回收第3轮500~1 000 bp的PCR产物,并将其克隆至pEASY-T1 Simple载体(北京全式金生物技术有限公司)后测序。测序结果与Ensembl基因组数据库中在线共享的大丽轮枝菌VdLs.17的基因组数据库(http://fungi.ensembl.org/Verticillium_dahliae/Info/Index)进行Blast比对分析,确定T-DNA插入位点的序列信息。
1.6 致病相关基因的克隆
根据VdLs.17基因组的序列信息,设计所鉴定的致病相关基因的特异引物 (表1)。然后从Vd991基因组中扩增致病相关基因。反应条件为95℃预变性 5min,95℃变性 30 s,55℃复性 30 s,72℃延伸4 m in,共30个循环,循环结束后72℃延伸10 m in。
1.7 数据分析工具
采用 M icrosoft Office Excel 2010,SigmaPlot 12.5和SPSS 17.0等软件分析致病缺陷型突变体的生长速率、产孢量和病情指数等。
2 结果与分析
2.1 致病缺陷型突变体的筛选
294个大丽轮枝菌的T-DNA插入突变体经过2轮致病力筛选,共有9个突变体接种棉花
25 d后的病症表现与接种野生型的棉花相比明显减弱(图1)。病情指数统计发现接种这些突变体的棉花的病情指数与野生型接种的棉花相比极显著下降(P<0.01);其中突变体M 11H11的病指下降幅度最明显,与野生型相比下降了32.26%,突变体M 12A11的病指下降幅度最小,相对野生型下降了9.68%,其余突变体的病指与野生型的病指相比都有不同程度的下降 (表2);表明这9个突变体在寄主棉花上的致病力与野生型相比均明显降低。

表1本研究所用的引物Table 1 Primers used in this study

表2致病缺陷型突变体致病性鉴定Table 2 Analysis of virulence of pathogenicity defective mutants
2.2 致病缺陷型突变体的分子检测
利用引物HygF和HygR对9个突变体和野生型Vd991中潮霉素基因进行检测,结果表明在所有突变体中均可以扩增出1 026 bp的潮霉素片段,而在野生型中则未能扩增到目的片段(图2A)。Southern杂交结果显示9个突变体中的T-DNA均已整合插入到大丽轮枝菌的基因组中。除M 11D07的T-DNA为2个拷贝插入以外,其余的均为单拷贝插入(图2B)。

图2突变体中潮霉素基因以及T-DNA插入拷贝数的检测Fig.2 Analysis of Hyg gene and T-DNA copy number in the Vd991 and pathogeniciy defective T-DNA mutants
2.3 致病缺陷型突变体的生物学表型分析
和野生型Vd991相比,突变体菌株在营养比较丰富的CM培养基上菌落生长速率发生了不同程度的变化。菌落形态观察和生长速率测定结果表明与野生型Vd991每天的生长速率(3.49±0.42 mm)相比,突变体 M 12A11、M 12B05、M 12H01、M 13E01和M 13H10的生长速率极显著下降;其中M 13E01生长速率最慢,与野生型相比下降约29.7%;而突变体M 11H11、M 11D07、M 12B10和M 13H08的生长速率与野生型差异不显著(图3A和3B)。
产孢量测定结果表明与野生型相比,突变体M 11H11,M 13H10,M 12H01 和 M 12A11 的 产 孢量极显著下降,分别下降了70.5%,53.6%,48.8%和39.2%;但是突变体M 11D07和M 13E01的产孢量与野生型相比分别提高了55.8%和44.2%,差异显著(图3C)。这表明T-DNA插入不同程度地影响了突变体的生长速率和产孢能力。
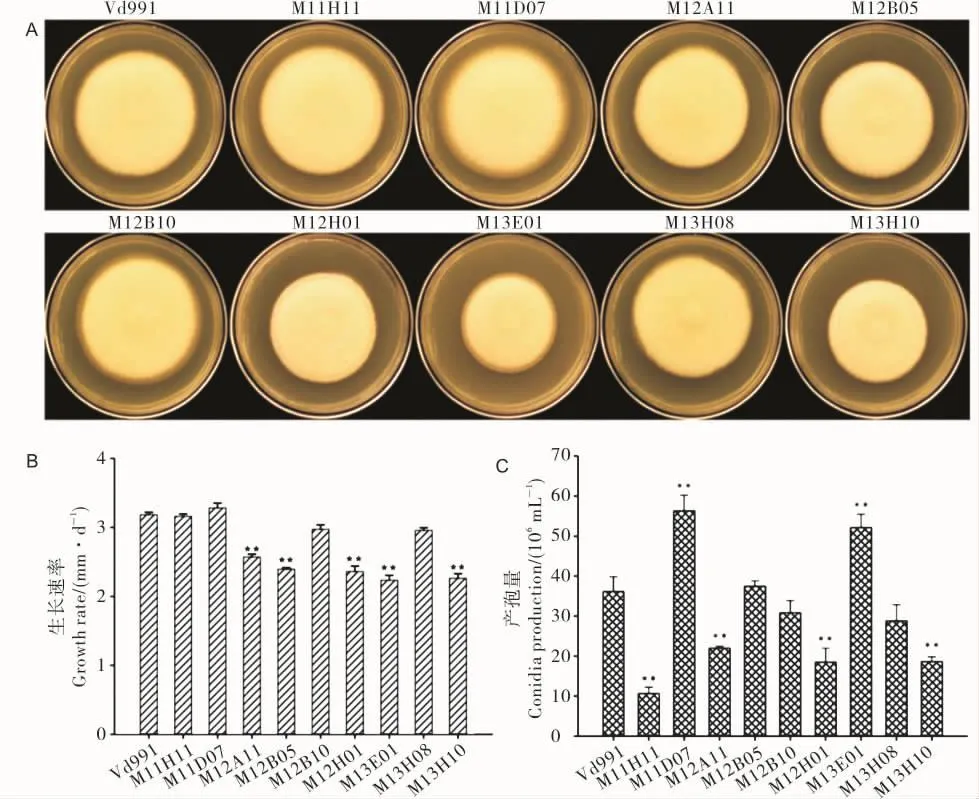
图3野生型Vd991与致病缺陷型突变体的菌落形态、生长速率和产孢量比较分析Fig.3 Com parison of colonial morphology,grow th rate and conidia production between Vd991 and pathogeniciy defective T-DNA mutants.
2.4 致病缺陷型突变体的T-DNA插入位点侧翼序列分析
将通过hiTAIL-PCR得到的RB侧翼序列与VdLs.17的基因组数据进行比对分析得到9个突变体中T-DNA插入位点的侧翼序列信息,其中M 12A11,M 12B10和 M 13H08的 T-DNA RB 右端均缺失1个A(图4)。另外,从表3中发现有4个突变体的T-DNA插在基因的编码区;3个突变体的T-DNA插在基因上游300 bp以内的启动子区;2个突变体的T-DNA插在基因下游300 bp以内的终止子区,其中突变体M 11D07为2个拷贝;没有T-DNA插在内含子区的突变体。这些插在基因启动子区和终止子区的突变体有可能影响这些基因的表达而导致突变体的致病力下降。从T-DNA插入位点来看,10个插入位点分布在大丽轮枝菌5条染色体上(表3),表明构建的大丽轮枝菌T-DNA插入突变体库具有很好的随机性,可以在全基因组范围内实现大规模的基因功能筛选与鉴定。

图4 T-DNA插入位点右边界序列分析Fig.4 Alignment of the RB sequences at the junction of T-DNA integration site of V.dahliae mutants
2.5 致病相关基因的克隆与分析
根据VdLs.17的基因组信息,设计表3中鉴定到的致病相关基因的特异引物在野生型Vd991中克隆相应的基因序列。序列分析结果显示Vd991中与VdLs.17中这10个致病相关基因的序列相似性为 97%~100%; 其中VDAG_00134和VDAG_03916这2个基因的序列在Vd991与VdLs.17中序列完全相同;而其它基因的差异主要体现在单碱基的突变和缺失。依据VdLs.17的功能注释,这10个基因可以分为3类:第一类是编码功能未知蛋白的5个基因;第二类是编码预测定位于细胞核的参与细胞功能调节的基因,包括编码SUA5蛋白的VDAG_04094, 编 码 Mago nashi蛋 白 的VDAG_07829和编码DNA修复相关核酸外切酶rad1的VDAG_01087;第三类是编码参与碳水化合物或脂酶代谢的基因,如编码β-葡糖苷酶的VDAG_00134和编码vacuole morphology and inheritance protein 的 VDAG_09430(表 3)。
3 讨论
大丽轮枝菌VdLs.17和JR2菌株的全基因组测序和注释信息的公布极大的促进了该菌致病相关基因的研究工作。利用T-DNA突变体插入位点的侧翼序列与这2个菌株的全基因组序列进行比对可以快速获得T-DNA在基因组上的插入位置和相关基因的信息,加速了功能基因的验证进程,有利于进一步阐明大丽轮枝菌的致病分子机理。
虽然利用T-DNA突变体库来筛选鉴定大丽轮枝菌的致病相关基因已有不少报道,如刘义杰等[20]从800个突变体中筛选到25个致病力显著下降的单拷贝插入的T-DNA突变体。谷素静等[21]筛选到3个致病力显著下降的突变体,其中2个突变体的微菌核产生严重受阻。但是本研究获得的致病相关基因与已报道的基因均不同,属于新发现的致病相关基因。通过与已公布的大丽轮枝菌基因组信息进行比对,发现只有5个基因有相关的注释信息。其中突变体M 11H11破坏的VDAG_09430基因编码1个参与囊泡形成的蛋白,可能参与磷酸肌醇信号转导途径的调控[22]。M 12B05突变体中T-DNA位于VDAG_04094基因上游的启动子区,可能影响该基因的正常表达。VDAG_04094编码1个SUA5蛋白,它在酵母中的同源蛋白可以通过结合dsRNA影响核糖体的翻译并影响酵母的正常生长。突变体M 13H08可能影响了VDAG_01087基因的正常表达,该基因编码DNA修复相关核酸外切酶rad1,其在酵母中的同源蛋白在细胞的减数分裂过程中发挥重要作用。突变体M 11D07可能影响了VDAG_00134基因的正常表达,该基因编码1个具有分泌信号肽的葡聚糖苷酶,推测其可能在大丽轮枝菌侵入早期降解寄主细胞壁的过程中发挥作用;但是由于该突变体的T-DNA是双拷贝插入,所以该突变体在棉花上的致病力降低是由1个基因引起的还是2个基因同时作用的结果还需要进一步通过敲除互补实验来验证。
就T-DNA的插入位置而言,本研究中获得的 突 变 体 M 12B05,M 13H08和 M 13H10的T-DNA都是插在了3个基因上游的启动子区,可能间接导致了T-DNA插入点下游的基因不能正常转录;而突变体M 11D07和M 13E01的T-DNA可能破坏了相关基因3′端的非编码区从而间接影响T-DNA插入点上游基因的正常转录或者翻译过程;其余突变体的T-DNA则插在了相关基因的外显子上,直接破坏了相应基因的正常表达。就T-DNA的插入位点分布而言,9个致病缺陷型突变体的T-DNA的插入位点随机分布于大丽轮枝菌8条染色体中的5条。
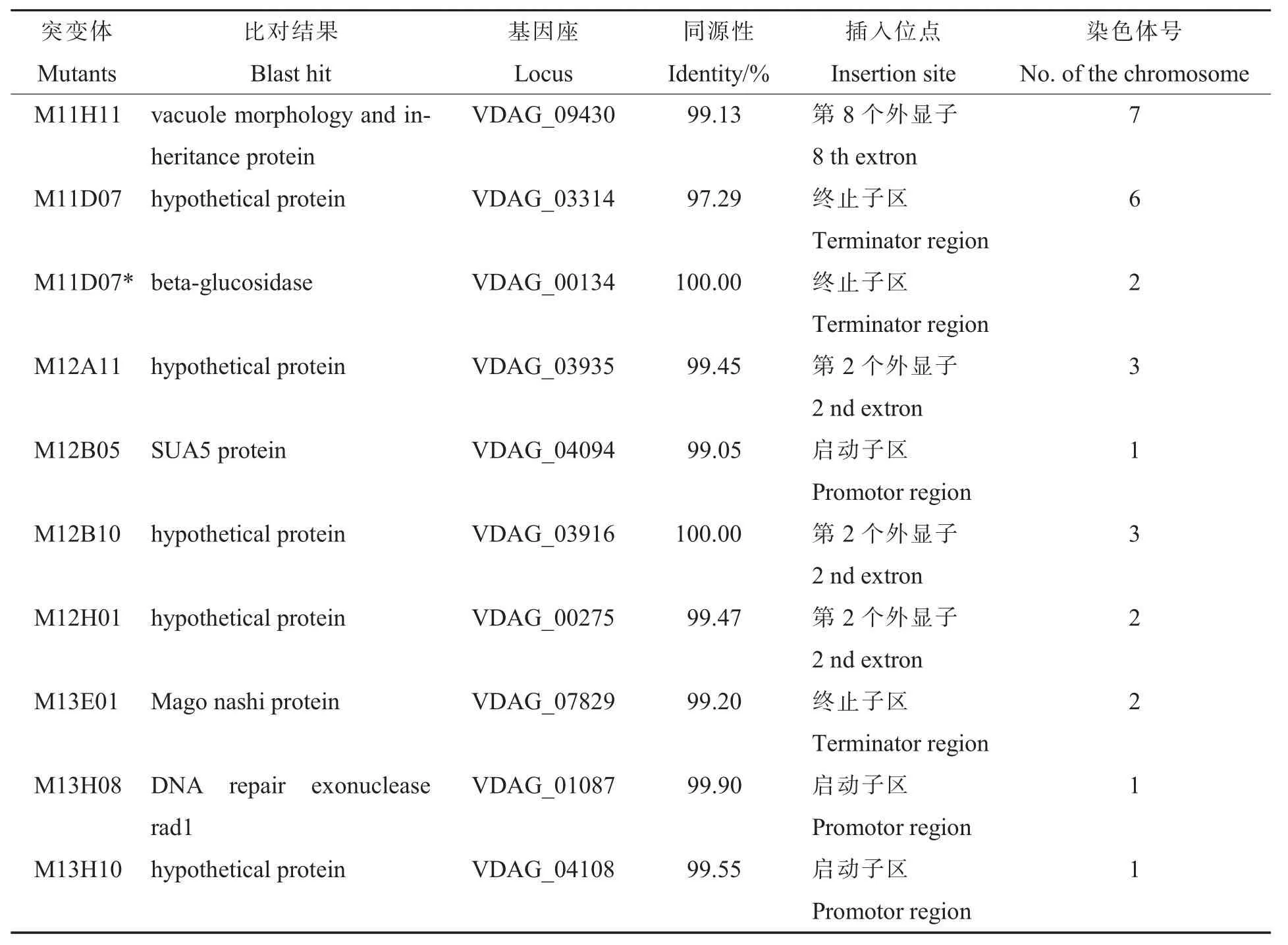
表3致病缺陷型T-DNA突变体插入位点侧翼序列分析Table 3 Sequence analysis of T-DNA flanking regions of V.dahliae pathogenicity defective mutants
4 结论
由于T-DNA插入的随机性,通过对大丽轮枝菌致病缺陷性T-DNA突变体的筛选和侧翼序列分析使得在基因组范围内大规模的开展大丽轮枝菌致病相关基因的功能研究成为了可能,极大的促进了大丽轮枝菌的致病分子机制等研究,为进一步培育抗病棉花品种奠定了基础。
[1]简桂良,邹亚飞,马存.棉花黄萎病连年流行的原因及对策[J].中国棉花,2003,30(3):13-14.Jian Guiliang,Zou Yafei,Ma Cun.The reason of the prevalence of Verticillium wilt of cotton in consecutive years and the corresponding countermeasures[J].China Cotton,2003,30(3):13-14.
[2]Klosterman S J,Atallah Z K,Vallad G E,et al.Diversity,pathogenicity,and management of Verticillium species[J].Annual Review of Phytopathology,2009,47(1):39-62.
[3]赵凤轩,戴小枫.棉花黄萎病菌的侵染过程[J].基因组学与应用生物学,2009,28(4):786-792.Zhao Fengxuan,Dai Xiaofeng.Infection process of Verticillium dahliae K leb.in Cotton[J].Genomics and Applied Biology,2009,28(4):786-792.
[4]朱荷琴,冯自力,尹志新,等.我国棉花黄萎病菌致病力分化及ISSR指纹分析[J].植物病理学报,2012,42(3):225-235.Pathogenicity differentiation and ISSR fingerprint analysis of cotton Verticillium dahliae in China[J].Acta Phytopathologica Sinica,2012,42(3):225-235.
[5]朱荷琴,冯自力,李志芳,等.分离自棉花的轮枝菌“种”的鉴定[J].中国农业科学,2013,46(10):2032-2040.Zhu Heqin,Feng Zili,Li Zhifang,et al.Identification of isolates of Verticillium species from cotton[J].Scientia Agriculture Sinica,2013,46(10):2032-2040.
[6]O'Donnell K,Cigelnik E,Weber N S,et al.Phylogenetic relationships among ascomycetous truffles and the true and false morels inferred from 18S and 28S ribosomal DNA sequence analysis[J].Mycologia,1997,89(1):48-65.
[7]Frandin E F,Thomma B P H J.Physiology and molecular aspects of Verticillium wilt diseases caused by V.dahliae and V.alboatrum[J].Molecular Plant Pathology,2006,7(2):71-86.
[8]Pegg G F,Brady B L.Verticillium wilts[M].Walling ford,UK:CABI Publishing,2002.
[9]M ishra N C,Tatum E L.Non-mendelian inheritance of DNA-induced inositol independence in Neurospora[J].Proceedings of the National Academy of Sciences of the United States of America,1973,70(12):3875-3879.
[10]Mullins E D,Chen X,Romaine P,et al.Agrobacterium-mediated transformation of Fusarium oxysporum:An efficient tool for insertional mutagenesis and gene transfer[J].Phytopathology,2001,91(2):173-180.
[11]Chen X L,Yang J,Peng Y L.Large-scale insertional mutagenesis in Magnapor the oryzae by Agrobacterium tumefaciens-mediated transformation[M]//Xu J R,Bluhm B.Fungal Genom ics.New York:Humana Press,2011:213-224.
[12]Maruthachalam K,Klosterman S J,Kang S,et al.Identification of pathogenicity-related genes in the vascular wilt fungus Verticillium dahliae by Agrobacterium tumefaciens-mediated T-DNA insertional mutagenesis[J].Molecular Biotechnology,2011,49(3):209-221.
[13]Zhang D,Wang X,Chen J,et al.Identification and characterization of a pathogenicity-related gene VdCYP1 from Verticillium dahliae[J].Scientific Reports,2016,6:27979.
[14]李彩红,李志芳,冯自力,等.棉花黄萎病菌致病相关基因VdMFS1敲除载体的构建[J].中国棉花,2013,40(1):7-12.Li Caihong,Li Zhifang,Feng Zili,et al.The construction of pathogenicity-related gene VdMFS1 replacement vector of Verticillium dahliae[J].China Cotton,2013,40(1):7-12.
[15]汪佳妮.大丽轮枝菌Vd991 T-DNA插入变体库的构建及致病相关基因的筛选[D].北京:中国农业科学院,2011.Wang Jiani.Verticillium dahliae Kleb.(Vd991)T-DNA mutant library construction and screening of pathogenic-related genes[D].Beijing:Chinese Academy of Agricultural Sciences,2011.
[16]王新艳,张丹丹,桂月晶,等.大丽轮枝菌致病性相关突变体快速筛选体系的建立[J].中国农业科学,2015,48(14):2747-2756.Wang Xinyan,Zhang Dandan,Gui Yuejing,et al.Construction of a rapid screening system of pathogenicity-related mutants in Verticillium dahliae[J].Scientia Agricultura Sinica,2015,48(14):2747-2756.
[17]朱荷琴,冯自力,李志芳,等.蛭石沙土无底纸钵定量蘸菌液法鉴定棉花品种(系)的抗黄萎病性[J].中国棉花,2010,37(12):15-17.Zhu Heqin,Feng Zili,Li Zhifang,et al.Evaluating cotton varieties resistant to Verticillium wilt using root-dip method in a bow l without bottom[J].China Cotton,2010,37(12):15-17.
[18]Dobinson K F,Lecom te N,Lazarovits G.Production of an extracellular trypsin-like protease by the fungal plant pathogen[J].Canadian Journal of Microbiology,1997,43(3):227-233.
[19]Liu Y G,Chen Y.High-efficiency thermal asymmetric interlaced PCR for amplification of unknown flanking sequences[J].Biotechniques,2007,43(5):649-650.
[20]刘义杰,李志芳,冯自力,等.棉花黄萎病菌低致病力突变体的表型分析及致病相关基因克隆[J].植物病理学报,2015,45(3):258-269.Liu Yijie,Li Zhifang,Feng Zili,Zhao et al.Phenotypic analysis of low virulent Verticillium dahliae mutant on cotton and cloning of pathogenicity related genes[J].Acta Phytopathologica Sinica,2015,45(3):258-269.
[21]谷素静,汪敏,桑茜,等.棉花黄萎病菌T-DNA插入突变体库的构建及致病缺陷突变体筛选[J].河南农业科学,2014,43(1):69-83.Gu Sujing,Wang M in,Sang Xi,et al.Construction of T-DNA insertional mutant library for Verticillium dahliae and identification of pathogenicity defective mutants[J].Journal of Henan Agricultural Sciences,2014,43(1):69-83.
[22]Sbrissa D,Ikonomov O C,Fenner H,et al.ArPIK fyve homomeric and heteromeric interactions scaffold PIK fyve and Sac3 in a complex to promote PIKfyve activity and functionality[J].Journal of Molecular Biology,2008,384(4):766-779.

