海洋产黑色素假交替单胞菌XH2的筛选及培养条件优化
窦旖君,薛永常
(大连工业大学 生物工程学院,辽宁 大连 116034)
黑色素是一种广泛存在于动植物及微生物中由酚类化合物聚合而成的多功能复杂多聚体,有真黑素、棕黑素、异黑素和类黑素4种不同类型[1],可作为生化反应的介质[2]、温度调节以及金属螯合[3-4],还可作为生物反应无定形的半导体以及农业生物杀虫剂的光保护剂,具有抗紫外辐射、清除自由基、阻止心磷脂脂质体氧化等功能,从而提高生物体的生存与竞争能力。同时还被作为新型天然药物等进行研究和利用[5-7]。微生物产天然色素大多无毒无害,除了保留许多对人体有益的保健成分,还可以作为新的保健品[8],很早就有微生物产黑色素菌株及关键酶等方面的研究[9-12],黑色素在生物防御方面也有一定的作用[13],Fana等[14]在传统苯丙氨酸途径基础上发现了一个新的黑色素合成途径,为探讨黑色素生物合成提供一条新思路。在黑色素合成的关键酶中,酪氨酸酶起到了关键作用,可催化酪氨酸形成L-多巴,进而由异聚体复合生成多种黑色素[15],对黑色素高产菌株SC-1酪氨酸酶基因的分子改造可大幅提高黑色素产量[16],因此,酪氨酸酶基因表达的研究对于研究黑色素的生物合成具有广阔的前景[17]。本研究从大连星海湾海域的海泥和海水分离出1株黑色素产量较高的XH2,对其生理生化特性及16S rDNA进行了鉴定,并优化其生长条件,为后续该菌株相关黑色素合成关键酶基因的进一步研究提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种来源 采集大连市星海湾海域退潮后的海滩或潮间带深处的海泥、海水。
1.1.2 培养基 ①筛选培养基[5]:海水2216E培养基:蛋白胨5 g,酵母膏1 g,FePO40.1 g,琼脂 20 g,陈海水1 L,pH 7.2~7.6;②L-Tyr发酵培养基[10]:葡萄糖1 g,蛋白胨5 g,NaCl 5 g,CaCl20.1 g,L-酪氨酸1 g,用海水定容至1 L,pH 7.2。固体培养基加琼脂粉20 g,pH 7.2。
1.1.3 主要仪器和试剂Dzup基因组抽提试剂盒(生工公司),16S rDNA引物(华大基因),TaqDNA polymerase、dNTPs Mix、10×buffer(宝生物公司(大连)),其余试剂均为国产分析纯。Chemi System UVP Bio-imaging System凝胶成像系统(美国UVP公司),TaKaRa PCR Thermal Cycler Dice(日本TaKaRa公司),DYY-2C型电泳仪(北京市六一仪器厂),V-1100D分光光度计(上海美谱达)。
1.2 方法
1.2.1 菌株筛选与分离 采集的海泥、海水经梯度稀释,均匀涂布于2216E固体培养基,28 ℃恒温培养2~3 d,选取黑色菌落并多次分离纯化获得单菌落。将得到的单菌落接在L-Tyr固体培养基中,比较产黑色素生长情况。
1.2.2 菌株形态及生理生化鉴定 将菌株在2216E培养基上划线培养,取单菌落,在显微镜下观察菌落大小、形态、颜色等特征,采用革兰染色法在显微镜下观察菌体形态。根据《伯杰氏细菌鉴定手册》[18-19]对该菌种进行糖发酵试验、氧化发酵试验,过氧化氢酶、明胶酶、淀粉酶、柠檬酸盐利用等实验。
1.2.3 不同生长条件对菌株生长及产黑色素的影响 将活化后的菌液以1%(体积分数)接种于L-Tyr发酵培养基中,180 r/min振荡48 h,测菌液OD600值。取上清液测OD400[6,20]值考察不同温度、NaCl浓度、酪氨酸含量、CaCl2含量对菌株生长和产黑色素的影响,并确定最佳生长条件。然后将活化后的菌液以1%的接种量接种于调整后的L-Tyr发酵培养基中,180 r/min振荡48 h,测定菌液OD600值,每隔3 h取1次样,记录数据并绘制菌株生长曲线,分析菌株生长特性。
1.2.4 黑色素的制备及溶解性质研究 黑色素的提取[21-22]:发酵液过滤除去菌体,用1 mol/L NaOH调pH至12,121 ℃高压处理20 min,5 000 g离心5 min,上清液用1 mol/L HCl调pH至2,沉淀过夜;12 000 g离心20 min,沉淀用pH为12的去离子水重悬,离心后烘干称重[5]。然后取相同质量已烘干的黑色素样品置于盛有等量去离子水、NaOH、HCl、有机溶剂(分别装有乙醇、苯酚、二甲苯、氯仿)的试管中,充分混匀,观察其溶解性。
1.2.5 酪氨酸酶测定 酪氨酸酶提取及测定参考文献[23-24]。①XH2粗酶液的制备:发酵菌液在4 ℃、10 000 g离心,菌体用100 mmol/L Tris-HCl缓冲液洗涤2次。将菌悬液的离心管置于冰浴中,超声波破碎。离心收集上清液,用于测定酶活和蛋白浓度。②酶活测定:取一定量粗酶液用0.10 mol/L的磷酸缓冲液(pH=7.2)稀释,取0.1 mL稀释液于10 mL比色管中,加入2.5 mL 0.10 mol/L的磷酸缓冲溶液(pH=6.0),再加入2 mL浓度为0.10 mol/L多巴溶液,开始计时,测定OD480值。前6 min内每分钟测1次OD值,以后隔2 min测1次,直至OD值不变为止。分别取0.2、0.3、0.4 mL已稀释提取液重复上述实验(总体积为5 mL)。 以OD值对时间作图得出酶活与时间的线性回归方程,由公式a=ΔA/(ktV)×10-6(a为所用溶液的酶的活性,ΔA为最大吸收波长吸光度的变化,t为时间(min),k为多巴红的摩尔吸收系数,V为加入酶的体积(mL)),A=aV/V0(A为原料总酶活,V0为粗酶液总质量(g)),计算酶活性。
1.2.6 产黑色素菌株的16S rDNA分子生物学鉴定 利用试剂盒提取XH2基因组DNA,利用细菌16S rDNA基因序列的通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)扩增基因组的16S rDNA序列。扩增产物由北京华大基因技术公司进行序列测定。将获得的测序结果进行拼接,NCBI在线Blast,进行序列比对和相似性分析。
2 结果与分析
2.1 菌株形态鉴定
利用2216E培养基分离出多株产黑色素菌株。其中菌株XH2分泌黑色素较快,在培养初期为透明或淡黑褐色,菌落表面平滑,单菌落较小,培养36 h后,可观察到明显黑色素产生,且所产出的黑色素可分泌到培养基中呈黑褐色;该菌在2216E培养基中即可合成黑色素,而在含有L-Tyr的发酵培养基中产黑色素状态明显好于2216E培养基(图1),说明L-Tyr对XH2产黑色素有促进作用。

图1 XH2在2216E(A)和L-Tyr发酵培养基(B)中的生长和产黑色素情况Fig.1 Strain XH2 growth and production of melanin in 2216E(A) and L-Tyr fermentation media(B)
2.2 菌株生理生化鉴定
XH2的糖酵解等生理生化鉴定及显微镜观察的具体结果见表1。生理生化结果表明XH2为杆状革兰阴性菌,无芽胞和鞭毛,糖类转化能力较弱,主要碳源为葡萄糖,且在L-酪氨酸为底物的培养基中有产黑色素的能力,说明有酪氨酸酶参与黑色素的代谢[23],XH2基本生理生化实验结果与陈静等[25]筛选的假交替单胞菌CHS相似。

表1 XH2生理生化及形态观察结果Table 1 Physiological and biochemical characteristics of XH2
注:“+”为阳性反应(有现象);“-”为阴性反应(无现象)
2.3 培养条件对XH2生长及产黑色素的影响
2.3.1 温度 以1%的接种量将XH2菌液接入250 mL三角瓶中,180 r/min连续培养72 h,分别于15、20、25、28、37 ℃进行观察,OD600值反映菌株生长情况,OD400值可以反映菌株黑色素合成情况,结果见图2。综合OD600和产黑色素的情况,XH2在20 ℃时产黑色素情况最佳,37 ℃基本死亡,相较于朱琳等[26]筛选出的最适生长温度为37 ℃的菌株,XH2培养温度范围更适宜实际操作。

图2 温度对XH2生长及产黑色素情况的影响
2.3.2 pH值 在相同条件下,分别调整培养基的pH为4、5、6、7、8、9、10,180 r/min连续培养72 h,观察其产黑色素情况,结果见图3。由图3可见,XH2在pH值为7时生长状况和产黑色素情况最好,酸性条件抑制菌株生长,菌株更适宜在弱碱性环境中生长,适宜后期处理工作。

图3 不同pH对XH2的生长及产黑色素情况影响Fig.3 Effect of different pH on the growth and the production of Melanin of XH2
2.3.3 NaCl含量 相同条件下,在L-酪氨酸发酵培养基中分别添加质量分数为0、0.5%、1%、1.5%、2%、3%、4%、5%、6%的NaCl,180 r/min连续培养72 h,产黑色素结果见图4。由图4可见,XH2在NaCl含量为0.5%~3%的海水培养基中生长状况良好,由于海洋菌特性,在不含海水及NaCl的培养基中,XH2无法生长。XH2生长最适NaCl浓度为0.5%,最适产黑色素浓度为1%。浓度过高,细胞形态受到破坏,生长和产黑色素情况受到抑制,XH2生长无需过高浓度,不同于已筛选的海洋菌株QJNY82[6]需要增加大量盐分。
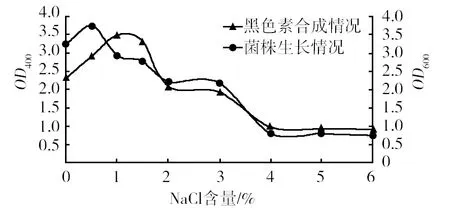
图4 不同NaCl含量对XH2生长及产黑色素情况的影响Fig.4 Effect of different NaCl concentration on the growth and the production of Melanin of XH2
2.3.4 L-Tyr含量 相同条件下,在L-酪氨酸发酵培养基中分别添加质量浓度为0、0.5、1.0、1.5、2.0、2.5 g/L的L-Tyr,180 r/min连续培养72 h,结果见图5。
XH2在L-酪氨酸质量浓度为0.5 g/L时,产黑色素能力最佳,在1 g/L时菌株生长状态最佳,当培养基中L-酪氨酸质量浓度大于1 g/L时,出现不溶现象,给菌株生长造成一定影响。L-酪氨酸的适当添加可明显提高菌株黑色素的产量[6],由于蛋白胨也含有少量游离的酪氨酸[5],菌株在培养基不添加酪氨酸的条件下也可产黑色素。但在不含蛋白胨的培养基中,菌株生长状态不佳,而且没有黑色素产生。因此可以证明,XH2黑色素的产生需要L-酪氨酸作为底物诱导。证明了XH2黑色素合成过程中有酪氨酸酶的参与[26]。

图5 L-Tyr含量对XH2生长及产黑色素情况的影响Fig.5 Effect of L-Tyr on the Growth and the Production of Melanin of XH2
2.3.5 CaCl2含量 相同条件下,在L-酪氨酸发酵培养基中分别添加质量浓度为0、0.1、0.15、0.2、0.3、0.4 g/L的CaCl2,180 r/min连续培养72 h,结果见图6。图6表明,CaCl2质量浓度在0.1 g/L时,XH2生长状态最佳,当质量浓度过高时,会改变细胞膜通透性,菌株生长状态不佳。

图6 CaCl2含量对XH2生长及产黑色素情况的影响Fig.6 Effect of CaCl2 content on the growth and the production of melanin of XH2
2.4 菌株生长曲线及产黑色素情况的测定
采用产黑色素最佳条件培养XH2,20 ℃、180 r/min培养72 h,测OD600值。发酵培养基为葡萄糖1 g、蛋白胨5 g、NaCl 10 g、CaCl20.1 g、L-Tyr 0.5 g、陈海水1 L,pH 7.0。时间对其生长及产黑色素影响见图7、8。

图7 XH2生长曲线Fig.7 Growth curve of XH2

图8 培养时间对XH2黑色素产量的影响Fig.8 Effect of culture time on the yield of XH2 melanin
从图7可以看出,XH2是1株生长周期较长的菌株。0~3 h处于延迟期,菌株生长缓慢;3~24 h处于对数期,菌株数量呈对数增加,菌株繁殖迅速;从27 h开始,菌株增长速度减慢,处于恒定期,这一阶段一直延续到72 h,菌株繁殖速度稳定,增长迟缓,无明显下降趋势。从图8可以看出,黑色素从菌株生长的6~8 h开始生成,并随菌株生长状态逐渐累积,有两个大量增长的阶段,分别是菌株对数生长期及后期菌株生长稳定期的积累,且与OD400值呈一定的正相关关系。优化后的培养基连续培养72 h,产黑色素量为1.164 g/L,相较于优化前不添加酪氨酸时的0.441 g/L,产量大约提高了2.6倍,说明添加适量L-酪氨酸可以大大提高黑色素的产量。对XH2产黑色素发酵条件的优化可以提高XH2黑色素的产量,说明XH2是1株性状优良且适宜在工业生产中应用的菌株。
2.5 XH2所产黑色素的溶解性测定
取1 g烘干的黑色素样品,分别置于各盛有1 mL去离子水、NaOH、HCl及有机溶剂(分别为乙醇、苯酚、二甲苯、氯仿)的试管中,充分混匀,结果见表2。

表2 XH2产黑色素溶解性结果Table 2 Solubility of XH2 produced melanin
注:“+”为溶解;“-”为不溶解
从表2可以看出,XH2所产黑色素不溶于酸性环境和有机溶剂,在碱性环境下可以溶解。
2.6 酪氨酸酶活性测定
由培养基中酪氨酸含量优化结果可以验证XH2代谢过程中有酪氨酸酶的参与,测得的不同酶液加入量和不同反应时间的关系见图9、10。
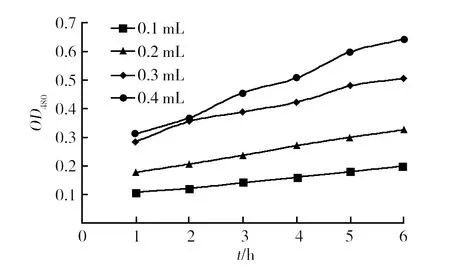
图9 前六分钟吸光度随时间变化情况Fig.9 The change situation of absorbancy with time for first six minutes

图10 吸光度随时间变化情况Fig.10 The change situation of absorbancy with time
可见前6 min的变化基本趋于直线,所得酶的动力学方程如下:y1=0.019k1+0.084 3,y2=0.030 1k2+0.145 9,y3=0.436k3+0.252,y4=0.397k4+0.285 6。计算出的酶活结果见表3。

表3 提取液和原料中酶的活性Table 3 The data of enzyme activity in the extract and materials
2.7 XH2菌株的16S rDNA扩增及测序结果分析
以XH2的基因组DNA为模板,利用16S rDNA通用引物进行PCR扩增,扩增产物经0.8%琼脂糖凝胶电泳,能够清晰观察到1条1 500 bp左右的条带,与预期大小基本一致(图11)。
扩增产物经双向测序后经拼接得知扩增的序列长度为1 400 bp。将该序列在NCBI上进行Blast比对,结果显示XH2与假交替单胞菌属(Pseudoalteromonassp.)亲缘关系比较接近。
选取几个相似序列构建进化树,结果表明XH2的16S rDNA与Pseudoalteromonassp.S-2 rRNA基因序列相似度达99%,综合2.2的生理生化鉴定,参考《伯杰氏细菌鉴定手册》[18],确定XH2属于假交替单胞菌属(Pseudoalteromonassp.)(图12)。

图11 产黑色素菌株XH2的16S rDNA扩增图Fig.11 Agrose gel electrophoresis analysis of strain XH2 16S rDNA AmplifyM:DNAmarker D2000

图12 基于XH2 16S rDNA序列构建的系统发育树Fig.12 Phylogenetic tree based on XH2 16S rDNA sequence
3 讨 论
本研究从大连星海海域筛选出1株产黑色素菌株XH2,通过单因素实验,测定了XH2的生长曲线及黑色素随时间的增长量。证明L-酪氨酸对于细菌产黑色素影响十分关键,L-酪氨酸的添加能够明显提高菌株黑色素产量,其主要原因是酪氨酸酶可以催化L-酪氨酸转化为L-多巴并生成黑色素。测定了XH2菌株发酵液中的酪氨酸酶活性,验证了酪氨酸酶参与细胞产黑色素,根据生理生化鉴定结果和16S rDNA序列比对结果,确定XH2属于假交替单胞菌属(Pseudoalteromonassp.)。
目前,对于天然产黑色素菌株的研究日益增多,但对于产黑色素海洋假交替单胞菌产黑色素菌株的研究还比较少,XH2的发现为这一研究提供了新的研究对象。如果针对XH2产黑色素的酪氨酸酶基因进行操作,从分子水平上发掘出新的提高黑色素合成的方法,应用到食品及化工产品加工行业,将有积极作用。

