1株高效菲降解不动杆菌的筛选、鉴定及性能研究
马 丹,王永刚,2*,陈吉祥,杨 智,孙尚琛,,李文新
(1.兰州理工大学 石油化工学院,甘肃 兰州 730050;2.兰州理工大学 生命科学与工程学院,甘肃 兰州 730050;3.兰州石化能源装备工程研究院有限公司,甘肃 兰州 730000)
多环芳烃是一类广泛分布并稳定存在于自然环境中的含2个或2个以上苯环的有毒有机污染物。菲为一种三环芳烃,是石油和煤炭加工工业的副产品,也是土壤沉积物中最常见的一类多环芳烃污染物[1]。菲具有致癌性、致畸性、致突变性、生物累积性以及内分泌扰乱等特性,对人体健康和自然环境有极大危害。微生物可以通过自身的代谢将多环芳烃进行分解转化,从而降低多环芳烃对生态环境的污染。目前采用微生物去除多环芳烃的方法是最常见的途径之一[2-4]。研究较为广泛的可降解菲的菌属主要有芽胞杆菌属(Bacillus)[5-6]、气单胞菌属(Aeromonas)[7]、假单胞菌属(Pseudomonas)[8]、鞘氨醇单胞菌属(Sphingomonas)[9-10]和根瘤菌[11]等。而约翰逊不动杆菌属细菌的研究主要集中在对处理污水和污物中的氮磷化合物,对外界不利条件的抵抗能力以及耐药性和耐药机制等方面。其中研究最深入的是其聚磷与解磷特性及其机制[12-13]。Li等[4]在低温中筛选出1株可以以柠檬酸钠和乙酸钠等为唯一碳源的约翰逊不动杆菌,该菌株呈现出较高的亚硝酸盐积累效率和较低的硝酸盐移除效率。约翰逊不动杆菌还具有较普遍的耐药性[15]。Wang等[16]从土壤中筛选出1株能产脂肪酶的约翰逊不动杆菌。苏丹等[17]以约翰逊不动杆菌DBP-3菌株为研究对象,对其冷休克蛋白基因进行了克隆及表达。在环境领域内关于约翰逊不动杆菌对多环芳烃菲降解机制和应用鲜有报道。有部分报道主要是不动杆菌属细菌对其他烃类化合物的降解。刘玉华等[18]概述了不动杆菌属细菌对烷烃、芳香烃等石油组分的降解。周婷等[19]筛选出2株不动杆菌,并对菌株的石油降解功能进行研究,而该菌株能够利用一定浓度的烷烃以及多环芳烃进行生长。本研究从兰州某化工厂石油废水中分离筛选出1株不动杆菌属的高效菲降解菌,并对该菌株的生长特性、降解特性、降解动力学、菲的相关降解基因及参与菲代谢关键酶酶活进行了研究,以期为菲及其他多环芳烃的生物处理提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株来源 菌株F-1分离自兰州某化工厂含油废水的污染水样。
1.1.2 培养基 ①LB固体培养基:酵母粉 2.5 g,蛋白胨 5 g,NaCl 5 g,琼脂 10 g,蒸馏水 1 000 mL,pH 7.0,1×105Pa灭菌20 min。②液体培养基:酵母粉 2.5 g,蛋白胨 5 g,NaCl 5 g,蒸馏水 1 000 mL,pH 7.0,121 ℃灭菌20 min。③基础培养基:NH4NO33 g,K2HPO41.5 g,KH2PO41.5 g,FeCl20.01 g,无水CaCl20.01 g,MgSO4·7H2O 0.1 g,NaCl 0.5 g,蒸馏水 1 000 mL,pH 7.0,1×105Pa灭菌20 min。④筛选培养基:不同浓度菲为唯一碳源的基础培养基。
1.1.3 试剂和仪器 菲(纯度≥97%,天津希恩思),环己烷、正己烷(色谱纯,天津市彪仕奇),其他试剂均为分析纯。无菌操作台(SW-CJ-2FD,苏州安泰),全自动高压灭菌锅 (280SA,致微仪器),恒温振荡器(IS-RDV1,美国精骐),紫外分光光度计(UV-2102PC,尤尼柯上海仪器),PCR扩增仪(TC-96/G/H,杭州博日)。
1.2 方法
1.2.1 菲降解菌的筛选 吸取1 mL水样于100 mL筛选培养基中,30 ℃、180 r/min振荡培养3 d后,从培养液中吸取1 mL置于新的筛选培养基中,重复3次。将最后一次的培养液涂布于固体筛选基础培养基上,30 ℃恒温过夜暗室培养后,采用划线分离法进行分离与纯化,-70 ℃冰箱保存备用。
1.2.2 降解菌株的鉴定 采用细菌DNA抽提试剂盒提取菌株基因组DNA,采用16S rDNA通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)与1492R(5′-GGTTACCTTGTTACGCTT-3′)进行PCR扩增。扩增条件:94 ℃ 5 min,94 ℃ 1 min,58 ℃ 1 min,72 ℃ 2 min,循环30次;72 ℃ 10 min。扩增结束后,产物经1.0%琼脂糖凝胶电泳检测后,将检测大小正确的PCR产物送至生工生物工程(上海)股份有限公司测序,测序结果提交NCBI/BLAST数据库进行比对分析,选取一致性在98%以上的近缘性物种,用MEGA 6.06软件按照邻接法(Neighbor-Joining)构建系统发育树,自展值为1 000。
1.2.3 菲降解菌生长特性 按2%接种量将菌株F-1接种于以菲(100 mg/L)为唯一碳源的基础培养基中,采用浊度法分别考察菌株F-1在不同温度(4、10、20、25、30、40和50 ℃)、不同pH值(2、3、4、5、6、7、8、9和10)、不同盐度(0%、0.3%、0.5%、1%、2%、3%、4%、5%、6%和7%)条件下的生长状况,震荡培养24 h后测定OD600值,确定菌株F-1的最适生长温度、pH和盐度。
1.2.4 菲降解菌降解特性 取F-1菌液转接到以菲(100 mg/L)为唯一碳源的基础培养基中,30 ℃、180 r/min振荡培养,在4、8、12、24、28、32、36、48、52、56 h对其进行取样涂平板计数,计算菌株在该培养基中生长数量。将菌株F-1分别接种于含有不同质量浓度菲(50、100、150、200、250、400、600、800 mg/L)为唯一碳源的基础培养基中,30 ℃、180 r/min震荡培养24 h后测定OD600值,确定其菲的耐受范围,并采用平板涂布法进行菌落计数。同时考察菌株F-1在以联苯、萘、蒽、菲、芘、直链烃(正癸烷、十二烷、十四烷、十六烷、十八烷、二十二烷、二十四烷和二十八烷)为唯一碳源的基础培养基中的降解特性。
1.2.5 菲的测定 以环己烷作溶剂,精确配置 0.5、1.0、1.5、2.0、2.5、3.0 mg/L菲的标准溶液,在波长为251 nm处用紫外分光光度计进行菲浓度的测定,绘制菲的标准曲线。同样采用环己烷萃取实验样品,多次萃取,合并萃取液,经无水硫酸钠脱水后,定容至50 mL,作为待测样品。并于251 nm波长处测定吸光度,根据标准曲线计算培养基中残留菲的浓度,从而计算降解率。
1.2.6 降解动力学研究 将多环芳烃菲的浓度随时间变化的趋势与零级、一级、二级动力学方程进行拟合,取相关系数高者为相应的反应级数。
零级降解动力学方程:c=-κt+c0(1)
t1/2=c0/(2κ) (2)
一级降解动力学方程:lnc=-κ1t+c0(3)
t1/2=ln2/κ1(4)
二级降解动力学方程: 1/c=κ2t+1/c0(5)
t1/2=1/(κ2·c0) (6)
式中:c为菲质量浓度(mg/L);t为降解时间(h);t1/2为降解半衰期(h);κ为零级降解速率常数;κ1为一级降解速率常数;κ2为二级降解速率常数。
1.2.7 菌株F-1对直链烷烃的GC-MS分析 分别称取正癸烷、十二烷、十四烷、十六烷、十八烷各3.75 g,二十二烷、二十四烷及二十八烷各1.25 g,用正己烷定容至25 mL,配制成正癸烷、十二烷、十四烷、十六烷、十八烷的终质量浓度为750 mg/L,二十二烷、二十四烷及二十八烷的终质量浓度为25 mg/L的混合液,每100 mL基础培养基中加入2 mL混合液,并接入2%的F-1菌液,30 ℃、180 r/min摇床培养3 d。采用正己烷萃取实验样品,多次萃取,合并萃取液,经无水硫酸钠脱水后,定容至50 mL。用GC-MS测定其降解率[20],十五烷作内标,在中国科学院兰州化学物理研究所完成。
1.2.8 芳烃降解基因的PCR检测 参考菌株AcinetobacterjohnsoniiXBB1基因序列(登录号为CP010350),选择与芳烃降解相关的邻苯二酚-1,2-双加氧酶、苯甲酸盐双加氧酶、铁氧化还原蛋白还原酶、乙醇脱氢酶、二羟酸脱水酶、醛缩酶和氧化还原蛋白基因进行PCR扩增。设计特异性引物见表1,反应条件同1.2.2。
1.2.9 邻苯二酚-1,2-双加氧酶活力的测定 将菌株F-1接种到液体LB培养基及菲质量浓度分别为50、100、150 mg/L的基础培养基中,过夜培养16 h,离心收集菌体,用磷酸缓冲液重悬。采用超声破碎仪在冰浴中进行破碎,8 500 r/min、4 ℃下离心30 min后取上清液(粗酶液)。石英比色皿中分别加入粗酶液(0.2 mL)、磷酸缓冲液(2.4 mL)和20 μmol/L邻苯二酚溶液(0.4 mL),37 ℃恒温水浴锅中反应30 min。在253 nm处测定光吸度值,计算光吸度增加值。酶活力单位(U)定义:37 ℃反应30 min条件下,每分钟内OD值变化0.001为1个酶活力单位(U)。
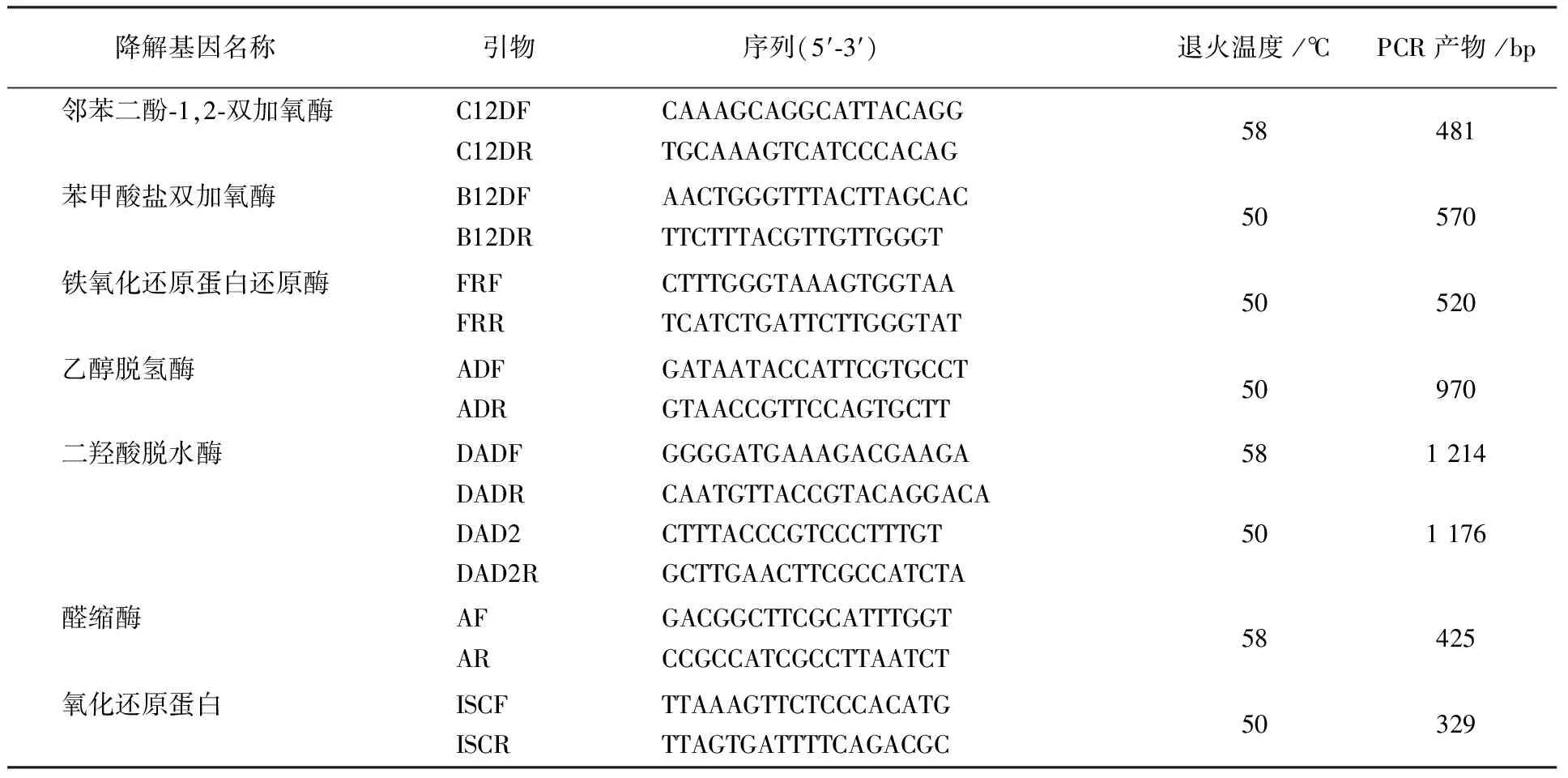
表1 菌株F-1降解基因检测引物Table 1 Primers for PCR detection of phenanthrene-degrading related genes
2 结果与分析
2.1 高效降解菲菌株筛选结果
采用筛选培养基从石油废水中共分离获得6株可以利用菲的菌株,分别编号为S-1、S-2、F-1、F-2、F-3、F-4。分别以2%的接种量接种到以菲(100 mg/L)为唯一碳源的基础培养基中,30 ℃、180 r/min振荡培养5 d后,菲的降解率如图1。其中菌株F-1降解菲的能力最强,降解率为43.57%。因此,将菌株F-1作为后续研究的主要对象。
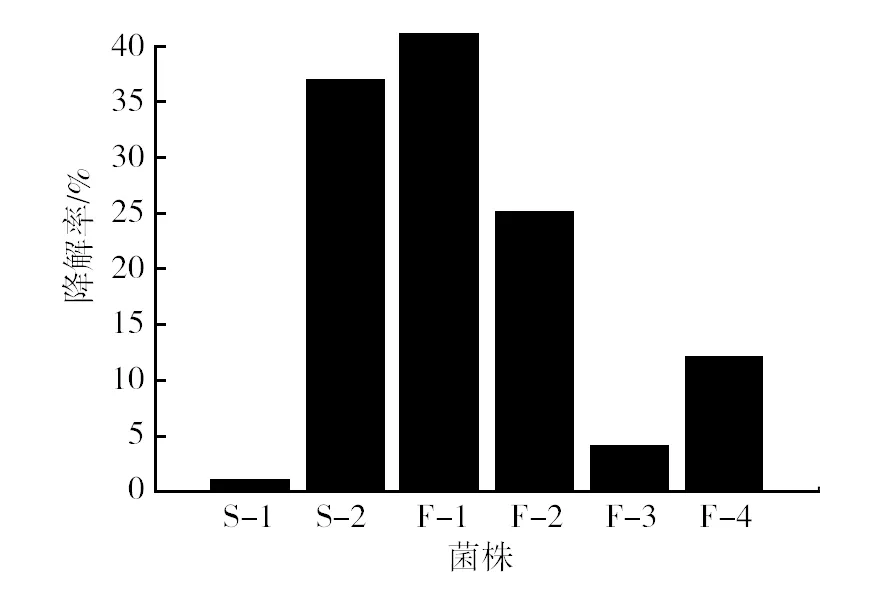
图1 不同菌株对菲的降解率Fig.1 Phenanthrene degradation rate of the different strains
2.2 菌株F-1的鉴定结果
菌株F-1在LB固体培养基上30 ℃过夜培养后,菌落呈乳白色,表面光滑,革兰染色结果显示为阴性细菌。菌株F-1部分生理生化特性结果见表2,该菌株除精氨酸、鸟氨酸、赖氨酸及尿素是阳性反应外,其余均为阴性反应。基于16S rDNA序列分析比对结果,采用邻接法构建系统发育树,如图2。从图2中可以看出,菌株F-1与约翰逊不动杆菌属细菌聚为一类,亲缘关系最近,与AcinetobacterjohnsoniiATCC 17909 16S rDNA序列一致性为100%。因此,结合菌落形态和生理生化实验结果进一步说明菌株F-1为约翰逊不动杆菌属。提交GenBank数据库,登录号为MF447530。

表2 菌株F-1部分生理生化特性Table 2 Biochemical tests performed on the strain F-1
注:“+”表示阳性反应;“-”表示阴性反应
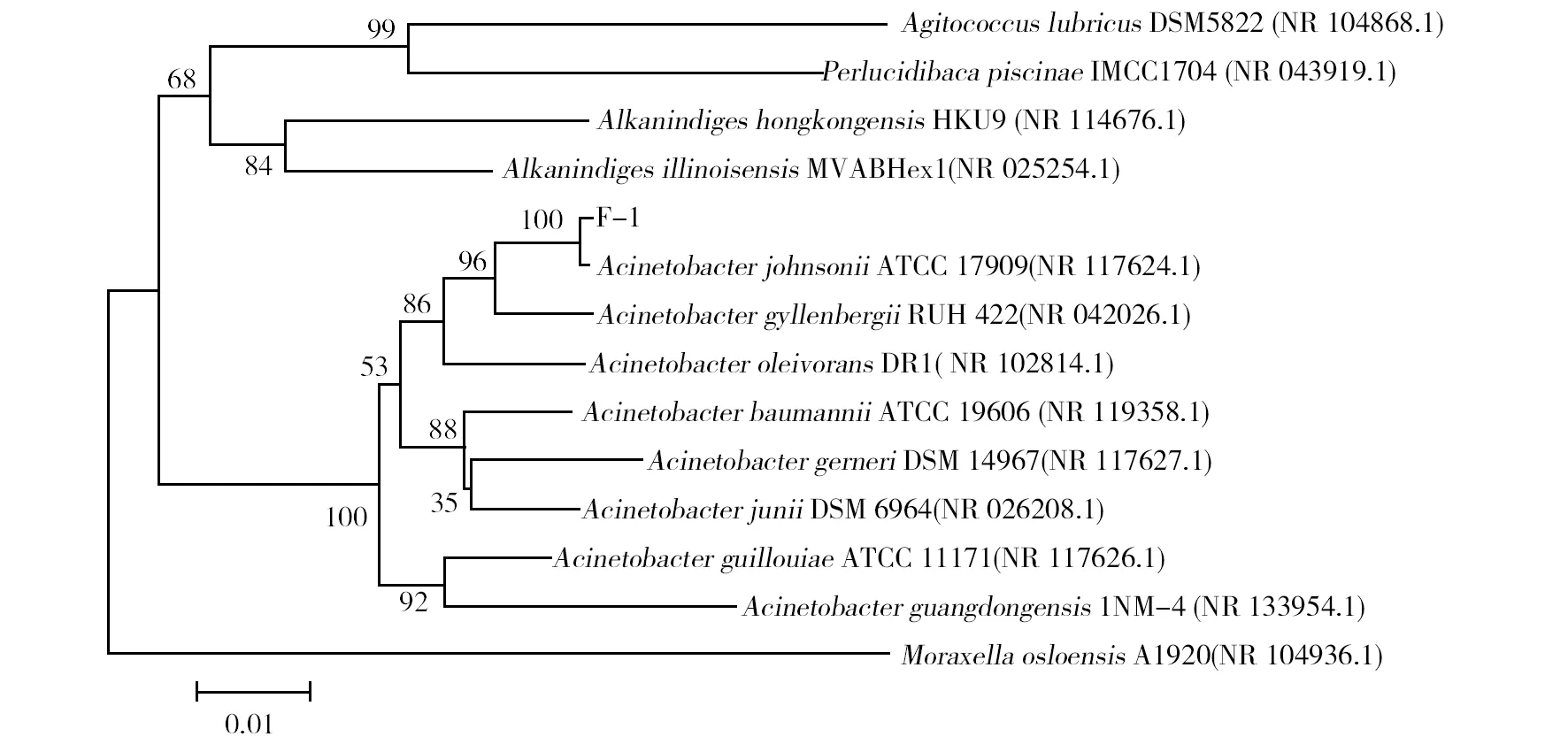
图2 菌株F-1系统进化树Fig.2 Phylogenetic tree of the bacteria F-1 based on the 16S rDNA sequences
2.3 菲降解菌F-1的生长特性
菌株F-1在不同pH、温度、初始浓度、盐度及时间的生长情况见图3。由图3A可知,菌株F-1在4~50 ℃范围内能正常生长。最适生长温度为30 ℃,生长速度最快;在低温(4~20 ℃)和高温(>50 ℃)条件下生长较为缓慢。图3B显示菌株 F-1在pH为5~9能够正常生长。最适pH为7,偏酸性;而在pH为2和10时几乎不能生长。图3C显示其最适盐度为0.3%,随着盐度升高,菌株生长情况逐渐降低,最大耐受盐浓度可达7%。图3D说明菌株F-1在菲初始质量浓度为250 mg/L时生长最好,在800 mg/L的质量浓度下依然可以生长,但生长微弱。可见,该菌株具有较好的环境适应性和较高菲浓度耐受性。
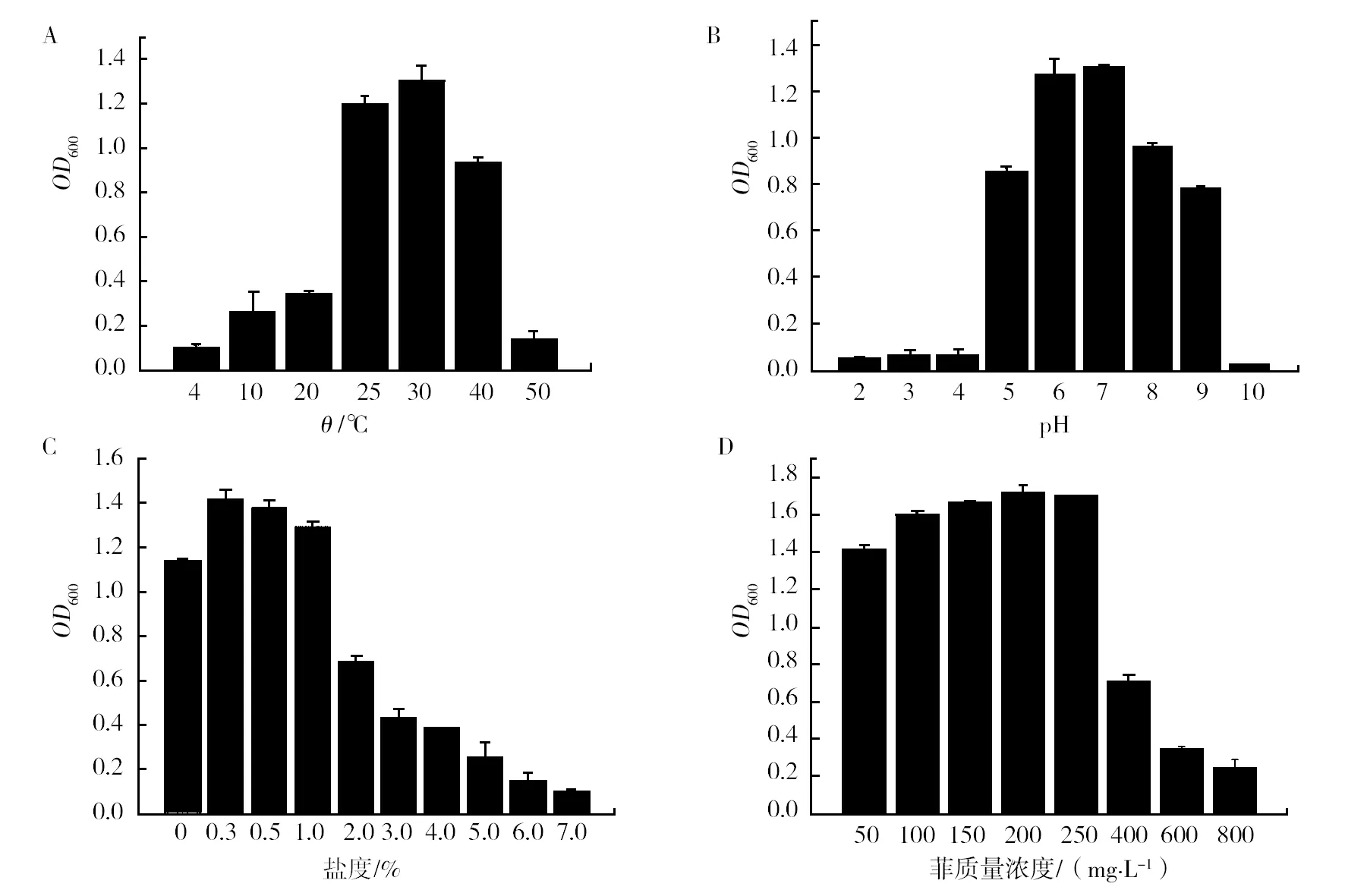
图3 菲降解菌生长特性Fig.3 Growth characteristics of the phenanthrene-degrading bacteria
2.4 降解动力学
分别将降解率与时间关系用零级、一级、二级动力学方程拟合[21-22],得到降解动力学拟合方程,结果如图4。降解半衰期分别为136.24、143.21和153.89 h。从图4中可以看出,二级方程拟合系数为0.986 75,线性相关性良好。在120 h内将菲的含量从100 mg/L降解到56.43 mg/L,降解率为43.57%。
2.5 菌株F-1对直链烷烃的GC-MS分析
菌株F-1在以菲(100 mg/L)为唯一碳源的培养基中生长情况见图5A,可见在12~24 h菌株生长情况最好,24 h后呈下降趋势。菌株F-1在不同芳烃中的生长情况见图5B,菌株F-1分别在联苯、萘、蒽、菲和芘(各终浓度均为100 mg/L)的基础培养基中生长24 h后,测得其在联苯以及菲中生长旺盛,但在萘、蒽和芘中的生长情况较差。采用GC-MS分析菌株F-1对直链烷烃正癸烷、十二烷、十四烷、十六烷、十八烷、二十二烷、二十四烷、二十八烷的降解效果,GC-MS检测如图5C、D,培养3 d后,正癸烷的降解率为25.3%,十二烷为10.2%,十四烷为11.6%,十六烷为15.6%,十八烷为27.4%,二十二烷为16%,二十四烷12%,二十八烷11%。由此可知,菌株F-1不仅可以高效的降解多环芳烃菲,对直链烷烃也有较好的降解效果。
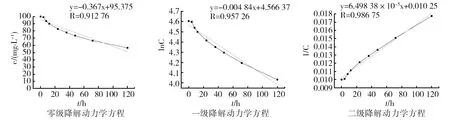
图4 菌株F-1对菲的降解动力学曲线Fig.4 Dynamics curve of the degradation of phenanthrene of strain F-1

图5 降解特性及菌株F-1降解直链烷烃的GC-MS分析Fig.5 GC-MS analysis of the straight-chain alkane by the Strain F-1
2.6 菲降解相关基因检测
微生物降解与代谢烃类化合物主要依赖于基因组多种功能性基因协作调控完成的。采用PCR特异性扩增从菌株F-1全基因组中检测到邻苯二酚-1,2-双加氧酶、苯甲酸盐双加氧酶、铁氧化还原蛋白还原酶、乙醇脱氢酶、二羟酸脱水酶、醛缩酶、氧化还原蛋白7种基因存在,电泳结果见图6。这些基因的存在进一步证明了菌株F-1具有降解菲以及其他烃类化合物的能力,具体基因之间如何协作调控还有待进一步研究。
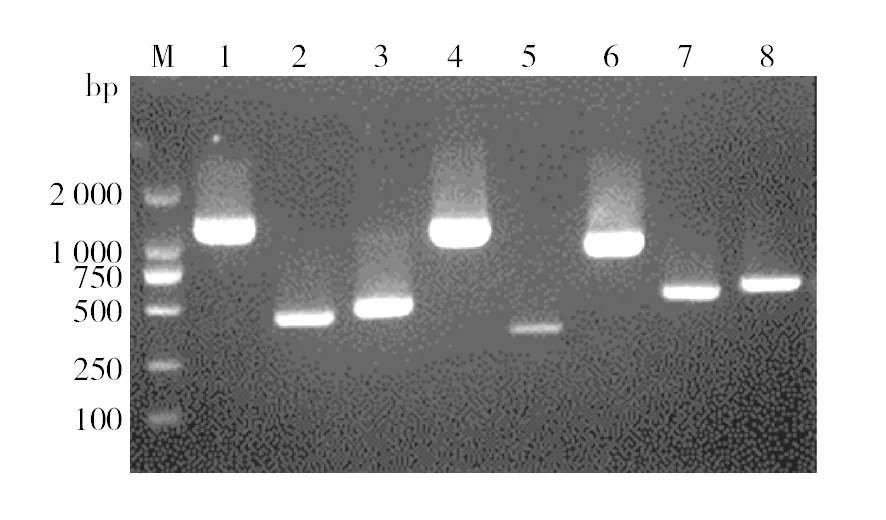
图6 菌株F-1降解基因PCR检测电泳图Fig.6 Electrophoresis of the phenanthrene-degrading genes of the strains F-1M: DNA Maker; 1、4: 二羟酸脱水酶DAD和DAD2; 2: 醛缩酶A; 3:邻苯二酚-1,2-双加氧酶C12D; 5: 氧化还原蛋白; 6: 乙醇脱氢酶AD; 7: 铁氧化还原蛋白还原酶FR; 8: 苯甲酸盐双加氧酶 B12DM: DNA Marker; 1,4: dihydroxy-acid dehydratase DAD&DAD2; 2: aldolase A; 3: catechol-1,2-dioxygenase C12D; 5: ferredoxin; 6: alcohol dehydrogenase AD; 7: ferredoxin reductase FR; 8: benzoate-1,2-dioxygenase B12D
2.7 邻苯二酚-1,2-双加氧酶活力
邻苯二酚-1,2-双加氧酶是参与多环芳烃降解的关键性酶[23]。分别将F1接种在含不同浓度菲为唯一碳源的培养基和LB培养基中,30 ℃、180 r/min培养16 h后,测定邻苯二酚-1,2-双加氧酶活力,结果见图7。由图7可知,随着培养基中菲浓度的升高,邻苯二酚-1,2-双加氧酶活力呈极显著性增加(P<0.01),而在LB培养基中培养菌株的酶活力仅为1.3 U。这可能是因为缺少了菲作为底物的诱导,使得邻苯二酚-1,2-双加氧酶在菌体中的组成型表达量减少,由此说明邻苯二酚-1,2-双加氧酶是环境诱导性酶,而且有研究表明,菲浓度与酶活力之间存在正相关关系[24-25],与本文研究结果一致。

图7 不同碳源和菲浓度中的酶活力Fig.7 Activity of catechol-1,2-dioxygenase under different phenanthrene concentrations and different source of carbon
3 讨 论
石油及化学加工业的快速发展,导致多环芳烃被带入环境,大面积的土壤及水源受到了威胁。由于多环芳烃在环境中的难降解性、致癌性、致畸性及致突变性,使其成为污染生态学研究的重点污染物。菲一直是科研人员在多环芳烃研究中的代表性污染物。因此,筛选出能有效降解菲的菌株更具应用价值。Janikowski等[26]实验表明鞘氨醇单胞菌属对菲的降解率在75 h达98 mg/(L·h) 。邓军等[27]从受多环芳烃污染的土壤中筛选出1株氧化节杆菲降解菌,在含菲的基础培养基(初始质量浓度为50 mg/L)5 d降解率可达60%。徐成斌等[28]从活性污泥中筛选出耳炎假单胞菌,培养96 h后降解率为65.8%。
大量研究表明,微生物对多环芳烃代谢主要通过各种芳烃加氧酶去除芳香环取代基和引入羟基,使芳香环打开后进一步降解。马迎飞等[29]从活性污泥中筛选出假单胞菌属,经PCR扩增和体外克隆获得双加氧酶基因。Meyer等[30]从废水以及土壤中分离出红球菌属和假单胞菌属两种菲降解菌,利用PCR技术检测出邻苯二酚双加氧酶。Chang-Hyun Chang等[31]从土壤中筛选出3株菲降解菌,通过PCR扩增检测出邻苯二酚2,3-双加氧酶。Taylo等[32]、Seo等[33]相继对PAHs降解菌的相关基因做了研究。而细菌对菲的降解主要有两个途径即水杨酸途径和邻苯二甲酸途径[34]。Robin等[35]筛选出1株分枝杆菌,能够降解多环芳烃(PAHs),验证该菌是通过邻苯二甲酸途径降解菲。何丽娟等[36]从石油污染土壤中分离到1株鞘氨醇杆菌属,对降解途径的初步研究显示,该菌株通过水杨酸途径降解菲。曹军伟等[37]从深海环境筛选出1株CeleribacterindicusP73,通过GC-MS联用技术鉴定出该菌降解菲的两个重要代谢产物为1-羟基-2-萘甲酸和1-萘酚。
多环芳烃由于自身稳定的环状结构以及较差的水溶性,使得其难以被微生物利用。多环芳烃污染的土壤中含有较高浓度的盐类物质,而盐浓度过高会抑制微生物的生长,从而影响微生物对多环芳烃的降解效率。微生物的生理活动也受环境pH值变化的影响,过高或过低的pH值都会影响微生物的生长及降解酶的活性,进而降低对多环芳烃的降解速率[38]。被多环芳烃严重污染的地区,因污染物浓度过高,微生物无法生存,导致污染物无法被有效降解。因此,进一步丰富多环芳烃降解微生物菌种库,阐明多环芳烃的降解机制是至关重要的。
本研究从石油废水中分离到1株以菲为唯一碳源生长的约翰逊不动杆菌属细菌F-1,该菌株有较强的环境适应能力,在25~40 ℃、pH值5.0~9.0、盐度0%~2.0%(质量分数)范围内良好生长。在30 ℃、pH 7.0、盐度0.3%(质量分数)、转速180 r/min条件下,培养5 d对菲(终质量浓度为100 mg/L)降解率为43.57%,降解过程符合一级动力学特征。同时能以联苯、萘、蒽、芘为唯一碳源良好生长。对直链烷烃正癸烷的降解率为25.3%,十二烷为10.2%,十四烷为11.6%,十六烷为15.6%,十八烷为27.4%,二十二烷为16%,二十四烷12%,二十八烷11%。菌株F-1基因组中存在大量与烃类化合物代谢相关的基因,进一步研究对含菲废水及多环芳烃污染的处理和深度修复有着潜在的应用前景。

