灵芝哈茨木霉病害生防细菌的筛选及菌剂制备研究
解鹏飞,郭建峰,张春兰,徐济责,,3*
(1.吉林农业科技学院 生物工程学院,吉林 吉林 132101;2.吉林农业大学 食药用菌教育部工程研究中心,吉林 长春 130118;3.吉林市食药用菌产业应用技术研究院,吉林 吉林 132101)
灵芝(Ganodermalingzhi) 属担子菌门,伞菌纲,多孔菌目,灵芝科,灵芝属[1],是重要的药用菌物,有着良好的营养、药用、保健和观赏等价值[2],在古代被人们誉为瑞草,历代医学家均认为灵芝能滋补强壮、扶正固本,更有着延年益寿的功效[3]。研究发现,灵芝有增强免疫系统抵抗癌症[4]、提高体内酶活性达到抗衰老[5]、保护肝脏[6]的作用,能够缓解神经衰弱、失眠、食欲不振等多种疾病[7]。随着灵芝功效不断被发掘,野生灵芝不能满足市场需求,人工栽培灵芝的规模越来越大[8],我国已形成规模化的地方栽培基地[9],目前灵芝栽培主要是固体培养和液体培养,固体培养包括椴木栽培和代料栽培[10],2015年我国椴木栽培和代料栽培面积达到1万公顷左右,产值约16亿美元,已成为世界上灵芝的主要生产国和出口国[11]。随着椴木栽培面积的不断扩大,一些灵芝病害也相继被发现[12],其中木霉菌是灵芝生产中最常见的病原菌之一[13]。木霉病害发生后主要通过使用农药等化学试剂进行防治,但由于木霉自身可在土壤中繁殖并久存且极易传播,使其效果不佳[14],随着各个国家和地区对农残等最低要求的提高,我国食药用菌等因农残超标而被退事件时有发生,同时农药残留对环境造成了极大的破坏[15]。因此近年来生防菌及其抑菌物质受到了研究者的广泛关注[16-19],在研究生产中灵芝在染病前几乎不会受到土壤中细菌的影响,本研究通过对土样进行梯度稀释、分离、纯化、拮抗实验的研究,初步获得灵芝木霉病害的拮抗菌,并与11种生防药剂进行对比,对获得的细菌菌株进行鉴定、发酵条件探索和菌剂载体筛选,为今后灵芝木霉病害的生物防治和菌剂制备提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种 病原菌采自灵芝栽培基地,生防菌编号JSW-0601,纯化保存。枯草芽胞杆菌B0066B,购自广东省微生物研究所。
1.1.2 培养基 PDA培养基、NA培养基、淀粉水解培养基、柠檬酸盐利用培养基,参照《常见细菌系统鉴定手册》。
1.2 方法
1.2.1 生防菌的初筛、纯化及复筛 利用“三点”接种法进行初筛;平板划线法进行纯化;对纯化后的菌株进行复筛。
1.2.2 滤菌液抑菌效果的测定 采用含毒介质法[20]测定。NA液体培养基接种JSW-0601,(30±1) ℃,150 r/min培养48 h。4 ℃、1 500 r/min条件下离心20 min除菌[21],用0.22 μm微孔滤膜除菌。将所得液体以2.5%的量与冷却至约40 ℃的PDA培养基混合并设置5个重复,以混入等量无菌水的PDA培养基为对照。平板中央接种病原菌菌饼,25 ℃培养,连续记录14 d病原菌的长速,观察其生长特性。
抑菌率(%)=((对照组日均生长速度-实验组日均生长速度)/对照组日均生长速度)×100%
1.2.3 灭菌液的抑菌效果测定 采用含毒介质法测定。混入量分别为20%、15%、10%、5%,每组设5个重复,操作同1.2.2。25 ℃培养,连续记录4 d病原菌的长速,观察其生长特性。
1.2.4 菌液的抑菌效果测定 采用含毒介质法测定。混入量分别为20%、15%、10%、5%,每组设5个重复,操作同1.2.2。25 ℃培养,连续记录18 d病原菌的长速,观察其生长特性。
1.2.5 菌体的抑菌率测定 采用纸碟法[22]进行抑菌活性测定。分别加入5、10、15、20 μL的菌体制成4组不同浓度梯度的菌液,每平板对称放置4个滤纸碟,每组设5个重复,以无菌水处理为空白对照。25 ℃下培养,记录第2天的抑菌圈直径,计算抑菌率[23]。
1.2.6 11种生防药剂的抑菌效果测定 以纸碟法检测11种生防制剂的抑菌效果,以接入等量无菌水的平板为对照,25 ℃培养,分别记录第2天和第18天的菌落特征。
1.2.7 JSW-0601的形态特征及生理生化鉴定 参照《伯杰细菌鉴定手册》[24]及《常见细菌系统鉴定手册》[25]进行逐步分析鉴定。实验操作方法参照《常见细菌系统鉴定手册》[25]完成。
1.2.8 JSW-0601的分子生物学鉴定 采用16S rDNA序列分析法[26]对菌株JSW-0601进行鉴定,通过提取DNA、PCR扩增、PCR产物测得16S rDNA的序列信息。利用 BLAST程序进行比对,检索同源性高且具代表性的菌株,利用MEGA 6.0软件构建系统发育树。
1.2.9 生防菌剂的制备和载体筛选 ①最优接种量的确定:分别以0.05%、0.1%、0.5%、1.0%、2.0%、3.0%、4.0%接种量的菌液接入NA培养基,恒温培养,测定OD600[27]。②生长曲线绘制:以最优接种量的接种,分别培养24、48、72、96和120 h,测定OD600,绘制生长曲线[17]。③菌液发酵单因素试验:碳源:NA液体培养基为基础培养基,选取葡萄糖、麦芽糖、乳糖、淀粉、蔗糖为基础培养基碳源,以最优接种量接种,恒温培养48 h;测定OD600;无机盐:选取氯化钠、硫酸镁、硫酸锌、磷酸氢二钾、磷酸二氢钾作为基础培养基无机盐,以最优接种量接种,恒温培养48 h,测定OD600;氮源:选取蛋白胨、酵母膏、硝酸铵、尿素为基础培养基氮源,以最优接种量接种,恒温培养48 h;测定OD600。④正交试验:单因素试验后,设计L4(23)正交试验(表1)。⑤载体初筛:选取高岭土、壳聚糖、几丁质、硅藻土为细菌载体[28],以5%的量添加到NA培养基中。稀释涂布平板,以未加载体的培养基为空白对照,每个处理3个重复。30 ℃恒温培养4 d,以细菌活菌量为指标,初步筛选出拮抗细菌载体。⑥载体复筛:选取高岭土、壳聚糖、硅藻土为细菌载体,发酵菌液,制备菌粉。稀释涂布测定载体的保护力。复筛最优细菌载体。

表1 L4(23)正交试验表Table 1 The orthogonal experiment table of L4(23)
2 结果与分析
2.1 复筛结果
确定JSW-0601为所筛拮抗菌中抑菌效果较好的细菌菌株。
2.2 滤菌液的抑菌效果测定
相同培养条件下,对照组已产大量的孢子,而实验组只产生少量孢子,可见发酵液中活性物质对病原菌的产孢有很好的抑制效果,且2.5%滤菌液抑菌率为30.80%(图1、表2)。

图1 滤菌液的抑菌效果Fig.1 The bacteriostatic effect of filtering the bacteria fermented liquidA:对照组;B:实验组A:control group; B:experimental group
2.3 灭菌液的抑菌效果测定
实验组病原菌的菌丝生长较对照组稀疏。可见JSW-0601分泌的无活性化学物质对病原木霉生长速度和产孢量均有较好的抑制效果,抑菌率依次为5%灭菌液51.91%、10%灭菌液62.79%、15%灭菌液73.97%、20%灭菌液80.20%,且呈线性规律(图2、表2)。

表2 不同含量发酵液的抑菌率Table 2 The bacteriostatic effect of ifferent amount fermented liquid
2.4 菌液的抑菌效果测定
相同培养条件下,对照组大量产孢且菌落色泽为黄绿色,实验组菌落未长满平板且菌落色泽为白色,同时呈现外层边缘菌丝稀疏,里层边缘菌丝浓密。菌液对病原菌有较强的抑制效果,抑菌率依次为5%菌液93.75%、10%菌液94.77%、15%菌液94.93%、20%菌液94.86%,但并无规律可循(图3、表2)。
2.5 菌体的抑菌率测定结果
菌体对病原菌菌丝生长有一定的抑制效果,5 μL菌体制成的菌液抑制率为51.67%、10 μL菌液为 55.00%、15 μL菌液为8.34%、20 μL菌液为63.33%(图4)。
2.6 11种生防药剂的抑菌性测定
前期,11种生防药剂中,地衣芽胞杆菌、多粘芽胞杆菌有较好的抑菌效果,其他9种药剂均无抑菌效果。后期,接入绿僵菌、侧芽胞杆菌的病原菌长势弱,菌落色泽为侧耳色。地衣芽胞杆菌、多粘芽胞杆菌所产生的抑菌圈依然明显,但病原菌长势强。接入白僵菌、绿色木霉的病原菌长势虽强,但产孢受到明显抑制,其余对病原菌仍均无抑制效果(图5、图6、表3)。

图2 灭菌液的抑菌效果Fig.2 The bacteriostatic effect of sterilization fermented liquidA:对照组;B:5%灭菌液;C:10%灭菌液;D:15%灭菌液;E:20%灭菌液A:control group; B:5% sterilization fermented liquid; C:10% sterilization fermented liquid; D:15% sterilization fermented liquid; E:15% sterilization fermented liquid
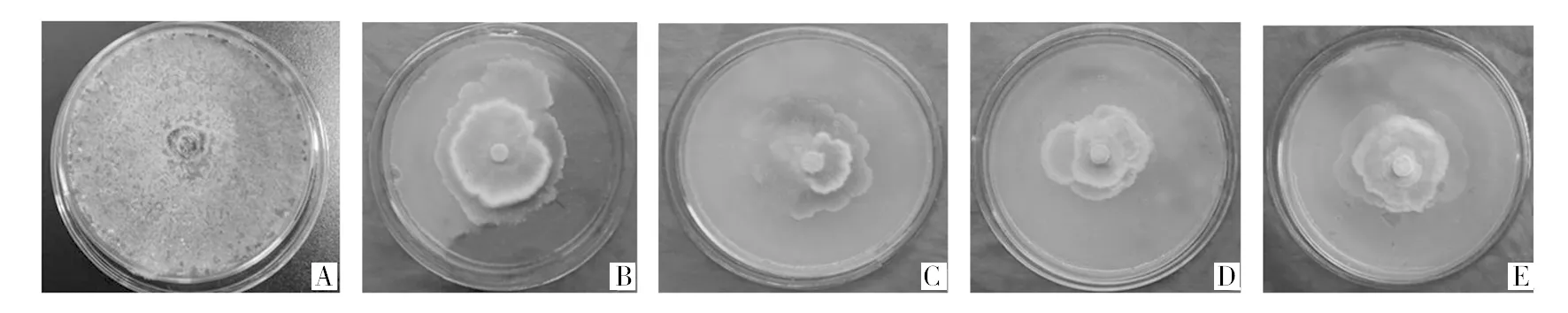
图3 发酵原液的抑菌效果Fig.3 The bacteriostatic effect of fermented liquidA:对照组;B:5%发酵原液;C:10%发酵原液;D:15%发酵原液;E:20%发酵原液A:control group; B:5% fermented liquid; C:10% fermented liquid; D:15% fermented liquid; E: 20% fermented liquid

图4 不同梯度菌液的前期菌体抑菌率Fig.4 Pre-bacteriostatic bacteriostatic effects of different gradient brothA:对照组;B:5 μL 菌液;C:10 μL菌液;D:15 μL 菌液A:control group; B: 5 μL liquid; C:10 μL liquid; D:15 μL liquid

图5 11种生防药剂的前期抑菌效果Fig.5 Pre-bacteriostatic effect of 11 kinds of Biological agentsA:绿僵菌;B:地衣芽胞杆菌;C:白僵菌;D:香菇多糖;E:绿色木霉菌;F:短稳杆菌;G:多粘类芽胞杆菌;H:苏云金杆菌;I:链霉素;J:微生物土壤改良剂;K:侧孢芽胞杆菌;L:空白,图6同 A:Metarrhizium anisopliae;B:Bacillus licheniformis; C:Beauveria bassiana; D:lentinan; E:green wood mold; F:Empedobacter brevis; G:Paenibacillus polymyxa; H:Bacillus thuringiensis; I:streptomycin; J:microbial soil conditioner; K: Bacillus laterosporus; L: CK;same figure 6

图6 11种生防药剂的后期抑菌效果Fig.6 The later bacteriostatic effect of 11 kinds of bio-control agents

表3 11种生防药剂的抑菌效果Table 3 The bacteriostatic effect of 11 kinds of biological agents
注:-:无抑菌圈;+:抑菌圈小,菌丝长势弱;++:抑菌圈较大,菌丝长势较好;+++:抑菌圈大,菌丝长势好;A:绿僵菌;B:地衣芽胞杆菌;C:白僵菌;D:香菇多糖;E:绿色木霉菌;F:短稳杆菌;G:多粘类芽胞杆菌;H:苏云金杆菌;I:链霉素;J:微生物土壤改良剂;K:侧孢芽胞杆菌
2.7 鉴定结果
2.7.1 16S rDNA序列分析 测序结果在NCBI中进行BLAST序列比对,下载同源性最高的16S rDNA序列。利用MAGE6.0软件建立系统发育树,由图7可知JSW-0601的16S rDNA序列与Bacilluspumillus序列的同源性最高,最大相似性达到100%,因此确定JSW-0601为短小芽胞杆菌。

图7 基于16S rDNA序列构建的系统发育树Fig.7 The Phylogenetic tree which is made by 16S rDNA order
2.7.2 形态特征 菌落形态为不透明,乳白色,圆形,边缘整齐有规则,表面湿润,光滑,菌落向外凸出生长。文献报道有不透明和半透明两种菌落形态,半透明的菌落较少存在,乳黄色[29-30]JSW-0601的菌体为短杆状。
2.7.3 生理生化特性鉴定结果 菌株JSW-0601为革兰阳性菌,其淀粉水解反应、接触酶反应、柠檬酸盐利用均呈阳性,如表4所示。对照表5可知该菌株特征数据与短小芽胞杆菌基本相似,但是由于巴氏芽胞杆菌的革兰反应与短小芽胞杆菌相似,且其接触酶反应与柠檬酸盐利用这两项特征数据文献未有记载,结合分子鉴定结果确定菌株为短小芽胞杆菌。
2.8 生防菌剂制备和载体筛选
2.8.1 最佳接种量确定 JSW-0601的OD600值随接种量增加呈先升高后降低最终趋于平稳的趋势,接种量为0.10%时,OD600值达到最大值(图8)。
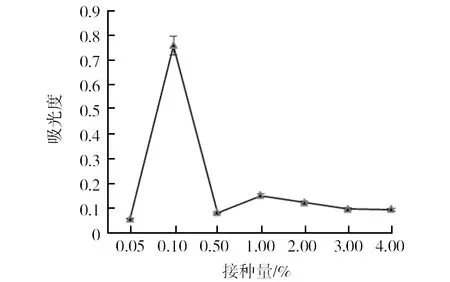
图8 接种量对JSW-0601的影响Fig.8 The influence of Inoculation amount of JSW-0601
2.8.2 生长曲线绘制 由图9可知,培养48 h时OD600值最大,菌量最多。

图9 时间对JSW-0601的影响Fig.9 The influence of time of JSW-0601
2.8.3 液体发酵单因素实验 葡萄糖为CK对照,由图10可知,4种碳源均优于葡萄糖,添加麦芽糖时OD600值最大,可达0.184 5。

图10 碳源对JSW-0601的影响Fig.10 The influence of carbon source of JSW-0601

表4 生理生化特性鉴定结果Table 4 The identification results of physiological and biochemical characteristics
注:+:90%~100%为阳性;-:90%~100%为阴性

表5 生理生化特性对照表Table 5 The comparison table of physiological and biochemical characteristics
注:+:90%~100%为阳性;-:90%~100%为阴性;d:反应不同;v:在一定菌株内不稳定;ND:未记载
蛋白胨为CK对照,其他3种氮源除酵母膏外均低于蛋白胨,且添加酵母膏时菌液的OD600值最高,可达0.208。硝酸铵和尿素对JSW-0601的生长有一定的抑制作用(图11)。
NaCl为CK对照,除ZnSO4外其他无机盐均优于NaCl,当添加MgSO4时,菌液的OD600值最高,可达0.252 5。ZnSO4对JSW-0601有很强的抑制作用(图12)。
2.8.4 正交试验 通过L4(23)的正交试验,最终确定麦芽糖0.25%、蛋白胨1%、硫酸镁0.5%为最优发酵条件(表6)。

图11 氮源对JSW-0601的影响Fig.11 The influence of Nitrogen source of JSW-0601

图12 无机盐对JSW-0601的影响Fig.12 The influence of Inorganic salt of JSW-0601

表6 L4(23)的正交试验Table 6 Orthogonal test of L4(23)
2.8.5 载体初筛 加入载体后菌液中的活菌数受到了影响,其中几丁质对JSW-0601的影响最大,故将几丁质排除选用剩下3种进一步筛选最优载体(表7)。
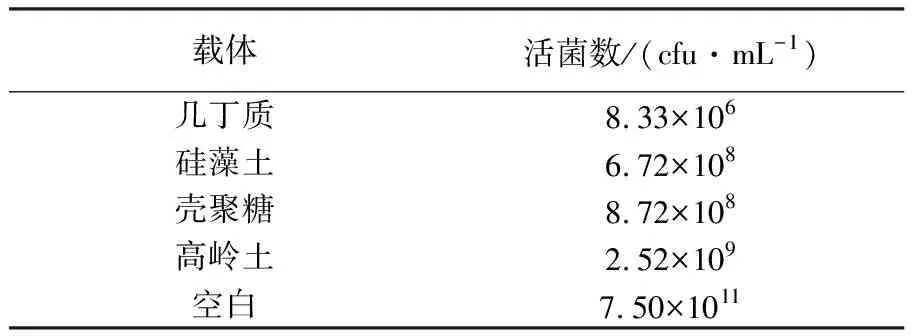
表7 载体初筛Table 7 Vector eariy screening
2.8.6 载体复筛 在初筛时的最优载体高岭土,反而在制成菌粉后所载附活菌数变为最低。硅藻土作为载体所制菌粉每克中活菌数最高,因此最终选定硅藻土为菌剂所用载体(表8)。

表8 载体复筛Table 8 Vector secondary screening
3 讨 论
枯草芽胞杆菌、地衣芽胞杆菌和凝结芽胞杆菌是现阶段美国 FDA 认为安全的3种芽胞杆菌[31],自1990年以来中国农业部已经对可应用于饲料和养殖的微生物种类进行了几次增补[32],目前认为可安全使用的芽胞杆菌是由农业部1126号公告所公布的枯草芽胞杆菌和地衣芽胞杆菌两种;但2010年出台的征求意见稿则进一步扩大芽胞杆菌使用范围,在原有基础上,增补了短小芽胞杆菌、凝结芽胞杆菌、侧孢芽胞杆菌和迟缓芽胞杆菌[33]。
结合分子鉴定和生理生化特性,确定JSW-0601为短小芽胞杆菌。通过测定抑菌效果,发现JSW-0601分泌的化学物质及胞外活性物质对病原菌丝均有较好抑制效果,与菌体共同存在时所表现的抑菌效果更强。对比纸碟法和含毒介质法,可见通过生防菌影响病原菌的营养来源可达到更好的防治效果。考虑到研究阶段存在的局限性,在田间施用时,可能受温度、微生物、pH等环境因素影响,防治效果也会随之变化,因此田间防效有待进一步研究。
11种生防药剂中,白僵菌、绿色木霉前期虽无抑菌效果,后期对产孢的抑制却优于JSW-0601,但绿色木霉作为一种食用菌病害也可能侵染灵芝,故可排除绿色木霉;绿僵菌、侧芽胞杆菌前期也无抑菌效果,但后期呈现较好抑制产孢效果;地衣芽胞杆菌、多粘芽胞杆菌虽前、后期的抑菌圈均较为明显,但对产孢无明显抑制效果,不利于病害的控制,较JSW-0601的抑菌效果差,可考虑与侧芽胞杆菌作为复合剂施用。其他生防药剂对病害均无抑菌效果,可见JSW-0601有很大的研究空间、实用价值。
本研究对JSW-0601可湿性粉剂进行初步研制,进行了最佳接种量的确定、生长曲线的测定、载体筛选以及发酵条件的优化等试验。最终确定硅藻土、0.1%接种量、培养48 h为最佳菌剂研制条件。L4(23)正交试验最终确定麦芽糖0.25%、蛋白胨1%、硫酸镁0.5%为最优发酵条件。最优发酵条件的筛选为后期田间试验提供了优良的佐剂条件将大大缩短菌体萌发时间,大大提高菌剂的性能。目前国内外短小芽胞杆菌主要应用于植物病害防治、毒素及石油降解、水产养殖、动物养殖的饲料添加益生菌等研究[34-40]。在灵芝及其他食用菌致病木霉的生防应用方面却鲜有报道,可见短小芽胞杆菌在此方面有很大的应用潜力。

