适用于双向电泳的米曲霉孢子破壁方法研究
胡荣涛,畅 英,陆娇娇,施碧红
(福建师范大学 生命科学学院,福建 福州 350117)
米曲霉(Aspergillusoryzae)是曲霉属中的重要成员之一,在微生物发酵领域,尤其是食品发酵行业,酱油、清酒等的生产过程中应用广泛。米曲霉为产孢子丝状真菌,其分生孢子由有隔菌丝顶端或分生孢子梗特化而成,是米曲霉的主要繁殖细胞。米曲霉分生孢子多为圆球状,少数为扁球型,孢子内部的核数目具有多样性,多数为多核(核数目≥2),少数为单核[1],且在其生长发育过程中会发生核型的变化。孢子核数目的不同会影响孢子大小、萌发率及对外界环境的敏感性等[1-3]。生产实践中不同核型孢子遗传稳定性差异会影响菌种的选育工作。分析生长过程孢子中蛋白组成的变化,有助于探讨米曲霉发育过程核型变化的遗传机制。双向电泳是研究不同细胞类型中蛋白表达差异的有效手段[4]。利用双向电泳研究米曲霉不同核型孢子中蛋白的差异,首先需建立提取制备孢子蛋白的高效稳定方法。真菌细胞壁的主要成分是多糖,另有少量蛋白质和脂类。米曲霉细胞壁多糖主要为葡聚糖、几丁质[5],孢子细胞壁较厚且结构坚韧,不易破碎,破碎不易完全,孢内蛋白提取较为困难[6]。为此我们对米曲霉孢子的破壁方法进行系列试验。本研究拟通过5种不同的破壁方法对米曲霉孢子进行破壁处理,用血球计数板计算破壁率,并进行蛋白质含量测定,最终使用双向凝胶电泳验证破壁方法的可行性。从而明确不同机械破壁方法的破壁效果,选出破壁效率高、简便易行、且适用于双向电泳蛋白质分析的破壁方法,为进一步研究米曲霉孢子蛋白质提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种 米曲霉FS1125为本实验室保藏菌种。
1.1.2 培养基(质量分数,%)及孢子悬液制备 CD培养基:NaNO30.3,KH2PO40.1,MgSO4·7H2O 0.05,KCl 0.2,FeSO4·7H2O 0.002,葡萄糖 2,琼脂糖 2。30 ℃培养9 d,收集孢子悬液,离心、裂解液(8 mol/L尿素,4% CHAPS,2% IPG buffer,40 mmol/L DTT)重悬以获得不同浓度的孢子悬液,并用双层擦镜纸滤去菌丝,血球计数板计算孢子数[7]。
1.1.3 试剂及仪器 LHR-150生化培养箱(上海一恒科学仪器),TGL-16M高速台式离心机(长沙湘仪),超声波清洗机(宁波新芝生物科技有限公司),均质器(MP·Fast-prep),普通光学显微镜(重庆光电),SDS-PAGE小型垂直电泳系统(Bio-Rad),Ettan IPG phor 3双向电泳系统(GE Healthcare),牛血清蛋白标准液(生工生物工程),蛋白染色液G-250(生工生物工程),尿素、CHAPS、DTT、IAA、IPG buffer、IPG胶条、矿物油均购自GE公司,其他试剂购自西陇化工。
1.2 方法
1.2.1 破壁方法 ①石英砂研磨:按50 mg/mL加入石英砂,直接研磨;②超声破碎:孢子悬液在冰水浴中进行超声破壁(工作30 s,间歇45 s破壁20 min);③石英砂+超声破碎:按50 mg/mL加入石英砂,研磨3~5 min成糊状,再超声处理;④液氮研磨:将一定量的已测定浓度的孢子悬液离心,弃上清,置于研砵中,液氮多次研磨直至絮状,再加入与原先等量的裂解液复溶;⑤MP·Fast-prep均质器法:采用均质器进行破壁处理(振荡速度5.0 m/s,工作时间30 s),间隔冰水浴反复进行10次循环。
1.2.2 破壁观察与破壁率测定 采用普通光学显微镜进行破壁观察并拍照,用血球计数板测定破壁前后完整的孢子数目,计算破壁率[8-9]。破壁率为3个重复样的平均值。

1.2.3 蛋白标准曲线的制作 取7支试管,分别加入0、10、20、40、60、80、100 μL的牛血清蛋白标准液(1 mg/mL),并用裂解液补足100 μL。再分别加入3 mL的蛋白染色液G-250。所有溶液加入5 min,待溶液颜色稳定,用分光光度计测定每管溶液在595 nm下的吸光值(比色空白皿用3 mL的蛋白染色液G-250),并绘制标准曲线。
1.2.4 样品蛋白浓度测定 破壁处理后的孢子悬液经过7 000 r/min离心10 min,去除孢子碎片后,取100 μL上清液于试管中,加入3 mL蛋白染色液G-250,反应5 min待颜色稳定后,于595 nm下比色(比色空白皿用3 mL蛋白染色液G-250)测定其吸光值,并计算蛋白质含量[10]。
1.2.5 孢子可溶性蛋白SDS-PAGE 将孢子经过以上5种不同破壁方法处理,离心取得的上清液,进行SDS-PAGE。采用不连续丙烯酰胺凝胶电泳,5% 浓缩胶(pH 6.8)和12% 分离胶(pH 8.8)。电压90 V,电流400 mA,时间90 min。电泳停止后用R250染色液进行染色。
1.2.6 双向电泳可行性验证 筛选出具有最高破壁率的方法所得到的样品液进行双向电泳试验,验证该破壁方法是否能适用于双向电泳样品制备[11]。
2 结果与分析
2.1 显微观察结果
在普通光学显微镜下观察米曲霉孢子破壁前后形态,可见孢子破壁前为圆球状孢子,破壁后多为细胞碎片,少数为孢壁内空圆球(图1)。
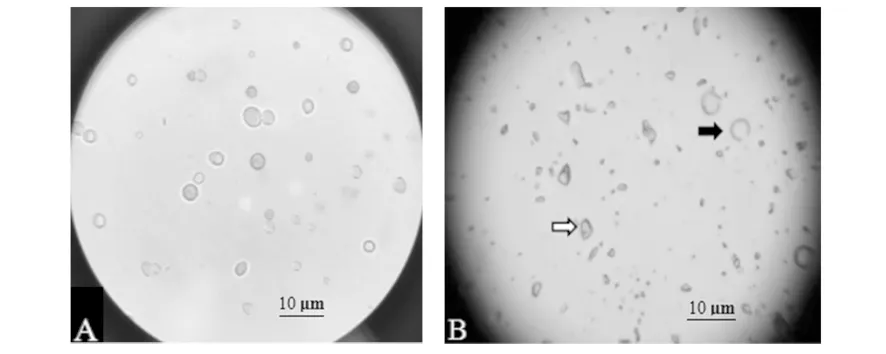
图1 米曲霉孢子破壁前后的显微观察Fig.1 The Aspergillus oryzae conidia before and after rupture under optical MicroscopeA:孢子破壁前形态;B:孢子破壁后形态(空心箭头指向为细胞碎片,黑色箭头指向为孢壁内空圆球)A: conidia before rupture;B: conidia after rupture(The hollow arrow points to the broken fragments of conidia,the black arrow points to the empty sphere)
对不同浓度的米曲霉孢子采用1.2.1所示的破壁方法,经血球计数板计数,结果表明:在孢子浓度较低(约107个/mL)时,方法③、④、⑤都具有较高的破壁率(>70%,表1),且方法⑤>③>④,其中方法⑤破壁率高达97%。随着孢子浓度的增加(约109个/mL),方法①和②的破壁率太低,不具有统计意义,不进行后续实验;方法③和④都出现了不同程度的破壁不完全,而方法⑤仍具有最优且稳定的高破壁率(90%,表1)。对表1中的2种不同浓度的孢子采用方法⑤的破壁效果均显著高于其他4种破壁方法(t检验)。
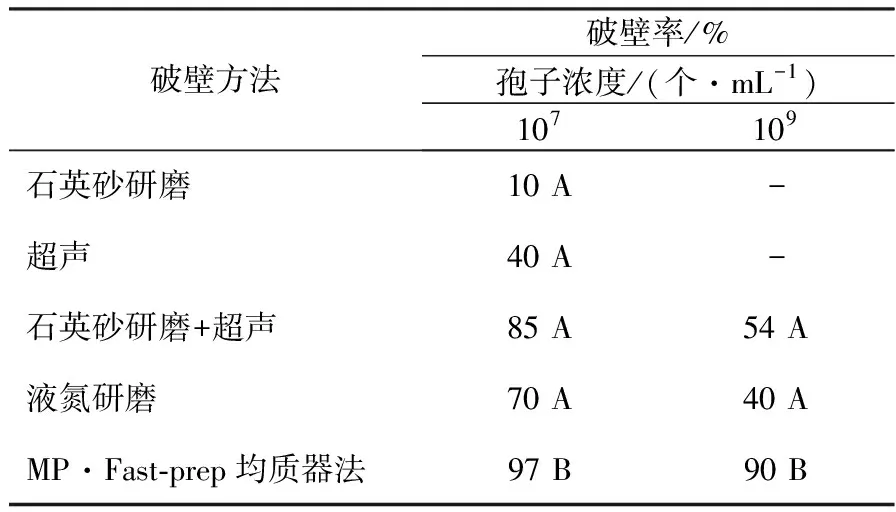
表1 不同浓度的米曲霉孢子的破壁率Table 1 Wall-broken rates of different concentration conidia of Aspergillus oryzae
注:“-”表示破壁率太低,没有统计意义;A、B表示P<0.001的显著差异,下表同
2.2 蛋白标准曲线
为测定破壁后孢子释放的蛋白含量,先用牛血清蛋白标样制作标准曲线,如图2,R2=0.999 1,线性良好。后续待测样品经分光光度计检测后,可利用该曲线线性关系计算蛋白含量。

图2 牛血清蛋白质标准曲线Fig.2 The standard curve of bovine serum proteins
2.3 可溶性蛋白含量
用Bradford方法测定米曲霉孢子在不同破壁方法处理下释放出的可溶性蛋白含量见表2。结果表明:经方法③、④、⑤处理的孢子均有不同的蛋白量释出并且与破壁率的结果一致(方法⑤>③>④),且不论孢子浓度为107或109个/mL,经方法⑤破壁后释放的可溶性蛋白含量均显著高于方法③或④(t检验)。另外从表2也可看出对于同一破壁方法,高浓度孢子悬液(109个/mL)破壁后其可溶性蛋白含量要显著高于低浓度孢子悬液(107个/mL)。为满足后续双向电泳对样品蛋白浓度的要求,需采用高浓度孢子悬液(109个/mL)进行破壁及蛋白提取。故方法⑤是首选破壁方法,因为随着米曲霉孢子浓度的不断加大,只有方法⑤可以保持高破壁率,并保障孢子内部蛋白质的释出。

表2 米曲霉孢子破壁后释出的可溶性蛋白含量Table 2 The soluble Protein releasing from broken spores
2.4 孢子可溶性蛋白SDS-PAGE
将浓度约为109个/mL的孢子分别经3种不同破壁方法处理的蛋白提取样品进行SDS-PAGE(图3),结果表明:3种方法处理的样品均可见清晰蛋白条带,方法⑤获得的样品条带最清晰明显,颜色也更深。比较三者的蛋白条带显色清晰排序为方法⑤>③>④,与分光光度计检测的蛋白含量排序相吻合。
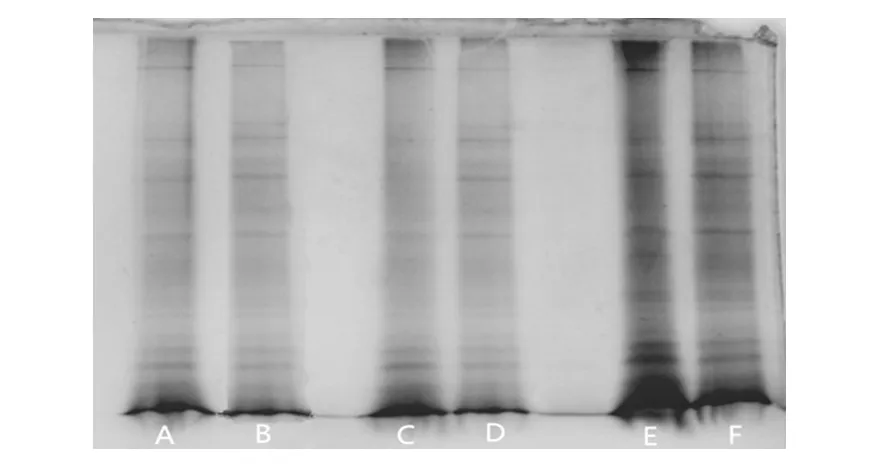
图3 米曲霉孢子可溶性蛋白的SDS-PAGEFig.3 SDS-PAGE of soluble protein in Aspergillus oryzae conidiaA、B为方法③破壁样品;C、D为方法④破壁样品;E、F为方法⑤破壁样品A and B were broken by Quartz sand grinding plus ultrasonic treatment method;C and D were from Liquid nitrogen grinding method;E and F were by MP·Fast-prep method
2.5 可溶性蛋白双向电泳
将方法⑤破壁提取可溶性蛋白样品进行双向电泳验证,结果表明使用该方法进行米曲霉孢子的破壁,并进行孢内蛋白的提取,其样本是适用于双向电泳试验的(图4)。

图4 米曲霉孢子破壁释出可溶性蛋白双向电泳图谱 Fig.4 Two-dimensional electrophoresis of the conidia protein in Aspergillus oryzae
由图4可见较为清晰丰富的蛋白点,且不存在横、纵向拖尾问题。说明使用方法⑤对米曲霉孢子进行破壁提取蛋白适用于双向电泳的样品制备。
3 讨 论
虽然目前已有不少文献报道真菌菌体蛋白提取方法,如单振秀等采用3种破壁方法对抗 Cr6+真菌进行处理,发现使用超声波法破壁效果最好[12];万其兵等[13]用4种破壁方法处理DS-9701菌株,结果表明石英砂+超声的方法效果较佳;王燕等用酶法进行米曲霉破壁[14],但酶解法会导致真菌细胞壁结构变化和蛋白位点的移动[15],可能会对进一步的孢内蛋白分析造成影响;刘东奇等[16]用6种方法对啤酒酵母进行破壁实验,结果表明微波法具有最佳破壁效果,破壁率达到49%。但是关于米曲霉分生孢子的破壁及其蛋白提取方法还鲜见报道。
蛋白质提取的关键步骤是细胞破碎和蛋白质溶解。本研究采用5种不同的破壁方法对米曲霉孢子进行破壁,结果表明:方法①石英砂研磨和方法②超声的破壁率不高,不适用于米曲霉孢子破壁;方法③石英砂+超声、④液氮研磨、⑤MP·Fast-prep均质器有较高的破壁率,但随着孢子浓度的提升,方法③石英砂+超声、方法④液氮研磨的破壁效果有所下降。如果通过延长处理时间等方法进行补救,有可能导致孢子内含物变性等问题。综合考虑,方法⑤MP·Fast-prep均质器破壁法为米曲霉孢子的最佳破壁方法。该法不论是破壁率还是孢内蛋白释放量都较高且稳定,且操作简便、液量损失少、破壁方法对孢子内蛋白质无明显影响,样品可用于SDS-PAGE和双向电泳,该方法的建立为米曲霉蛋白质组学的进一步研究提供了参考。

