温度响应的细菌生理生化特性调控研究进展
包永明,王庆玲,吴 宪
(1.大连理工大学 生命科学与技术学院,辽宁 大连 116024;2.大连理工大学 食品与环境学院,辽宁 盘锦 124221)
温度作为一个重要的环境信号,可以控制生物的生长及代谢。生物有机体、种群和群落对于环境因素,如温度产生的胁迫,可通过整合外源信号和内源信号,调控各项生理活动,抵抗或适应环境因素变化带来的生存压力。细菌生长及代谢对温度响应的机制和调控研究,是利用有益微生物,抑制有害微生物的科学基础,具有重要的理论意义和应用价值。对于结构简单的原核生物细菌,响应环境信号变化的调控系统几乎涵盖了简单的细胞结构及分子,细菌对温度变化响应的原件包括DNA、RNA及蛋白分子等,这些分子能够作为温度感应元件,探测环境温度变化,从而启动各种相关的细胞响应。
1 DNA作为温度感受元件
DNA作为遗传物质,可以通过复制和转录调控实现表型性状的改变。作为温度感受DNA元件的细菌,主要通过DNA的完整性及拓扑异构构象,从而实现对温度响应的调控。
一种方式是细胞通过DNA分子超螺旋结构改变响应温度变化,从而控制基因的转录速率,影响基因的表达,比如大肠埃希菌和沙门氏菌等中温细菌,其细胞内的DNA分子倾向于负超螺旋结构,当环境温度升高时,会增加DNA分子的正螺旋结构,使得DNA分子变得松散,当环境温度降低时,会减少DNA分子的正螺旋结构[1];而嗜热古生菌,其胞内DNA分子倾向于正超螺旋的结构,环境温度升高会增加DNA分子的正螺旋结构,较低的环境温度会诱导DNA分子形成负螺旋结构[2](图1A)。
另一种方式是细胞通过改变DNA拓扑结构,影响DNA分子与转录抑制蛋白或小分子的结合能力,调控基因转录的起始,从而响应环境温度变化。H-NS(histone-like nucleoid-structuring)蛋白作为转录抑制剂被广泛研究[3],大多数细菌在较低的温度下,DNA分子属于弯曲的状态,能够与H-NS蛋白较好结合,抑制了H-NS调控的基因表达,当外界温度升高时,高温减弱了DNA的弯曲程度,降低了与H-NS的结合能力,从而促使相应基因的转录[4](图1B)。这种调控方式多发生于生长在宿主体内的病原菌内,当温度处于37 ℃时,毒性因子的表达增加,病原菌的毒性增强;当温度低于37 ℃时,毒性因子的表达减少,病原菌毒性减弱,如鼠伤寒沙门氏菌(Salmonellatyphimurium);在30 ℃以下温度生长,不能激活type III分泌系统的表达,原因是细胞中的H-NS蛋白与DNA的结合,阻碍了T3SS分泌系统基因的表达[5]。
2 RNA作为温度感受元件
RNA作为温度感受原件,常见于细菌毒性因子、热休克及冷休克蛋白基因的表达。RNA温度敏感的区域一般位于编码基因mRNA 5′端的非编码区[6],如图2所示,在低温条件下,位于基因起始密码子AUG上游RNA敏感区部分的SD序列容易形成一个发卡结构,阻碍了翻译的进行;随着温度升高,发卡结构逐渐变得不稳定,暴露出核糖体的结合位点,使得基因能正常翻译。
经典的RNA热敏元件属于ROSE (Repression of Heat Shock gene Expression)家族,常出现在大肠埃希菌和沙门氏菌中[7]。ROSE元件约为60~100个核苷酸,位于热休克基因转录子5′端的非编码区,能够响应温度的变化,调控热休克基因mRNA的翻译过程。另外一种控制热休克基因表达的RNA热敏元件包含了4个尿嘧啶核苷,如沙门氏菌中的agsA基因,其起始密码子上游含有4个尿嘧啶核苷。在高温下,这4个尿嘧啶核苷会参与翻译起始的复合物,影响转录子的翻译,而在低温下,则不会参与形成复合物,agsA转录子能够正常起始翻译[8]。冷休克蛋白的表达也能够被RNA温控元件所调控,如大肠埃希菌中,编码冷休克蛋白CspA上游的序列含有推测的RNA热敏元件,可控制cspA mRNA的翻译速率,即在低温下形成的结构比在高温下有更高的翻译速率[9]。另外,涉及低温下响应的蛋白CspE和低温环境下菌体生长的DsrA蛋白都被推测受RNA温控元件的调控,但详细的机制仍不明确[10-11]。

图1 DNA结构和拓扑异构作为热敏感受器[1]Fig.1 DNA structure and topology as a thermosensor[1]A:负超螺旋与正超螺旋的转化;B:DNA与H-NS蛋白结合A:conversion of negative supercoil between positive supercoil;B:DNA binding with H-NS

图2 RNA作为温度感受器基本原理[1]Fig.2 The basic principle of RNA thermometers[1]
3 蛋白质作为温度感受元件
蛋白质空间结构对温度变化非常敏感,环境温度的改变容易使蛋白质从有活性构象到无活性构象转变,或者使有活性二聚体与无活性单聚体之间转变,因此蛋白分子作为温度感受的元件是目前被研究得最广泛的感应因子。蛋白质作为温度感受元件主要集中在转录因子、分子伴侣及响应刺激的感应蛋白上。
3.1 Sigma (σ)因子及分子伴侣
很多微生物细胞中,分子伴侣也能够作为温度感受器调控各种温度依赖性的基因表达。诸多的分子伴侣行使σ因子作用,如,σE、σH和σS作为胁迫响应的因子可以响应温度变化调控细菌的生长及代谢特性。大肠埃希菌和栖热链球菌中,Hsp70(Heat shock 70 kD protein)家族的分子伴侣DnaK和共伴侣分子DnaJ,以及核苷酸交换因子GrpE作为一个重要的元件可以感受温度的刺激,当外界温度变化时,GrpE的结构发生改变,从而可以调控温度依赖性表型基因的表达[12];分子伴侣DegP(HtrA)也能够作为一个独特的热敏感受元件,感受温度的变化,其作用机制是DegP活性在具有分子伴侣和蛋白酶功能之间转化[13]。
3.2 转录因子
转录调控因子是指可与基因调控序列直接或者间接作用并调控基因转录的一类蛋白,也称反式作用因子。转录因子C端通常具有螺旋-转角-螺旋(helix-turn-helix,HTH)结构,这种HTH结构域可以结合调控基因的启动子区域[14]。
大肠埃希菌的cAMP受体蛋白(cAMP receptor protein,Crp),属于依赖cAMP的转录因子,它包含两个结构域,N端的cNMP结构域与C端的DNA结合结构域;Crp N端的cNMP可与cAMP结合,形成Crp-cAMP复合物,使Crp自身结构发生改变,从而实现对一系列下游调控基因的正向或者负向的表达调控[15-17]。
一些植物病原微生物,如黄单胞菌(Xanthomonas)中,Crp类似蛋白的转录因子(cAMP receptor like protein,Clp) 不能与cAMP结合,而是作为新型第二信使环二鸟苷酸(3′,5-cyclic diguanylic acid,c-di-GMP)结合的受体蛋白。c-di-GMP与Clp的N端的cNMP结合后,形成Clp-cNMP的复合物,这种结合导致Clp的结构发生改变,从而调控下游基因的表达[14]。将Xanthomonascampestris中的clp基因敲除后,发现敲除菌株的胞外酶活性及胞外多糖的产生显著减少,其致病性显著降低[18]。水稻致病菌Xanthomonasoryzae中突变clp基因,其菌体的胞外多糖、运动性及抗氧化能力显著降低[19]。这些转录因子通常并没有感受温度变化的能力,但是这些第二信使分子能够很敏感地感受外界环境的变化,因而温度调控胞内转录因子与信使分子复合物的含量,从而间接调控相关基因的表达。
某些转录阻遏因子自身具有感受温度的能力,如图3A所示,转录因子可以直接结合到DNA分子的启动子区,影响基因的转录。阻遏蛋白CtsR广泛存在于各种革兰阳性菌中,如枯草芽胞杆菌、乳酸乳球菌及地衣芽胞杆菌等,CtsR蛋白具有富含甘氨酸的环,当CtsR感受到温度变化时,CtsR与其他的热休克响应元件一起从DNA上脱离,允许基因起始转录[20]。其他具有温度依赖性DNA结合活性的转录阻遏蛋白都被证明与CtsR具有类似的机制,随着温度的升高而与DNA解离,如沙门氏菌中的TlpA[21]、耶尔森氏菌中的RovA[22]、链霉菌中的RheA[23]及强烈火球菌中的Phr[24]。GmaR是单核细胞增生李斯特菌中的转录因子和热敏蛋白,它能够控制温度依赖鞭毛基因的转录,是目前报道的唯一一个温度响应的抗阻遏蛋白因子[25]。
3.3 双组分系统
双组分信号传导系统(Two-Component System Transduction System,TCSs),是生物界广泛存在的重要信号传导系统,也是重要基因表达的调控系统[27],其作用方式主要是通过磷酸转移信号来调控胞内各项生理特性,如图4所示。细菌中双组分系统和信号蛋白的数量可以代表菌体对外界环境的适应能力。图4A所示典型的双组分系统包括一个跨膜的组氨酸蛋白激酶(Histine kinase,HK)作为感应蛋白和一个位于细胞质内的应答效应蛋白(Response regulator,RR);HK的N端位于细胞膜上或者部分位于膜外,可以直接或间接地感受胞外环境信号,感应蛋白也是一种磷酸激酶,可以自发地磷酸化。RR可以接受从感应蛋白HK转移而来的磷酸基团,从而引起信号的响应。在特定的信号下,HK中保守的His残基发生自我磷酸化,此过程是把细胞内ATP的高能磷酸键转移到HK蛋白的组氨酸残基(His)上;产生的高能磷酸基团会通过激酶HK传递给RR中信号接受结构域REC(CheY homologous receiever domain)的Asp残基上,引起RR构象变化,从而激活RR的输出结构域[28-29]。如图4B所示,另一种是复合的双组分系统,系统中高能磷酸键的转移有一个延迟过程,当激酶细胞膜上或者膜外的感应结构感受到外界信号刺激时,激酶自身发生磷酸化,此时的磷酸基团并没有直接传递给RR,而是又经过一个磷酸转移过程,传递给另外一个胞内激酶,胞内激酶接受磷酸信号后,通过HPT(Histidine phosphotransfer domain)结构域的磷酸转移功能,把磷酸信号转移给调节蛋白RR;有的双组分系统中的激酶自身就带有这种磷酸转移酶的结构域,磷酸转移并不需要其他激酶[29-30]。

图3 蛋白作为热敏元件示例[26]Fig.3 Examples of protein temperature sensors[26]A:具有感受温度能力的转录因子;B:温度依赖性DNA结合活性的转录阻遏蛋白A:transcription factor capable of sensing temperature; B:transcriptional repressor proteins with temperature dependent DNA binding activity

图4 细菌中双组分系统区域组成与信号[29]Fig.4 Domain organization and signaling of TCSs in bacteria[29] A:典型的双组分系统;B:复合的双组分系统(磷酸基团转移延迟)A:basic system TCSs;B:complex phospho-replay
一些古生菌中,有些丝氨酸双组分系统可以同时具有这两种功能,当细胞膜上的激酶接受外界刺激后,既可以把外界信号直接转移给效应蛋白RR,同时也可以通过另外一种激酶或者自身杂合激酶作用,经过磷酸转移延迟的过程,把信号转移给响应蛋白RR[31]。
3.3.1 温度感应的双组分系统 双组分系统是微生物中最普遍也是最有效的感受和响应外界环境信号的机制之一,越来越多的温度响应双组分系统被发现,它们调控了不同微生物的各项生理活动。南极古生菌Methanococcoidesburtonii中的LtrK/LtrR双组分系统能够响应低温的刺激,调控很多温度依赖的基因表达,Najnin等[32]发现,双组分系统中的感应激酶LtrK对效应蛋白LtrR的磷酸化活性是不稳定的,具有温度依赖性,在10 ℃以下具有高磷酸化活性,温度超过30 ℃时,LtrK的激酶活性很快丢失。铜绿假单胞菌PG1480中的双组分系统CorS/CorR能够响应温度的刺激调控响应蛋白CorR的活性,高温能够影响激酶CorS的构型的改变,导致CorS激酶活性丢失,从而调控CorR蛋白的磷酸化水平,最终调控菌体中基因的表达[33-34]。溶藻弧菌中的双组分系统VarS/VarR能够调控温度依赖产生的胶原蛋白酶的表达[35]。蜡样芽胞杆菌中的CasK/CasR[36]及肉毒梭状杆菌ATCC3502中的双组分系统CBO2306/CBO2307[37]能够调控菌体在低温环境下的生长。枯草芽胞杆菌中的DesK/DesR双组分系统能够响应外界温度,从而调节编码Δ-5′脂肪酸链去饱和酶基因des的表达。DesK/DesR双组分系统也是研究得比较全面、透彻的温度响应的双组分系统[38-40](图5)。响应蛋白DesR是转录调节蛋白,其转录调控活性受激酶DesK的磷酸化控制,在不同温度下,膜的流动性作为一个特定的信号被DesK的N-末端的感应区域所获得,DesK是一个双功能的酶(磷酸酶或者激酶的活性),由多个跨膜区域及位于胞质内的催化区域构成,其中催化区域包括二聚化区域、组氨酸磷转移结构域DHp及ATP结合结构域,而处在跨膜区域与催化区域的这一部分称作连接枢纽linker region(绿色标注)。这个链接区域在不同的温度下有不同的构型:①散乱的螺旋构型,可以在水膜交接面结合磷脂,DesK表现出磷酸酶的活性;②不能与细胞膜的磷脂发生作用,处于正常的螺旋状态,DesK表现出激酶的活性。温度依赖的细胞膜厚度的改变决定了linker region的构型,当环境温度降低时(25 ℃),细胞膜结构处于高度有序状态,细胞膜的流动性降低,细胞膜的厚度增加,此时链接区域linker处于α螺旋状态,DesK激酶活性使DesR磷酸化,激活des基因的表达,表达的Des酶能够插入到细胞膜中,催化细胞膜上的磷脂去饱和化,形成不饱和的磷脂,从而可以恢复细胞膜的流动性。当环境温度升高时(37 ℃),细菌细胞膜的流动性增强,膜的厚度降低,此时链接区域处与细胞膜上的磷脂发生作用,处在散乱的螺旋状态,DesK磷酸酶活性使DesR去磷酸化,不能转录des基因[40]。

图5 基于温度改变的DesK活性模型[40]Fig.5 Model for DesK activity upon temperature changes[40]
嗜麦芽单胞菌中的双组分系统研究虽然起步晚,但是更多的双组分系统被发现并证实。Huang等发现CreBC双组分系统在嗜麦芽单胞菌中能够调控外泌的蛋白酶活性及菌体的移动性,单敲除creC或者双敲除creCB都能减少胞外蛋白酶的活性,然而creB单敲除菌株的蛋白酶活性并没有发生改变,表明CreC激酶和CreB调控胞外酶的机制有待于进一步解析产生[41]。同时,CreCB双组分系统能调节鞭毛的形态,增加细胞膜的电位及调控鞭毛相关基因调控子CreD蛋白的表达,共同调控嗜麦芽单胞菌的菌体移动性[41-42]。在嗜麦芽单胞菌中,双组分系统PhoQ/PhoP被发现,这是一个在大肠埃希菌中研究得比较详尽的双组分系统,这个系统能够感受外界环境中的温度、pH、Mg2+及抗菌药物,从而调控细菌的各项生理功能[43-44]。Liu等[45]发现嗜麦芽单胞菌中PhoQ/PhoP能够调控细菌对抗菌素的敏感性,敲除响应蛋白PhoP能够使菌株对多种抗生药物的MIC浓度减少2~64倍,原因是敲除PhoP增加了细胞膜的渗透性及减少SmeZ的表达,从而增强了菌株对抗菌药物的灵敏性。Zheng等[46]在研究嗜麦芽单胞菌中组氨酸激酶时发现,一个双组分系统SmLt4209-SmLt4208(BfmA-BfmK)的敲除明显减少了菌株的生长,影响了菌体的移动性及生物膜的形成,其中BfmA是一个转录调控因子,可以直接结合到acoT基因的启动子上,而acoT编码一种在生物膜形成过程中起重要作用的乙酰辅酶A的巯基酯酶。
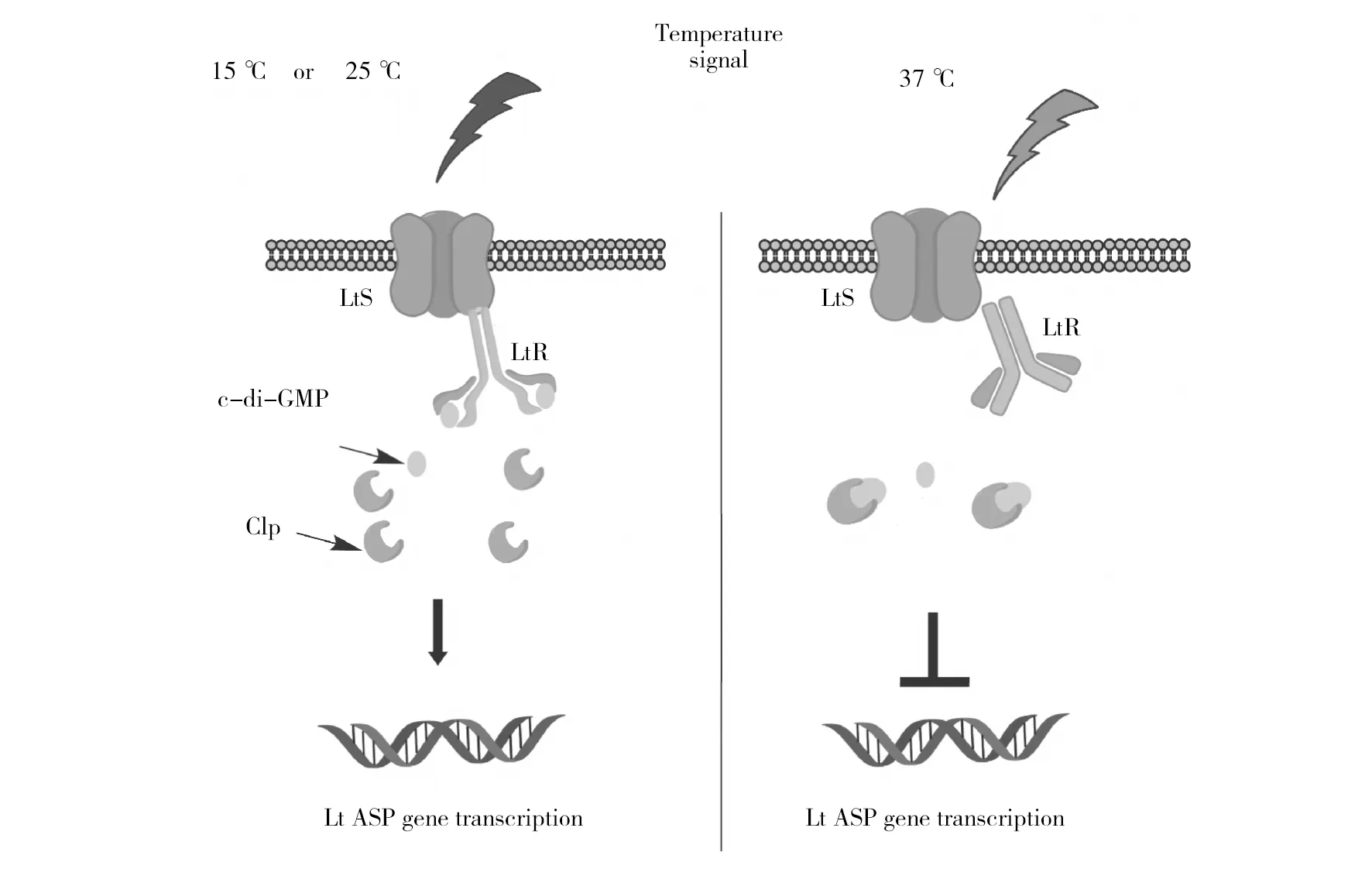
图6 嗜麦芽单胞菌的LotS/LotR双组分温度响应Fig.6 Response to temperature with LotS/LotR TCSs in S.maltophilia FF11
作者在研究嗜麦芽单胞菌S.maltophiliaFF11低温响应蛋白酶(S.maltophiliatemperature-responsive protease,SmtP)时,发现S.maltophilia的4个双组分系统Sm3706/Sm3705、Sm1829/Sm1828、Sm1911/Sm1912和Sm0737/Sm0738涉及c-di-GMP代谢。基因敲除和回补实验证明Sm3706/Sm3705是一个新的未被鉴定的双组分系统,命名为LotS/LotR(low temperature sensor and regulator),LotS是一个非经典的感应激酶;LotR是一个效应蛋白,包含与c-di-GMP代谢有关的GGDEF和EAL结构域及REC结构域。证明LotS/LotR作为上游调控系统相应温度变化,通过下游转录因子Clp调控SmtP表达;同时发现LotR参与了温度调控的c-di-GMP水平[47](图6)。
3.3.2 群体感应 群体感应(quorum sensing,QS)是指微生物群体在其生长过程中,由于群体密度的增加,导致其生理和生化特性的变化,显示出少量菌体或单个菌体所不具备的特征。S.maltophilia的Sm1829/Sm1828与黄单胞菌中的双组分系统RpfC/RpfG具有较高的序列同源性。基因敲除及回补实验证明S.maltophiliaFF11中的Sm1829/Sm1828响应DSF分子调控,行使群体感应特性。这个系统能够调控胞外酶的活性,但是DSF仅在低温下能够调控胞外蛋白酶的表达(文章待发表)。
3.3.3 第二信使c-di-GMP
3.3.3.1 c-di-GMP 1987年,在木醋杆菌(Acetobacterxylinum)中,c-di-GMP作为纤维素合成酶异构激活因子由Benziman实验室首先发现[48],随后Benziman等鉴定和测序了控制c-di-GMP合成与降解酶类的编码基因,这些基因分别编码鸟苷酸环化酶(DGCs)和磷酸二酯酶(PDEs)。同时也发现,负责c-di-GMP代谢的DGCs和PDEs分别含有高度保守的GGDEF和EAL结构域,这两个结构域的命名来源于活性中心保守的序列基序Gly-Gly-Asp-Glu-Phe(GGDEF)和Glu-Ala-Leu(EAL)[49-50]。含有GGDEF、EAL和HD-GYP结构域的蛋白分布在各种细菌的基因组,水稻白叶枯病中约含25~26个,大肠埃希菌中约含36个,霍乱弧菌中含有66个,铜绿假单胞菌中含有38个,枯草芽胞杆菌中约含7个,表明c-di-GMP是一个广泛存在于细菌中的第二信使,它可以调控生物膜的形成、菌体的运动性、毒性因子的表达及细胞周期的分化等生理过程(如图7)[51]。

图7 细菌中c-di-GMP的生物学功能[51]Fig.7 Physiological functions of bacterial c-di-GMP[51]
DGCs的主要作用是能够把两个分子的GTPs合成为环二鸟苷酸(c-di-GMP);PDEs是把c-di-GMP降解成二核苷酸pGpG或者是GMP。鸟苷酸环化酶在GGDEF motif的两个亚单位形成一个二聚体,合成的二聚体具有DGCs的活性,二聚体中的每个亚单位会结合一个GTP底物分子,催化活性位点位于两个亚单位接触面A site之间[52]。除了A site活性位点之外,DGCs蛋白还具有参与Mg2+与GTP结合的活性位点,这些活性位点的突变会导致DGCs酶活性的丢失。此外,大多数的DGCs还含有RXXD 结构域,能与c-di-GMP结合,这种反馈调节避免了反应物GTP的大量消耗[53],如图8所示。

图8 鸟苷酸环化酶结构图[54]Fig.8 DGC structure[54]A:二鸟苷酸环化酶基序;B:二鸟苷酸环化酶二聚体及底物结合位点(A位点);C:二鸟苷酸环化酶二聚体及Mg2+与GTP结合位点A:DGCs motif;B:DGCs dimer with substrate binding site (A site);C:DGCs dimer with Mg2+ and GTP binding site
大多数有磷酸二酯酶活性的PDEs,在结构上都含有保守的EAL 基序或者EVL 基序,基序中氨基酸的突变会造成PDEs活性的丢失。除此之外,其他活性位点比如涉及Mg2+结合的位点或者与底物c-di-GMP结合的位点氨基酸残基发生突变,同样会造成PDEs活性的降低甚至丢失[55-56]。同DGCs类似,PDEs单体并没有催化活性,无活性的单体形成二聚体后才具有催化活性(图9)。

图9 含EAL结构域的磷酸二酯酶催化水解c-di-GMP[57]Fig.9 c-di-GMP hydrolysis catalyzed by EAL-PDE[57]
另外一种PDEs酶是含有HD-GYP结构域的HD家族蛋白,有活性的含有HD-GYP结构域的蛋白能够把c-di-GMP水解为中间产物pGpG,最终水解为GMP,表明HD-GYP同样可以行使EAL的功能[58]。目前,对于此结构域的蛋白研究比较详细的是RpfG,它是黄单胞菌群体感应中重要的组成元件,与RpfC组成一个能够响应群体信号分子DSF的双组分系统,其本身具有磷酸二酯酶的活性。如图10所示,DSF能够结合RpfC中位于细胞膜外的N端22个氨基酸组成的肽段,这种结合引起RpfC构型的改变,使其转换成激酶的状态,调控群体感应中各种基因的表达[59]。
许多蛋白同时包含GGDEF和EAL两种结构域,在目前鉴定的GGDEF-EAL蛋白中,这些蛋白往往表现一种酶活性,而失活的那部分结构域能够表现出调节活性[61-62]。但是对于Vibrioparahaemolyticus中的ScrC蛋白来说,ScrC同时具有DGC和PDE的活性,正向和反向调控菌体的运动性和附着力[63]。另外,生物信息学分析、体外酶活分析及结构与功能解析,不仅鉴定出有催化活性的DGCs和PDEs,而且也鉴定出一部分蛋白虽然含有GGDEF-EAL结构域,但是却没有催化活性,研究表明有些退化的含有GGDEF和EAL结构域的蛋白可以充当c-di-GMP受体的功能。
GGDEF蛋白中含有c-di-GMP的结合位点I-site,有些GGDEF蛋白虽然丧失了其催化能力,但I-site位点仍能保持其与c-di-GMP的结合能力。新月柄杆菌C.crescentus中,蛋白popA包含两个信号接收结构域和一个GGDEF结构域,体外证明popA蛋白的催化活性丧失,但却能结合c-di-GMP,c-di-GMP结合PopA在I-site后,能够调节PopA极端定位,从而调控菌体的细胞周期[64]。另外一个退化的GGDEF结构域蛋白是P.aeruginosa中的PelD,此蛋白与c-di-GMP结合后能够调控菌体胞外多糖PEL的生成及生物膜的形成,二级结构分析表明,PelD蛋白与其他的GGDEF蛋白有相似的结构,与c-di-GMP的结合取决PelD蛋白中的RxxD 基序,这种基序类似于DGCs中的I-site;然而,定点突变及表型分析表明,突变RxxD中的氨基酸残基并没有减少c-di-GMP与PelD的亲和性,却减少了胞外多糖PEL的产生[65]。
与退化的GGDEF结构域类似,一些失活的PDEs仍然保留结合c-di-GMP的能力,调控细胞的各项生理过程。目前鉴定的这些蛋白通常含有GGDEF-EAL串联结构域,典型的两个蛋白为P.aeruginosa中的FimX蛋白[66]和P.fluorescens中的LapD蛋白[67]。FimX蛋白可以控制菌体的随机运动性及IV型菌毛的装配,其蛋白结构包括N端的REC结构域、PAS结构域及串联的GGDEF-EAL结构域,体外证明FimX既不能合成c-di-GMP也不能降解c-di-GMP;然而,纯化的含有全部结构的FimX蛋白与单独的EAL结构域都表现出了极高的c-di-GMP结合能力[66]。进一步研究表明,FimX蛋白C端的EAL结构域与c-di-GMP的结合,诱导了N端的REC结构域及N端与C端连接区域的构型改变,从而影响了菌体的极端定位的改变;同时发现如果突变或者敲除FimX中的EAL,FimX蛋白丧失了与c-di-GMP的结合能力,表明EVL在FimX蛋白与c-di-GMP的结合上扮演着重要的角色[66,68]。LapD蛋白包含了涉及膜信号蛋白的HAMP结构域及GGDEF-EAL串联结构域,其与c-di-GMP结合表现出一种新的作用方式,可通过一种由内而外的信号转导机制,控制细胞表面黏附素LapA在表面的定位,从而调节菌体细胞膜的形成。进一步的研究表明,位于细胞质内的LapD蛋白的EAL结构域与c-di-GMP结合后,改变了LapD的构象,从而使信号经GGDEF-EAL传递至含有HAMP结构域的信号输出结构域,导致周质蛋白酶LapG无法剪切LapA的N端区域,从而保持了完整的LapA能够黏附在细胞的表面,导致生物膜的形成[69-70]。
3.3.3.2 c-di-GMP的代谢调控 参与c-di-GMP代谢的合成酶(DGCs)和降解酶(PDEs)受外界环境调控,这需要细胞能够精确地感受外界环境的信号并把这些信号传递到细胞内,从而能够参与c-di-GMP水平的调节[71]。DGCs和PDEs的活性受环境条件的控制是通过多种感受结构域与调控结构域与这些蛋白联合共同完成的,很多蛋白带有多种信号接收域,其胞内水平受多种胞外的信号控制。许多含有GGDEF、EAL和HD-GYP结构域的蛋白,往往含有多种信号输出和输入结构域,包括PAS、GAF、HAMP等感应外界信号的蛋白结构域和接受信号的REC调控元件,而感应信号的元件能够感应外界的小分子、氧化还原、光、电荷、营养、渗透压、抗生素等信号,这表明c-di-GMP的代谢可以受多种信号的调控[71]。
许多细菌中编码c-di-GMP代谢酶的蛋白带有很多预测的感应结构域,使细胞可以把很多环境信号转换为c-di-GMP水平。例如,基于数据库中P.aeruginosa基因组的信息,推测此菌含有大约41个c-di-GMP的代谢酶,而几乎每个代谢酶都包含至少一个预测的感应结构域[72]。c-di-GMP信号能够控制细胞的各项生理活动,所以细胞面对外界环境条件的改变,能够严密地控制c-di-GMP的水平。比如很多参与c-di-GMP代谢的蛋白都含有PAS感应结构域,这种感应结构域在血红素或核黄素等协同因子存在下能感应光、氧化还原物质和氧分子[73-74]。目前研究比较详细的参与c-di-GMP代谢的系统是大肠埃希菌中的DosC/DosP/PNPase系统,DocC是带有一个GCS感应结构域的鸟苷酸环化酶,DosP是带有一个PAS感应结构域的磷酸二酯酶[75]。虽然GCS与PAS两个感应结构域都能感受外界氧浓度,但是这两个感应结构域感应的氧浓度是不同的,当外界氧浓度低的时候,DocC通过GCS结构域以Kd= 20 μmol/L的亲和力与氧结合,从而激活鸟苷酸活化酶的活性,合成c-di-GMP;当外界氧浓度增加到一定范围的时候,DosP的PAS结构域以Kd>70 μmol/L的亲和力与氧分子结合,激活磷酸二酯酶的活性,从而降解c-di-GMP[76]。因此,细胞内c-di-GMP的水平根据氧浓度的不同而变化,而PNPase是RNA的调控酶,PNPase与mRNA形成复合物,这种复合物是c-di-GMP的受体,因此这个复合物的mRNA调控过程也是受氧的调控,这样氧水平的信息被DosC与DosP结合,并转化为c-di-GMP的信号,从而调控PNPase对mRNA的进程[77]。An等[78]研究也表明,RbdA作为具有磷酸二酯酶的蛋白,此蛋白也含有PAS氧感应的结构域,敲除氧感应区域或者突变此结构域的重要氨基酸,消除了RbdA对外界低氧的调控。感应外界环境信号的两个酶通常都含有REC的结构域,而REC的结构域是信号传导系统应答调节子的结构特征。具有REC与GGDE和EAL结构域的蛋白可以通过REC结构域能够接受外界信号的变化,从而可以调控整个蛋白的酶活性。对温度响应的含有GGDEF-EAL结构域的蛋白还未见报道。
4 展 望
细菌细胞作为感受温度的敏感元件分子呈现多样性。DNA主要通过分子完整性及拓扑异构构象变化来响应温度变化,通过调控基因的转录实现细胞生理生化特性改变。RNA分子主要通过位于编码基因mRNA 5′端的非编码区的二级结构(如发卡结构)阻碍蛋白质翻译的进行,来调控毒性因子、热休克及冷休克蛋白的形成。蛋白质分子作为温度感受元件,响应温度变化,调控细胞的生理生化特征,主要机制表现在基因转录的σ因子、分子伴侣等转录调控因子以及双组分系统;其中双组分系统调控多样性和复杂性最突出,虽然感应蛋白以组氨酸蛋白激酶HK、效应蛋白RR通过磷酸化或去磷酸化行使调控工程显示一定共性,但是详细的调控方式,特别是第二信使c-di-GMP进一步作用方式及机制存在诸多问题仍然是研究热点,也是有效实现微生物催化转化及防止食品腐败变质的关键技术基础。有效的研究策略主要是:转录差异是首要切入点,转录组分析及实时定量PCR技术是主要手段;基于生物信息学及全基因组的基因挖掘可有效在蛋白质作为感受元件方面,缩小目标范围,达到事半功倍效果;候选蛋白的过表达、基因敲除及回补、免疫学技术是经典的研究手段;细胞生理生化变化指标的检测基础还是色谱及光谱技术。

