改性氧化铝对四氧化二氮气体吸附的研究
胡继元,黄智勇
(火箭军工程大学,陕西西安710025)
四氧化二氮作为液体推进剂,可广泛运用于火箭和武器系统中。其具有高毒性,可以通过呼吸道或皮肤引发人员中毒甚至死亡,且具有较大的火灾和爆炸危险性,能与大多数有机物发生燃烧甚至爆炸。四氧化二氮沸点较低,一旦泄漏会迅速由液体转变成气体,形成红棕色烟,危险性极大。在四氧化二氮储库中,可能由于阀门或管路接口密封不严而出现少量的泄漏。目前,处理四氧化二氮气体的方法主要有化学破坏法、吸附法、催化还原法等[1]。针对于储库中少量四氧化二氮泄漏的问题,并考虑到储库空间狭小的现实情况,采用固体吸附法处理较为合适。
氧化铝是一种多孔、高分散度、表面性质稳定的材料,有较大的比表面积,是一种很好的吸附材料。大量研究表明,通过对氧化铝改性可以改变其表面结构,提高吸附能力。常用的改性方法有酸碱改性和负载金属改性。王晨晨等[2]用硫酸对氧化铝改性,提高了其对氟的吸附效果;尹方平等[3]用氢氧化钠对氧化铝改性,发现改性后的氧化铝对氟的吸附能力是未改性氧化铝的2~3倍。张晓帅等[4]用钙、镁对有序介孔氧化铝改性,研究了其对CO2的吸附能力,结果表明改性后的有序介孔氧化铝对CO2的吸附能力是未改性的1.2~1.4倍。笔者根据文献资料采用浸渍法,分别用硫酸、氢氧化钠、硝酸银对氧化铝改性,利用Autosord-iQ系列全自动比表面分析仪分析了改性后氧化铝的比表面积、孔容、孔径变化,运用静态吸附研究了其对四氧化二氮气体的吸附情况,探讨和分析了改性前后氧化铝吸附机理,考察了改性试剂、浓度、时间对吸附的影响。
1 实验
1.1 试剂与仪器
试剂:Al2O3(天津福晨化学试剂厂);硫酸、氢氧化钠、硝酸银,均为分析纯;实验用水为去离子水。
仪器:DHG-9140A型电热鼓风干燥箱、ML 204/02型灵敏天平(精度为0.1 mg)、Autosord-iQ系列全自动比表面分析仪、吸附装置(自制)。
1.2 改性氧化铝制备
改性步骤:1)用蒸馏水清洗氧化铝,去除颗粒表面的无机杂质,放入电热鼓风干燥箱中于200℃下烘干2 h,得到预处理的氧化铝;2)将0.005 mol的硫酸、氢氧化钠、硝酸银分别溶解于100 mL蒸馏水中,得到0.05 mol/L浸渍液体;3)将氧化铝分别放入浓度为0.05 mol/L的硫酸溶液、0.05 mol/L的氢氧化钠溶液、0.05 mol/L的硝酸银溶液中浸泡6 h后滤出,置于电热鼓风干燥箱中于200℃下烘干4 h,制成硫酸、氢氧化钠、硝酸银改性后的氧化铝。
1.3 改性氧化铝的表征
改性后的氧化铝的结构采用全自动比表面分析仪分析,通过氮气进行吸附脱附测量,运用BET方程计算比表面积,利用t-plot方法来计算微孔孔容和微孔表面积。
1.4 四氧化二氮吸附量的测定
利用重量法测定吸附量。四氧化二氮气体进入氧化铝吸附柱(约为1.0~2.0 g)中被吸附,当吸附柱质量在40 min内不再变化时则认为吸附达到平衡,通过灵敏天平称量吸附前后氧化铝吸附柱的质量变化,得到氧化铝对四氧化二氮的饱和吸附量[5-6],计算公式:

式中,Q为氧化铝的吸附量,mg/g;m1为吸附前氧化铝和吸附柱的总质量;m2为吸附后氧化铝和吸附柱的总质量;m0为吸附前氧化铝的总质量。
2 结果与讨论
2.1 改性前后氧化铝结构变化
分别用 H2SO4、NaOH、AgNO3溶液对氧化铝改性,改性前后氧化铝表面结构采用扫描电镜分析,结果见图1。由图1可见,氧化铝孔道尺寸及排列较为一致,具有一定的有序性。与改性前的氧化铝相比,H2SO4改性后的氧化铝微孔增多,比表面积增大;NaOH、AgNO3改性后氧化铝表面孔结构有不同程度破坏,使得微孔减少,从而导致改性后的氧化铝比表面减小。尽管改性后的氧化铝表面结构发生了一定程度的变化,但改性后氧化铝表面形貌特征变化均不是特别明显,孔结构仍是以介孔分布为主。

图1 不同改性试剂改性前后氧化铝的SEM照片
图2、图3分别为改性前氧化铝的孔径分布曲线和氮等温吸附脱附曲线。由图2可以看出,氧化铝孔径以介孔为主,孔径大小为2~6 nm。由图3可以看出,氧化铝的吸附曲线为朗缪尔Ⅳ型曲线,呈现典型的介孔结构特征。在p/p0为0.4~1.0时存在着明显的H1型迟滞环,表明氧化铝孔道的有序性良好[7]。

图2 氧化铝孔径分布曲线
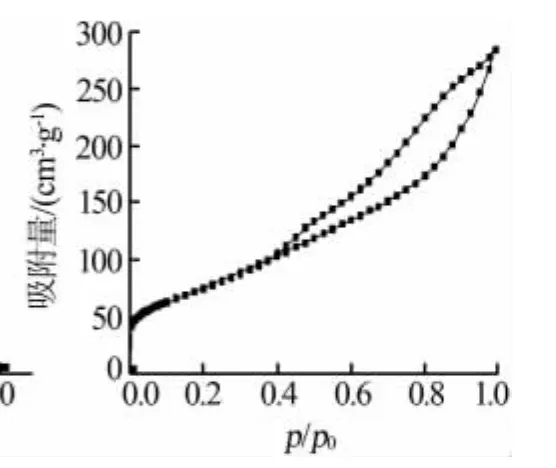
图3 氧化铝氮等温 吸-附脱附曲线
用 H2SO4、NaOH、AgNO3对氧化铝改性后,其比表面积、孔容、孔径都发生了变化,具体参数见表1。由表1可见,NaOH改性后的氧化铝比表面积减少5.6%,孔容和孔径分别增加了1.00%和6.6%,这可能是由于NaOH具有的强碱性,破坏了氧化铝内部结构导致比表面减少,氧化铝部分微孔和介孔被硫酸氧化侵蚀,导致孔径增大;H2SO4改性后的氧化铝比表面积、孔容、孔径分别增加了4.0%、8.9%和4.2%,这可能是由于化学浸渍过程中酸液对氧化铝具有一定蚀刻作用,使内部结构发生变化,氧化铝内部孔道打通形成微孔,导致表面积、孔容、孔径均有所增加;AgNO3改性后的氧化铝比表面积和孔容分别减少了9.8%和5.7%,孔径则增加6.8%,这可能是氧化铝表面负载了Ag+,造成部分孔道堵塞,从而导致比表面积和孔容有所减小[8]。

表1 氧化铝表面孔径结构分析
2.2 H2SO4、NaOH、AgNO3改性试剂对吸附的影响
采用静态吸附实验分别测定 H2SO4、NaOH、AgNO3改性氧化铝对四氧化二氮气体饱和吸附量的影响,结果见图4。从图4可以看出,氧化铝经过H2SO4、NaOH、AgNO3改性后,吸附饱和量都比未改性的氧化铝有所增加,其中NaOH改性后的氧化铝吸附效果优于H2SO4、AgNO3改性后的氧化铝。改性后,各氧化铝样品对四氧化二氮吸附能力大小依次为 NaOH>H2SO4>AgNO3>未改性。这可能是由于四氧化二氮为酸性气体,易吸附于略带碱性的氧化物表面[9],同时用NaOH改性增加了氧化铝的碱性位数量,从而提高其对四氧化二氮的吸附能力。从图4还可看出,吸附曲线在0~10 min时斜率较大,说明此时吸附剂的吸附速度较快,在40~60 min时斜率逐渐趋于平缓,表明此时吸附速率较慢。这是由于反应初期,四氧化二氮浓度梯度高,外部扩散占主导[10-11],吸附量迅速增加;随着吸附进行,四氧化二氮浓度梯度降低,内部扩散占主导,吸附速度逐渐趋于平缓。从实验结果来看,比表面积、孔容、孔径并不是影响吸附量的主要因素,很有可能是改性试剂令吸附剂表面结构发生了变化。
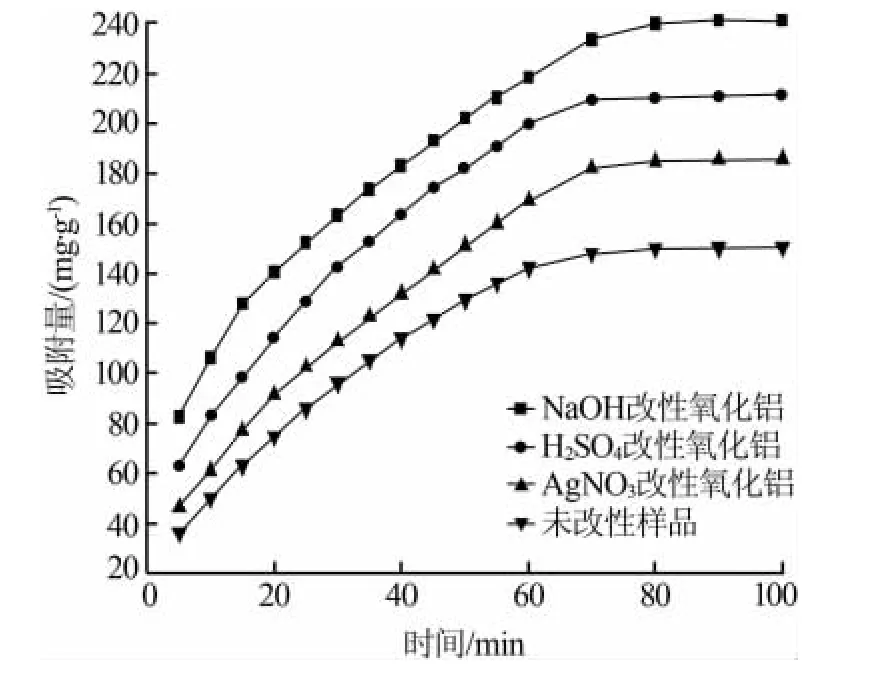
图4 不同改性剂对氧化铝改性后吸附四氧化二氮效能影响
2.3 NaOH改性氧化铝对对四氧化二氮的吸附研究
2.3.1 改性试剂浓度及改性时间对吸附量的影响
图5为改性6 h时,NaOH改性浓度对吸附性能的影响。由图5可知,改性浓度从0 mol/L增至0.5 mol/L,吸附量随改性浓度的增加迅速增大,当投加量由0.5 mol/L增至2.5 mol/L时,吸附量随改性浓度的增加逐渐减少。这可能是当NaOH浓度过大时严重破坏了氧化铝的表面结构,同时较大浓度的NaOH与氧化铝发生了化学反应,生成了更多的Al(OH)3沉淀物导致了其表面堵塞,从而减少了吸附量。当改性浓度为0.5 mol/L时,氧化铝对四氧化二氮的最大吸附量达到了254 mg/g。
采用0.5 mol/L氢氧化钠溶液对氧化铝改性,研究了不同改性时间下对四氧化二氮吸附量的影响,结果见图6。由图6可知,当改性时间为4 h时吸附量最大,此时氧化铝的改性已经达到理想的改性效果;随着改性时间的延长,生成的Al(OH)3沉淀物影响了氧化铝的表面结构,从而导致对四氧化二氮的吸附量逐渐减少。

图5 改性浓度对吸附效果的影响

图6 改性时间对吸附 效果的影响
2.3.2 氧化铝再生吸附性能的研究
利用焙烧法对吸附后的氧化铝进行再生,结果见图7。由图7可见,每次再生后的氧化铝的吸附量均有一定程度的下降,再生1次和再生2次的吸附量分别下降了5%和15%。这是由于采用焙烧法未能将吸附的四氧化二氮全部处理掉,也有可能经过反复焙烧破坏了氧化铝表面的碱性基团。实验表明,该吸附剂经2次再生后,氧化铝对四氧化二氮的吸附量虽有所下降,但总体效果依然良好。

图7 改性氧化铝再生后对四氧化二氮的吸附效果
3 结论
1)运用 H2SO4、NaOH、AgNO3对氧化铝改性,氧化铝表面结构都发生了明显的变化,改性后的氧化铝对四氧化二氮的吸附效果均得到了提高;2)采用NaOH对氧化铝改性,其吸附四氧化二氮效果最好,改性后的吸附量是未改性的1.6倍,表明酸性气体四氧化二氮易吸附于略带碱性的氧化物表面;3)研究了氢氧化钠改性试剂浓度以及改性时间对吸附量的影响,当改性试剂浓度为0.5 mol/L、改性时间为4 h时,吸附效果最佳;4)再生后的改性氧化铝吸附四氧化二氮的效果依然很好,1次再生后的吸附容量可以恢复到原来的95%。
[1]李亚裕.液体推进剂[M].北京:中国宇航出版社,2011.
[2]王晨晨,段颖,徐微,等.活性氧化铝改性除氟性能研究[J].安徽农业大学学报,2014,41(2):248-252.
[3]尹方平,王东田,时海平,等.氢氧化钠改性活性氧化铝除氟效能研究[J].给水排水,2009,35(S1):205-207.
[4]张晓帅,赵瑞红,许永权,等.钙镁改性有序介孔氧化铝对电厂尾气 CO2吸附性能的研究[J].化工新型材料,2015,43(1):229-231.
[5]Sun H,Li A,Zhu Z,et al.Superhydrophobic activated carbon-coated sponges for separation and absorption [J].Chem.Sus.Chem.,2013,6(6):1057-1062.
[6]刘寒冰,杨兵,薛南冬.酸碱改性活性炭及其对甲苯吸附的影响[J].环境科学,2016,37(9):3671-3678.
[7]柴彤,赵瑞红,栗明宏,李宣民.氨基改性有序介孔氧化铝吸附二氧化碳性能研究[J].无机盐工业,2016,48(12):14-18.
[8]Wen H C,Yang K,Ou K L,et al.Effects of ammonia plasmatreatment on the surface characteristics of carbon fibers[J].Surface and Coatings Technology,2006,200(10):3166-3169.
[9]王亚坤,赵瑞红,冯晓霞,等.氨基化有序介孔氧化铝合成及吸附 CO2性能研究[J].材料导报,2012,26(8):71-74.
[10]张小磊,李尚明,李红艳,等.负载镧镁改性活性氧化铝的除氟性能[J].环境工程学报,2016,10(8):4189-4195.
[11]刘琼,郭华明.活化铁锰结核的除氟性能研究[J].环境科学,2009,30(8):2263-2270.

