沉默β-catenin表达对胃癌细胞5-Fu敏感性的影响
潘安萍 朱建伟⋆ 杨跃
胃癌的发病率占全球恶性肿瘤的发病率的第四位,其病死率占全球癌症相关死亡的第二位,并随着世界人口的增多及人口老龄化的演变,胃癌的发病人数还在不断增加[1]。β-catenin是一多功能连环蛋白质,主要位于细胞膜,在恶性肿瘤细胞中普遍高表达,与恶性肿瘤细胞的增殖、凋亡、侵袭转移、药物敏感等多种生物学行为密切相关[2]。本研究拟通过沉默胃癌细胞内β-catenin蛋白表达,探讨β-catenin蛋白表达量与胃癌细胞化疗药物敏感性之间的关系。目前5-氟尿嘧啶(5-Fu)与顺铂两药联合方案是临床胃癌化疗的基础治疗方案[3]。5-Fu被广泛证实在胃肠道肿瘤治疗中能使患者生存获益,含5-Fu的两药联合方案是胃癌临床研究中常见的对照方案[4]。因此,本实验选择5-Fu药物来探讨β-catenin对胃癌细胞耐药的影响。并初步探讨其可能的分子机制。
1 材料和方法
1.1 胃癌细胞及主要试剂 AGS、MGC803细胞株购自上海博谷生物科技有限公司。β-catenin-RNAi慢病毒液、空载体慢病毒液购于上海吉玛公司;RT-PCR试剂盒购于美国Sigma公司;兔抗人β-catenin单克隆抗体购于美国Santan Cruz公司;羊抗鼠、兔IgGHRP单克隆抗体均购于中杉金桥公司。
1.2 细胞培养 胃癌AGS、MGC803用含10%胎牛血清的RPMI-1640培养基于37℃、5%CO2的细胞培养箱中常规培养,传代1次/2d,按1:3比例传代。
1.3 实验分组 分别将慢病毒载体β-catenin-RNAi慢病毒液及空载慢病毒液分别感染AGS及MGC803细胞,实验分组:实验组(感染β-catenin-RNAi慢病毒液的AGS-RNAi、MGC803-RNAi)、阴性对照组(感染空载慢病毒的AGS-Neg、MGC803-Neg)、空白对照组(未处理的AGS、MGC803)。
1.4 病毒感染 将两株细胞稀释成1×104/ml,种6孔板,待细胞贴壁后实验组及阴性对照组细胞每孔滴加各自慢病毒液,正常细胞组加入等体积的完全培养基。24h后给细胞换液,3d后荧光倒置显微镜下观察荧光显示情况。转染效率=带绿色荧光细胞数/总细胞数×100%。
1.5 Western blot分析各组细胞内β-catenin的表达量 蛋白提取试剂盒提取各组细胞总蛋白,蛋白分析试剂盒分析蛋白浓度。配置聚丙烯凝胶,各组蛋白均取20μl行蛋白电泳,后将目的蛋白条带转移至NC膜,5%的脱脂奶粉封闭1h,一抗(1∶1000)4℃封闭过夜,二抗(1:2500)室温封闭1h。暗室中滴加发光液后进行曝光、显影、定影,得到的胶片可行结果分析,以β-ation为内参。
1.6 RT-PCR 分析各组细胞内β-catenin在基因水平表达情况,用Trizol提取各组细胞内的总RNA,用分光光度计测量提取的RNA的浓度,用逆转录试剂盒进行RNA的逆转录,用RT-PCR试剂盒进行RTPCR。
1.7 MTT法检测各组细胞在不同浓度的5-Fu条件下的存活情况 各组细胞均稀释至104/ml备用。5-Fu药物共设7个药物浓度梯度:20、10、5、2.5、1.25、0.625、0.3125μg/ml。种96孔板:实验组及对照组每孔加细胞悬液100μl,调零组每孔加100μl的完全培养基,每组均设置4个复孔。每组实验细胞均种3板,分别于药物作用24h、48h、72h后取出测量。取出的96孔板每孔加20μl MTT溶液,置培养箱中4h后终止,每孔加入150μl二甲基亚砜,低速振荡10min,在酶联免疫检测仪490nm波长处测值。
1.8 统计学方法 采用SPSS 17.0统计软件。计量资料以(x±s)表示,组间比较采用方差齐性检验。计数资料的比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组细胞的转染情况 转染4d后,荧光显微镜下观察各组细胞的荧光显示情况与普通光镜下作对比,实验组、阴性对照组细胞显示强绿色荧光,且带绿色荧光的细胞数占总细胞数比例均>80%,而空白对照组细胞无绿色荧光,两组细胞荧光显示情况见图1。
2.2 各组细胞内β-catenin mRNA表达水平 RTPCR结果以2-ΔΔCt值为观察指标,AGS、AGS-Neg、AGS-RNAi分别为2.09±0.13、2.00±0.10、1.04±0.08;MGC803、MGC803-Neg、MGC803-RNAi分 别 为1.11±0.07、1.23±0.12、0.45±0.06。两株胃癌细胞均显示实验组细胞内β-catenin在基因水平较阴性对照组及空白对照组降低(P<0.05),但阴性对照组及空白对照组之间差异无统计学意义(P>0.05)。
2.3 各组细胞内β-catenin蛋白表达量 Western blot得出的蛋白条带如图2。Image J测出各组细胞内β-catenin蛋 白 相 对 表 达 量,AGS、AGS-Neg、AGS-RNAi分 别 为1.0371±0.0712、1.0667±0.0273、0.2452±0.0032;MGC803、MGC803-Neg、MGC803-RNAi分 别 为0.8725±0.0110、0.8593±0.0074、0.4220±0.0164。实验组细胞内β-catenin蛋白表达均较阴性对照组及空白对照组降低(P<0.05),阴性对照组及空白对照组之间差异无统计学意义(P>0.05)。
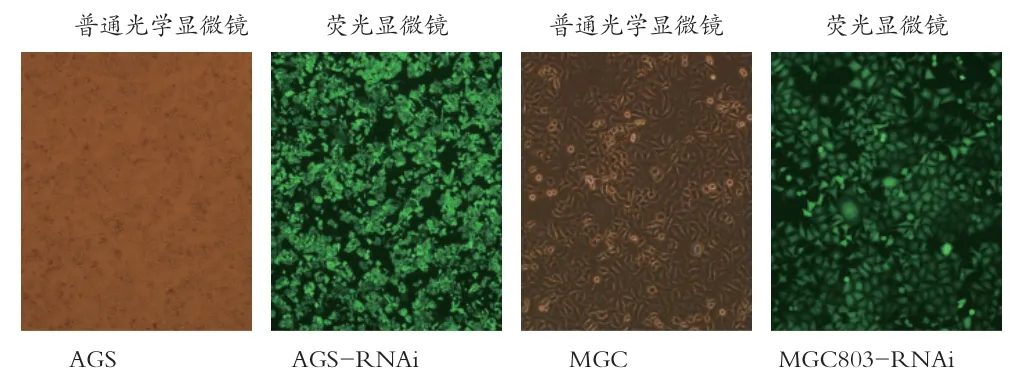
图1 实验组细胞慢病毒感染后荧光显微镜及普通显微镜对比图(×100)
2.4 β-catenin表达下调对胃癌细胞5-Fu敏感性的影响 MTT检测结果显示:相同浓度的5-Fu作用24h后对两株实验组细胞的抑制率明显高于其相应阴性对照组(P<0.01)。而相同浓度的5-Fu作用24h后对阴性对照组细胞及空白对照组细胞之间的增殖抑制率无明显差异(P>0.05)。相同浓度的5-Fu作用48h、72h后均得到类似的结果。
2.5 β-catenin表达下调对胃癌细胞中DPD、TS及P-gp表达的影响 Western blot检测条带如图3。TS、P-gp在实验组细胞中表达量较阴性对照及空白对照组均低(P<0.01),而阴性对照组与空白对照组间无明显差异(P>0.05);DPD蛋白表达量在各组间均无明显差异(P>0.05)。

图3 各组细胞内DPD、TS、P-gp蛋白表达条带与内参条带对比图(注:1~6分别指AGS、AGS-Neg、AGS-RNAi、MGC803、MGC803-Neg、MGC803-RNAi)
3 讨论
胃癌是一种常见疾病,具高发病率及病死率。随着医学发展,部分肿瘤通过早发现、用新药、多学科联合等多种手段,疾病控制率已明显改善,然而胃癌疾病控制率及病死率一直居高不下。除了近年来胃癌治疗的有效新药更新外,还与现有的化疗药物耐药严重有关。几乎临床化疗的胃癌患者在治疗过程中应用过5-Fu或其衍生物。但5-Fu的耐药性问题不容忽视。β-catenin是Wnt信号通路中的关键蛋白,其被发现与肿瘤密切相关。β-catenin可通过影响Wnt信号通路下游的靶蛋白的表达来影响肿瘤细胞的多种生物学行为,其中除了细胞增殖、凋亡、侵袭转移外,还能够影响肿瘤细胞的化疗药物敏感性[2]。但是目前对于β-catenin与肿瘤化疗药敏之间关系的研究多数是在肠癌、乳腺、肝癌等中开展,对于胃癌细胞的研究尚少[5]。因此本研究选取β-catenin相对高表达的AGS、MGC803两株胃癌细胞进行研究,以探讨β-catenin蛋白表达对胃癌细胞5-Fu敏感性的影响。
本研究通过下调胃癌细胞AGS及MGC803中β-catenin蛋白表达,然后测量不同浓度的5-Fu药物对慢性病毒感染前后细胞增殖率的影响。结果发现,下调了β-catenin蛋白表达之后的两株胃癌细胞均对多个浓度的5-Fu较正常细胞出现更明显的生长抑制,且AGS细胞株差异更显著。作者猜测可能与沉默β-catenin蛋白表达效率在AGS细胞要高于MGC803细胞有关。因此,β-catenin低表达的细胞,对5-Fu药物更敏感,而β-catenin高表达的胃癌细胞,易产生5-Fu耐药。
目前国内外研究显示,胃癌细胞耐药与多药耐药(MDR)机制有关。MDR相关基因ABCB1编码的一种P-糖蛋白(P-gp)在细胞内能作为一种转运泵将多种细胞毒药物转运至胞外使得胞内药物低水平,进而降低药物疗效引发耐药[6]。近年来发现β-catenin作为转录因子能调控P-gp表达从而参与癌症耐药[7]。但是5-Fu的耐药机制除了与MDR机制有关外,还有其自身特殊的机制。研究较多的是二氢嘧啶脱氢酶(DPD)及胸苷酸合成酶(TS)。DPD是5-Fu代谢的关键酶,其表达上调能加速5-Fu的降解从而降低药物疗效,有研究证实DPD的表达量与肠癌、食管癌的疗效密切相关[8]。TS是5-Fu作用的靶酶,5-Fu与TS结合形成复合物能干扰DNA的合成,从而导致细胞死亡。研究证实TS低表达的肠癌患者更易从5-Fu为基础的化疗中获益且预后相对更好[9]。
目前国内外关于肿瘤细胞5-Fu耐药机制的研究众多,基本明确与TS、DPD酶的表达量密切相关,且目前这类研究主要在肠癌细胞中进行[8],关于胃癌细胞与5-Fu药物敏感性之间的研究文献不多,且尚无研究通过影响β-catenin蛋白表达来观察其下游靶分子(TS、DPD、P-gp)表达异常后胃癌细胞对5-Fu敏感的变化,从而探讨β-catenin蛋白表达与胃癌细胞5-Fu耐药之间的关联性,因此,本研究通过沉默β-catenin蛋白表达,初步探索胃癌细胞5-Fu耐药进一步可能机制。
本研究得出β-catenin下调后的胃癌细胞内P-gp、DPD及TS的表达量也有部分改变。实验组细胞中DPD的表达量与对照组无明显差异,但P-gp及TS的表达量在实验组细胞中均出现有统计学差异的下调。P-gp作为Wnt信号通路的下游靶蛋白,有可能参与了β-catenin对胃癌细胞5Fu敏感性的影响。但目前少有研究证实TS为β-catenin的下游靶蛋白,但是靶向Wnt信号通路其他成分间接通过TS酶影响5-Fu敏感性的研究已在肠癌、卵巢癌及口腔癌中有证实[5,9]。就目前来说,虽然关于TS酶表达与5-Fu敏感性之间的关系尚有争议,但是大部分研究认为TS酶的表达量高的细胞更易产生5-Fu耐药。且本研究同样发现下调β-catenin表达后的胃癌细胞对5-Fu敏感性增强,同时TS酶的表达量下调。因此,β-catenin对胃癌细胞5-Fu敏感性的影响有可能是通过影响细胞内P-gp及TS蛋白表达来实现。

