D-D值与急性主动脉夹层预后的相关性研究
贾炳学
急性主动脉夹层(Acute aortic dissection,AAD)作为临床常见心血管急危重症,近几年患病率呈上升趋势,起病急骤,进展迅速,临床表现复杂多样,目前病因尚未完全明确[1]。据统计,若未及时对AAD采取有效治疗,发病1d内病死率高达33%,发病2d后达50%;2周内Stanford A型AAD病死率达75%,3个月后达90%[2]。有报道称主动脉夹层发生的病理生理过程与血清生化物密切相关,而目前常见外周血生化标记物包括金属基质蛋白酶、C反应蛋白、N末端B型脑钠钛前体、D-二聚体(D-dimmer,D-D)等,由于外周血生化标记物诊断快速,具有非侵入性,且无需对操作人员进行特殊培训,故而使生化检查在AAD诊断方面具有重要价值,尤其是D-D,阳性率较高,为AAD早期快速诊断及预后评估带来希望[3-4]。但目前关于外周血生化标记物检测与AAD预后的关联性尚缺乏系统性研究。本文主要深入探究D-D值与急性主动脉夹层预后的相关性,报道如下。
1 临床资料
1.1 一般资料 采用随机平行对照方法纳入2014年1月至2018年1月于本院收治的237例AAD患者为研究对象,开展前瞻性随访研究,本研究获本院医学伦理委员会批准。237例患者中男186例,女51例;年龄37~78岁,平均(54.18±12.17)岁。纳入标准:(1)符合《主动脉夹层腔内治疗指南》[5]中相关诊断标准,均经胸片、心电图、超声心动图、CT、磁共振成像等检查确诊为AAD者。(2)发病在14d以内,均接受内、外科治疗者。(3)对本研究知情且签署同意书。排除标准:(1)合并肝肾功异常、心脏衰竭、肺栓塞者。(2)伴有冠状动脉疾病、感染性疾病及癌症者。(3)近期手术史或服用抗感染药物者。
1.2 治疗方案 所有患者入院后均接受内、外科治疗,其中内科治疗包括β受体阻滞剂(倍他乐克、氨酞心安等)、血管紧张素转换酶抑制剂(蒙诺、安博维等)、钙拮抗剂(伲福达等)及硝普钠/压宁定、双氢克尿噻、速尿等药物,维持生命体征,降压,控制心率,改善心功能;外科治疗包括Bentall手术、升主动脉置换术、全主动脉弓置换等。根据患者实际病情,选择合适的治疗方式。
1.3 D-D检测方法 所有患者分别于入院当日(或次日)及出院前1d清晨采集血液样本,抽取空腹肘静脉血约4ml,置入不含抗凝剂的真空管内,室温静置20min后,以2500r/min速度离心20min,留取上清液。采用美国贝克曼ACL7000全自动凝血分析仪,以酶联免疫吸附法(ELISA)测定D-D水平,试剂盒为美国ABI公司产品,操作方案严格参考仪器及试剂说明书。正常人D-D参考值<0.5mg/L。
1.4 观察指标 (1)统计患者基线资料,包括姓名、年龄、性别、就诊时间、既往史(是否合并高血压、糖尿病、高血脂症、马凡氏综合征及吸烟史)、入院时生命体征(心率、收缩压、舒张压)、入院时生化资料(胆固醇、甘油三脂、低密度脂蛋白、高密度脂蛋白、血钾、血镁、血钙、白细胞计数、C反应蛋白、D-D)等。(2)观察住院期间患者预后情况。以不良预后为终点,包括全因死亡、肾功能不全、心包积液、主动脉瓣关闭不全等。按是否出现不良预后,将患者划分为预后不良组和预后良好组。
1.5 统计学方法 采用SPSS 19.0统计软件。计量资料以(x±s)表示,组间行t检验;计数资料以%表示,组间行χ2检验。采用ROC曲线评价D-D对AAD不良预后的预测价值,并确定上述检测指标的最佳截断值,P<0.05为差异有统计学意义。
2 结果
2.1 患者预后分析 237例患者住院期间存活127例,占53.59%,归入预后良好组。死亡45例,占18.99%;肾功能不全21例,占8.86%;心包积液16例,占6.75%;主动脉瓣关闭不全23例,占9.70%;其它不良事件5例,占2.11%,110例均归入预后不良组。2.2 预后良好组与预后不良组基线资料比较 预后良好组Stanford A型所占比例及D-D水平显著低于预后不良组(P<0.05),收缩压、舒张压显著高于预后不良组(P<0.05),其它基线资料与预后不良组比较差异均无统计学意义(P>0.05),见表1。
2.3 D-D对AAD不良预后的预测价值 经ROC曲线处理,结果显示D-D对AAD患者不良预后有一定预测价值,曲线下面积为0.941(标准误0.018,P<0.001,95%CI=0.905~0.976),预测不良预后的最佳截断值为4.845mg/L,此时敏感度0.973,特异度0.772,见图1。
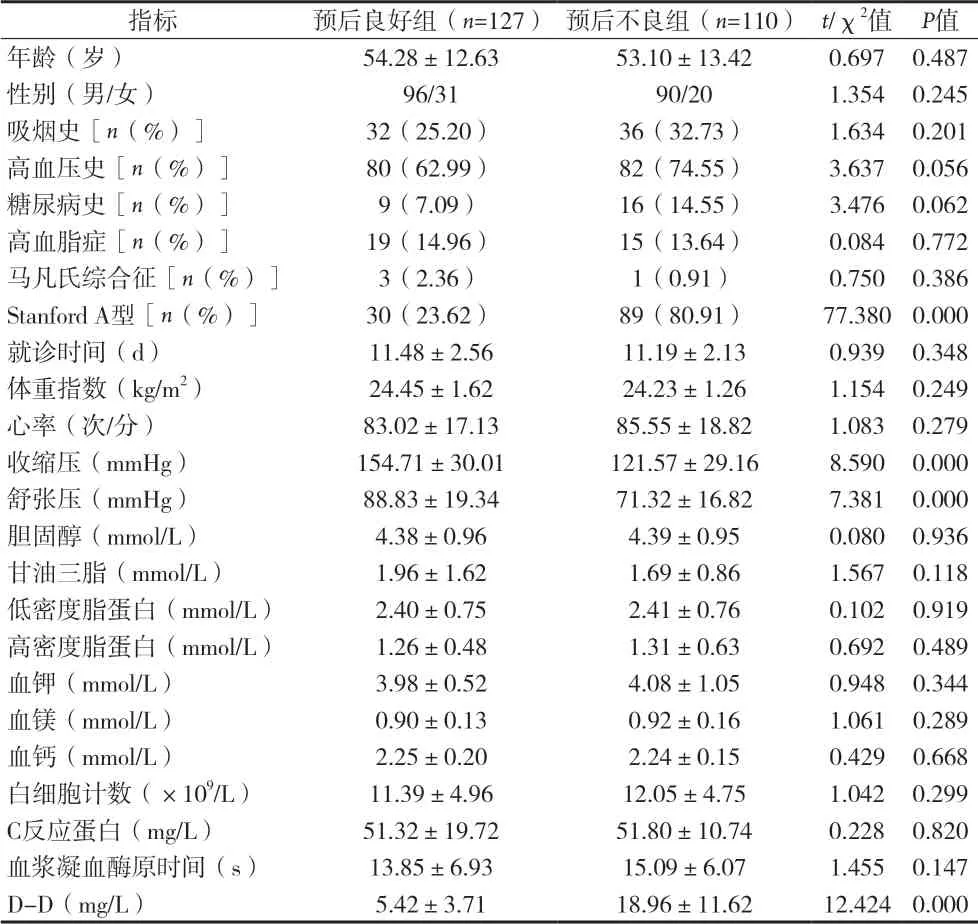
表1 预后良好组与预后不良组基线资料比较(x±s)
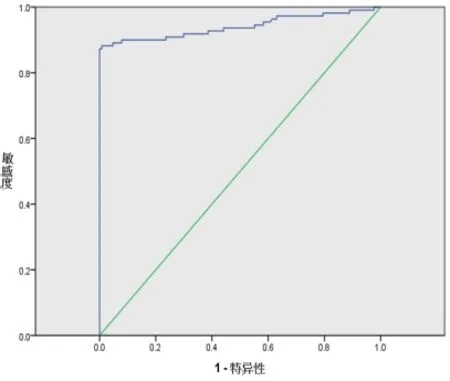
图1 D-D预测AAD不良预后ROC曲线
3 讨论
有报道称AAD的发生与纤维蛋白溶解系统有密切联系,AAD发生后,由于主动脉壁被破坏,导致外源性凝血途径被激活,纤溶系统亦被激活;而主动脉壁损伤后会释放相应组织因子,伴随着病情进展,假腔内血流速度逐渐减慢,于假腔内形成血栓,导致纤维蛋白溶解系统被激活,诱导弹性蛋白、交联纤维蛋白等血管壁成分降解[6]。而D-D作为由纤维蛋白原激活后降解生成的一种特异性产物,在钙离子等作用下会诱发聚合反应,形成纤维蛋白多聚体,于纤溶酶水解后生成特异性降解片段[7]。因此,诸多学者认为D-D可作为一种特异性降解产物,较大程度上能反映机体纤系统溶活性与凝血功能,行D-D浓度检测,可掌握标志物反应是否呈高凝及纤溶充进状态[8-9]。近年来,对D-D的研究多集中于血栓性疾病(如急性肺栓塞、静脉血栓形成等)诊断中,而关于其与AAD预后的相关性报道仍存在一定争议。
本研究结果显示,预后良好组D-D水平明显低于预后不良组,经ROC曲线处理,结果显示,D-D对AAD患者不良预后有一定预测价值,预测不良预后的最佳截断值为4.845mg/L,此时敏感度0.973,特异度0.772。李丹丹等[10]报道D-D是AAD患者住院期间预后的独立因素,通过ROC曲线探讨D-D水平对AAD患者死亡的预测价值,发现其最佳临界点为4.85mg/L,敏感度为85.7%,特异度为75.8%,其最佳临界点与本文研究结论相似。有研究称AAD患者中死亡患者血清中D-D浓度明显高于生存患者,使用ROC曲线分析,发现应用D-D来判断死亡率时具有较高的灵敏度及特异性,其临界值为5.50μg/ml,判断院内死亡敏感性为92.9%,特异性为75.9%,其最佳临界值与本文结论有所出入,可能与本文研究样本量的大小有关[11]。另有报道通过对AAD患者进行大规模研究,发现D-D对AAD患者死亡有一定预测价值,其最佳临界值为5.67mg/L,这与本文研究略有出入,可能与样本量大小及抽血时间有关。推测D-D在AAD发生后升高的可能机制,AAD发生后破坏主动脉中层,致使血液侵入内外膜形成假腔,由于真假腔内血液流动速度存在较大差异,于假腔内流动速度较为缓慢,易引起血栓形成,导致纤溶系统被激活,最终促使D-D水平升高[12]。而D-D水平与夹层血管撕裂长度、范围大小等因素有关,AAD发生时病变范围越广泛,被激活的继发性纤溶反应与凝血反应越剧烈,故D-D水平越高[13]。国外也有报道称AAD患者D-D水平增高幅度与主动脉夹层累及范围呈正相关,与病程长短呈负相关[14]。在本研究中,急性期死亡的AAD患者血浆D-D水平明显高于存活的AAD患者,可能是因为D-D水平越高,提示夹层撕裂范围越大,病变越严重,故而病死率越高,预后越差。因此,作者认为,D-D水平可作为AAD患者预后评估参考指标。此外,有研究证实,D-D对AAD死亡的预测价值可能受病变分型影响,Stanford A型夹层病死率较高[15]。本研究中,预后不良组Stanford A型所占比例明显高于预后良好组,多因Stanford A型夹层撕裂范围广,激活的纤溶反应及凝血反应伴随着动脉血管累及范围的逐渐扩大而相应剧烈,所产生的纤溶特异性降解产物D-D也逐渐增多,故预后较差[16]。
本研究虽证实D-D与AAD预后存在相关性,但仍存在一些不足之处,如样本量选取偏小,研究时间有限,缺乏夹层具体影像学资料分析,有一定的选择偏倚性;患者院外随访资料缺乏,未评估手术远期并发症及预后。另外,本文中未涉及实验室指标联合检查对AAD预后判断的分析,故今后仍需深入调查取证。
——以渤海A 油藏为例

