人HDAC6基因的原核表达纯化和初步功能检测
陈志达,张鹏飞,郗洪庆,戴广海,卫 勃,陈 凛
解放军总医院,北京 100853 1普通外科;2普通外科研究所;3肿瘤内科
组蛋白去乙酰化酶HDAC6是细胞质中存在的一种重要的去乙酰化酶,在人体内的分布具有组织特异性,在心、肝、肾、胰等脏器中高表达[1]。1999年,Grozinger和Verdel两个独立的研究小组通过克隆方法首次获得了hdac6基因。研究发现hdac6基因定位于Xp11.23染色体上,大小约为3 645 bp,转录翻译后HDAC6由1 215个氨基酸组成[2]。HDAC6作为一种重要的去乙酰化酶通过使特异性底物脱掉Lys(赖氨酸)乙酰基来维持组蛋白乙酰化和去乙酰化的平衡。现有研究已经确认的HDAC6底物主要有微管蛋白a-tubulin、热休克蛋白Hsp90和皮质肌动蛋白Cortactin[3]。近年来研究表明,诱发肿瘤发生的一个重要的分子学机制是组蛋白表观修饰乙酰化和去乙酰化相互竞争的平衡被打破。HDAC6通过去除组蛋白的乙酰基调控其他转录过程,对肿瘤的发生发展起到十分关键的作用[4]。已有研究发现在乳腺癌、卵巢癌、肺癌、前列腺癌、口腔癌等恶性肿瘤中均存在HDAC6高表达现象[5-7]。为进一步研究HDAC6的功能特点,我们设计hdac6引物并扩增出基因编码区全长,将其构建在原核表达载体上,通过诱导纯化的方式获得HDAC6的融合蛋白,然后用还原性谷胱甘肽进行洗脱后使微管蛋白a-tubulin去乙酰化,并初步验证其功能,为深入研究去乙酰化酶HDAC6在调控肿瘤发生、发展过程中发挥的作用奠定了实验基础。
材料和方法
1 pGEX-KG原核表达 载体、DH5α大肠埃希菌和BL21感受态细胞、人乳腺文库为本室保存。限制性核酸内切酶XbaⅠ和HindⅢ、T4 DNA连接酶和PCR试剂购自于宝生物工程(TaKaRa)有限公司;琼脂糖凝胶DNA胶回收试剂盒采购自天根(北京)生化科技有限公司;PCR引物由赛百盛公司合成;GST-Sepharose 4B购自Pharmacia;GSTHRP、ac-tubulin、α-tubulin抗体购自圣克鲁斯(上海)生物技术公司(Santa Cruz);测序由奥科鼎盛生物科技有限公司(北京)完成。
2 去乙酰化酶HDAC6全长编码区基因的扩增结合赛百盛公司提供的引物设计原则,根据文献报道的去乙酰化酶HDAC6序列我们设计合成引物。上游引物:5'-GCTCTAGACATGACCTCAACCG GCCAGG-3';下游引物:5'-CCCAAGCTTTTAGTG TGGGTGGGGCATATC-3',其中上游引物中包含限制性核酸内切酶XbaⅠ的酶切位点,下游引物中包含限制性核酸内切酶HindⅢ的酶切位点。以人乳腺文库为模板,利用PCR多聚酶链式反应的方法扩增HDAC6序列。按以下条件进行HDAC6编码区全长的扩增[8]:1.95℃环境预变性,时间5 min;2.95℃环境正式变性,时间30 s;3.58℃环境退火,时间30 s;4.72℃环境延伸,时间5 min。将上述4个步骤循环进行31次,然后行最后一次延伸,温度要求72℃环境,延长时间7 min。扩增得到的DNA产物用10 g/L琼脂糖凝胶进行电泳检测,若为目标DNA,最后以琼脂糖凝胶DNA回收试剂盒回收提取PCR产物。
3 重组表达质粒的构建及鉴定 以限制性内切酶XbaⅠ和HindⅢ双酶切pGEX-KG表达载体,37℃环境下酶切4 h,继而在浓度为10 g/L的琼脂糖凝胶进行电泳、胶回收载体大片段;以同样的方法将PCR片段回收产物进行双酶切,形成特异性黏性末端的双链DNA,使用T4-DNA连接酶接入pGEX-KG表达载体中,16℃恒温下连接处理12 h。接下来,转化DH5α大肠埃希菌菌株,挑取适宜的单克隆菌落,摇菌培养并提取质粒。用限制性内切酶XbaⅠ和HindⅢ双酶切鉴定。酶切鉴定正确的克隆送奥科鼎盛生物科技有限公司(北京)测序。
4 GST-HDAC6融合蛋白的小量诱导表达鉴定选取鉴定正确的重组表达质粒,使用DH5α感受态细胞进行转化,然后挑选适应的阳性单克隆或菌落,加入到LB溶液中,37℃环境震荡培养2 ~3 h。使用分光光度仪测试溶液浊度,若达到A600nm=0.7 ~ 0.9,加入诱导剂 IPTG(异丙基硫代半乳糖苷),致其最终浓度为1 mmol/L,继续在37℃环境中,连续震荡培养4 h。培养结束后12 000 r/min高速离心,丢弃上清液,保留菌体沉淀以备进行SDS-PAGE染色和Western blot蛋白含量检测。
5 GST-HDAC6融合蛋白的纯化与洗脱 将转化重组质粒pGEX-KG-HDAC6和表达载体pGEXKG的BL21感受态菌株接种于含有氨苄青霉素(Ampicillin)的LB液体培养基中,37℃恒温环境震荡培养4 ~ 9 h,过夜活化。按2%的体积比例,吸取活化的溶液转种于另一组LB液体培养基中,30℃恒温环境震荡培养,使用分光光度仪测试溶液浊度,若达到A600nm=0.5 ~ 0.6,加入诱导剂IPTG(异丙基硫代半乳糖苷),致其最终浓度为0.1 mmol/L。将培养基转至20℃恒温环境,继续持续震荡培养20 h。培养结束后12 000 r/min高速离心,丢弃上清液,保留菌体沉淀,按照法玛西亚(Pharmacia)公司提供的实验说明完成融合蛋白的纯化:1)在收集到的菌体中加入裂解液,4℃环境(通常冰浴)进行超声波裂解、破碎;2)设置离心机转速为12 000 r/min,离心收集裂解液上清;3)在上清液中加入适量琼脂糖凝胶GST-Sepharose 4B,持续4℃环境旋转结合4 h;4)低速离心离心收集琼脂糖凝胶GST-Sepharose 4B颗粒,转速维持在3 000 r/min;5)最后采用SDS-PAGE染色的方法鉴定融合蛋白的纯化效果。
6 去乙酰化实验检测目标蛋白的活性 具体实验方法参考文献[9]:利用还原性谷胱甘肽小量(35µl/次)多次将GST-HDAC6从beads上逐渐洗脱,同时洗脱GST蛋白作为阴性对照。使用RIPA裂解293T细胞,并对裂解的细胞蛋白进行定量分析。将洗脱后的10µg还原性谷胱甘肽与含有30µg蛋白的RIPA裂解液混合加入到反应溶液中,37℃共同孵育2 h后,进行SDS-PAGE以及放射显影[反应溶液的成分为15 mmol Tris(pH 7.9)、10 mmol NaCl、0.25 mmol EDTA、10 mmol b-2-mercaptoethanol和 10% glycerol]。
结 果
1 去乙酰化酶HDAC6编码区基因DNA的克隆以人乳腺文库为模板,按一定条件经过变性、退火和延伸等过程,扩增出HDAC6编码区全长的序列,最终获得的PCR产物大小约3 645 bp,符合预期片段大小(图1)。
2 重组表达载体pGEX-HDAC6重组质粒的构建与鉴定 将PCR产物用限制性内切酶XbaⅠ和HindⅢ双酶切后,同法酶切pGEX-KG表达载体,将两者连接。转化大肠埃希菌DH5α菌株,挑选适应的阳性单克隆或菌落,采用试剂盒提取质粒DNA进行双酶切特异性鉴定。结果提示:在凝胶电泳中可以见到与预期片段3 645 bp大小相符的外源基因插入片段(图2),对照空载体在经过双酶切后却没有此片段,表明pGEX-KG上游的多克隆位点中已经插入去乙酰化酶HDAC6的基因序列。奥科鼎盛生物科技有限公司(北京)DNA序列测序结果回报,拟构建的重组质粒与已知目标序列完全一致,没有发生突变(数据省略)。
3 GST-HDAC6融合蛋白的诱导表达及鉴定 经鉴定正确表达的重组质粒转化感受态细胞BL21菌株,经过诱导剂IPTG小量诱导后,离心收集菌体。考马斯亮蓝染色鉴定和Western blot蛋白检测发现,获取的融合蛋白GST-HDAC6能够正确表达(图3)。
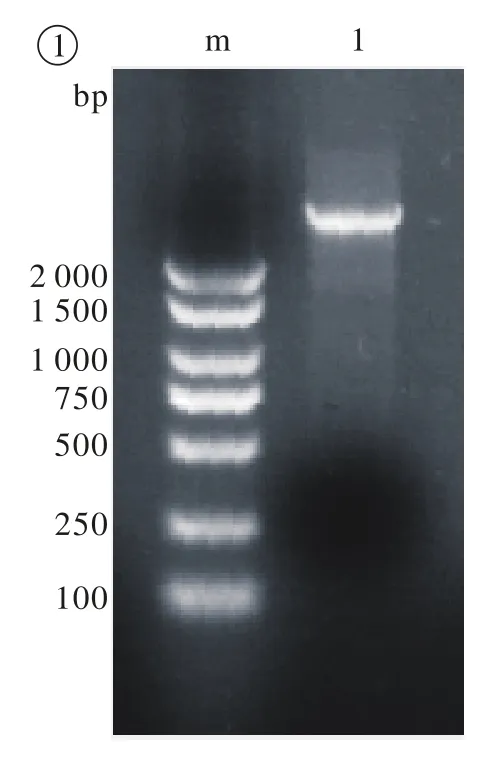
图1 目的基因的PCR扩增 m:BM2000+1.5K DNA标记; 1:退火温度在58℃时的PCR产物Fig. 1 Target gene PCR amplification m:BM2000 +1.5K DNA marker; 1: PCR products at 58℃ annealing temperature
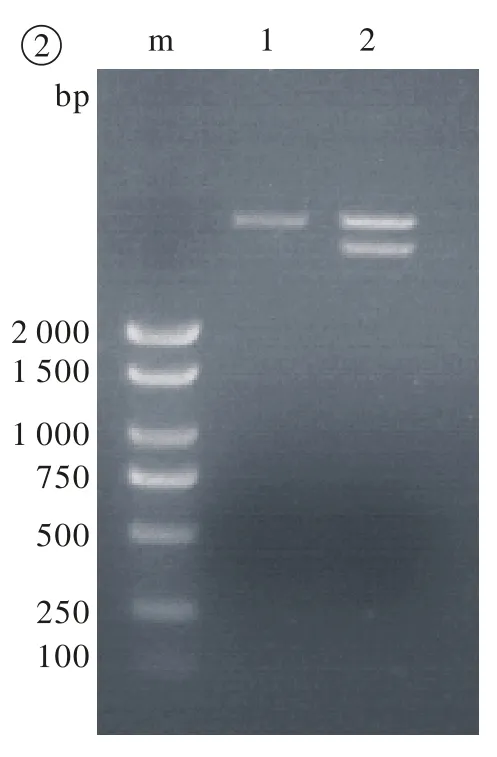
图2 重组质粒酶切鉴定 m: BM2000+1.5K DNA标记;1: pGEX-KG+XbaⅠ+HindⅢ; 2: pGEX-HDAC6+XbaⅠ+HindⅢFig. 2 Recombinant plasmid enzyme digestion quali fi cation m: BM2000+1.5K DNA Marker; 1: pGEX-KG+XbaⅠ+HindⅢ; 2: pGEX-HDAC6 + XbaⅠ+HindⅢ
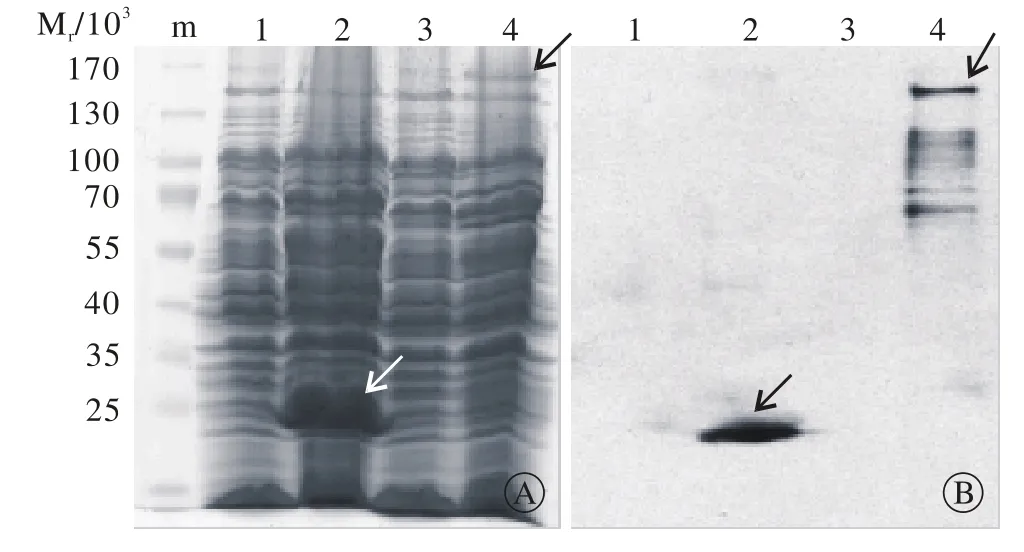
图3 融合蛋白GST-HDAC6的SDS-PAGE和Western blot蛋白检测分析 a: SDS-PAGE ; b: Western blot. m: 蛋白标记; 1:pGEX-KG空载体诱导前; 2: pGEX-KG空载体诱导后; 3:pGEX-KG-HDAC6诱导前; 4:重组质粒 pGEX-KG-HDAC6诱导后,图示位置为表达蛋白条带Fig. 3 SDS-PAGE and Western-blot results of GST-HDAC6 fusion protein a: SDS-PAGE ; b: Western blot. m: protein marker; 1: pGEX-KG before induction; 2: pGEX-KG after induction; 3: pGEX-KG-HDAC6 before induction; 4:Recombinant plasmid pGEX-KG-HDAC6 after induction
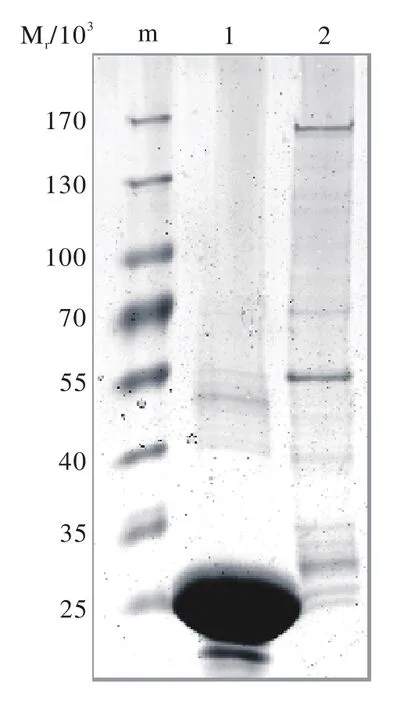
图4 GST-HDAC6融合蛋白纯化SDS-PAGE分析m:蛋白标记; 1:GST空载体蛋白; 2:GSTHDAC6蛋白Fig. 4 SDS-PAGE of GSTHDAC6 fusion protein purif i cation m: protein marker; 1:GST protein; 2: GSTHDAC6 protein
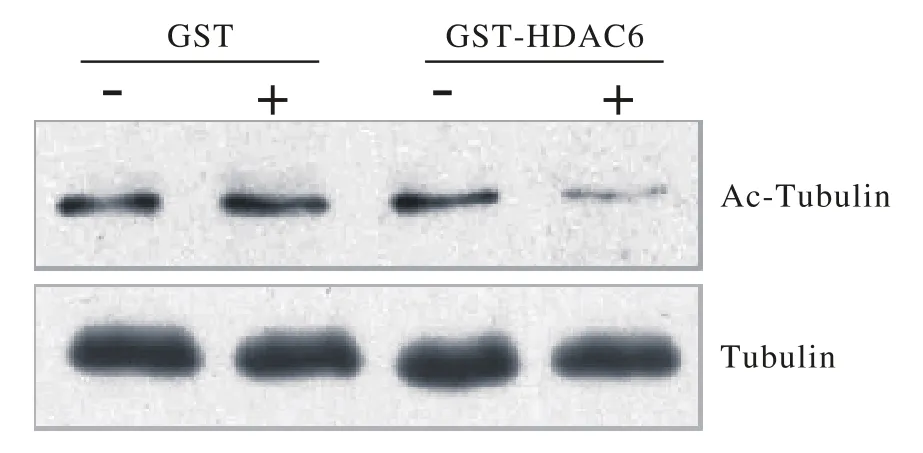
图5 去乙酰化实验检验GST-HDAC6生物活性Fig. 5 GST-HDAC6 showed great enzyme activity by deacetylation experimental verif i cation
4 融合蛋白GST-HDAC6的纯化 利用法玛西亚(Pharmacia)公司的琼脂糖凝胶GST-Sepharose 4B亲和珠纯化后融合蛋白。考马斯亮蓝染色后结果提示通过系统纯化,获取到部分纯度较高的GST蛋白和GST-HDAC6蛋白(图4)。
5 去乙酰化酶实验检测融合蛋白活性 将之前洗脱的GST-HDAC6、5µg GST蛋白与α-tubulin共同孵育后,进行SDS-PAGE和放射显影,结果显示,纯化的GST-HDAC6能够使α-tubulin去乙酰化,但GST却不能使之发生这样的变化,说明纯化的HDAC6蛋白具有一定的生物学活性(图5)。
讨 论
现代肿瘤理论认为,恶性肿瘤的发生、发展与遗传基因的表观遗传学改变密切相关。表观遗传学改变虽然不影响DNA序列,但它可以从转录水平影响基因的表达,进而调控DNA功能表达,具体机制可能与DNA自身化学修饰有关。在众多的修饰方式中,组蛋白的乙酰化和去乙酰化修饰发挥着关键性作用。组蛋白乙酰化的水平是去乙酰化酶和乙酰基转移酶动态竞争后的结果。乙酰化修饰时(乙酰转移酶HATs发挥作用),通过瓦解氨基末端的二级结构并中和组蛋白所带的正电荷以及疏水的乙酰基团产生的空间阻力,降低组蛋白与DNA的亲和力,舒展核小体结构,从而激活基因转录;而去乙酰化酶(HDACs)使组蛋白发生去乙酰化,从而抑制基因转录。由此可见,特定基因的表达状态取决于被转录因子定位在靶基因启动子上的HATs和HDACs间的动态平衡,一旦这种平衡被打破,就容易诱发肿瘤的发生、发展[10]。
HDAC6是HDAC家族中的一员,属于Ⅱ类HDAC去乙酰化酶。近年来,在乳腺癌、卵巢癌、肺癌、口腔癌等恶性肿瘤中发现HDAC6具有明显的差异性表达现象,这也使其成为防癌、控癌的研究热点[11-14]。虽然具体机制并未完全阐明,但目前研究结果表明,HDAC6调控肿瘤的机制主要有以下几个方面:1)对反应底物微管和Hsp90去乙酰化,从转录水平出发,抑制细胞的运动能力,减弱肿瘤的转移能力和血管的速度;2)结合泛素以维持去乙酰基的活性,浓集染色质破坏正常基因转录和蛋白质表达;3)结合转录抑制因子,沉默抑癌基因的表达[15-18]。
微管蛋白a-tubulin是最早被发现的HDAC6底物,能够被HDAC6去乙酰化。在本实验中,我们成功构建去乙酰化酶的HDAC6原核表达载体,利用GST-Sepharose 4B对融合蛋白进行了纯化,并利用体外去乙酰化实验成功降低tubulin的乙酰化水平,证明纯化的GST-HDAC6融合蛋白具有较好的生物学活性,为接下来在体外实验中进一步研究HDAC6调控乙酰化与肿瘤之间的关系奠定实验基础。

