DR5、DcR2蛋白在多囊卵巢综合征大鼠子宫内膜中的表达
王立群,张 娟,丁桂清,,周月希,湖北中医药大学第一临床学院,湖北武汉 430070;解放军中部战区总医院 妇产科生殖中心,湖北武汉 430070
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄期妇女最常见的内分泌失调性疾病之一,主要表现有高雄激素、排卵障碍、多囊卵巢、肥胖、胰岛素抵抗、血脂障碍、糖耐量受损等,是造成无排卵性不孕的主要原因[1]。PCOS妇女早期妊娠流产率可达30% ~ 50%,是正常妇女的4倍[2],此外PCOS患者子宫内膜增生过度和子宫内膜癌(endometrial cancer,EC)的发生率也较高,是正常女性的2 ~ 3倍[3-4],PCOS患者虽然在药物作用下恢复排卵功能,但是其移植失败率和自发性流产率仍然较高[5],这些都提示患者子宫内膜的功能存在失常。目前研究认为PCOS患者子宫内膜功能失常主要是由于雌孕激素撤退缺失以及胰岛素/葡萄糖通路、黏附分子、细胞因子、炎症反应发生改变等原因造成[6]。但是由于PCOS患者内分泌和代谢障碍对子宫内膜造成的影响比较复杂,致使其子宫内膜功能失常的机制还未被完全阐明。本实验从子宫内膜细胞凋亡的角度出发,通过检测死亡受体-5(death receptor-5,DR5)和诱骗受体-2(decoy receptor-2,DcR2)蛋白在PCOS大鼠子宫中的表达,探讨PCOS子宫内膜功能失常的其他可能机制,为临床降低PCOS患者移植失败率、自发性流产率以及子宫内膜癌发生率等治疗提供更多的理论依据。
材料和方法
1 实验动物 选用21 d龄雌性SPF级SD大鼠20只,体质量50 ~ 60 g,由湖北省实验动物研究中心[SCXX(鄂)2015-0018]提供,在湖北省疾病预防控制中心屏障环境[SYXK(鄂)2017-0065]中饲养,温度控制在(22±2)℃,相对湿度为50% ~60%,自由饮食,光照周期为日夜各12 h。
2 试剂与仪器 硫酸普拉睾酮钠,青岛捷世康生物科技有限公司;DR5、DcR2兔多克隆抗体,Abcom公司;内参兔抗β-actin抗体,Proteintech公司。小鼠IgG免疫组化试剂盒,HRP标记羊抗鼠二抗,博士德生物工程有限公司;DAB试剂盒,北京索莱宝生物有限公司;RIPA裂解液、磷酸酶抑制剂、BCA蛋白浓度定量试剂盒、SDSPAGE凝胶配制试剂盒,碧云天;PVDF膜,美国Millipore公司。YD6L生物组织包埋机,金华市益迪医疗设备有限公司;RM2016轮转型切片机,上海徕卡仪器有限公司;BX51奥林巴斯荧光显微镜,日本OLYMPUS公司;TGL-16G-A高速冷冻离心机,上海安亭科学仪器厂;DYY-7C电泳仪、垂直、转移电槽,北京六一仪器厂;RT-6500酶标分析仪,深圳雷杜公司;DB3000凝胶图像分析仪,天能;各种微量移液器,上海安亭科学仪器厂。
3 动物模型的建立[7-8]21 d龄雌性SD大鼠,断乳,适应性喂养2 d,23 d龄时随机分为两组,每组10只。其中一组每日按硫酸普拉睾酮钠90 mg/g皮下注射,相当于脱氢表雄酮(dehydroepiandrosterone,DHEA)60 mg/g,0.4 ml注射用水溶解,连续注射20 d,以建立PCOS大鼠模型(PCOS组)。另一组设为对照组,每日皮下注射0.4 ml注射用水,连续注射20 d。所有大鼠注射后第21日晨用4%水合氯醛麻醉,解剖取卵巢、子宫,分离表面多余组织,固定(4%多聚甲醛),石蜡包埋,4µm厚切片,行HE染色和免疫组化染色。
4 HE染色 将制备好的卵巢、子宫石蜡切片(4µm)分别脱蜡至水,苏木素染色1.5 min,流水冲洗返蓝,显微镜下观察核蓝紫色,100%乙醇浸泡3 min,伊红染色10 s,100%乙醇浸泡10 s,观察细胞质红色,晾干,中性树脂封片后,用倒置显微镜观察卵巢、子宫形态变化。
5 免疫组织化学染色检测DR5、DcR2蛋白的表达 取大鼠子宫石蜡切片脱蜡,流水冲洗;3%过氧化氢封闭内源性过氧化物酶,PBS冲洗;微波抗原修复,PBS冲洗;山羊血清封闭,不洗;一抗(用PBS按1∶200稀释的兔抗大鼠DR5抗体和按1∶100稀释的兔抗大鼠DcR2抗体)4℃过夜;复温,PBS冲洗;二抗(生物素标记山羊抗兔IgG,用PBS按1∶150稀释)37℃孵育35 min;SABC(用PBS按1∶150稀释)37℃孵育30 min,PBS冲洗;DAB显色,显微镜下控制显色时间(5 ~10 min),阳性细胞被染成棕黄色,由Image-Pro Plus计算细胞内棕黄色区域面积(Area)及光密度值(IOD),平均光密度值(OD)为两者之比(IOD/Area),OD值越大,蛋白表达越强。
6 Western blot检测DR5、DcR2蛋白的表达水平取大鼠子宫组织,加入组织裂解液,碾磨匀浆,离心取上清,应用BCA蛋白定量试剂盒测定蛋白浓度,以6µl样品每泳道行12% SDS-PAGE凝胶电泳,约90 min,根据目的蛋白分子量切胶,然后将蛋白电转移至PVDF膜上,5%脱脂奶粉奶粉溶液室温下摇床封闭2 h,相应分子量范围PVDF膜分别加入 DR5(1∶ 500)、DcR2(1∶ 1 000)和β-actin(1∶2 000)4℃孵育过夜,二抗摇床孵育2 h,ECL发光液显色,以β-actin为内参,用Image J软件进行灰度分析。
7 统计学分析 SPSS19.0统计软件包对数据进行分析,计量资料以-x±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
结 果
1 卵巢和子宫光镜HE染色检查 PCOS组大鼠卵巢切面沿包膜下可见多个卵泡呈囊性扩张,黄体形成明显减少,囊性扩张的卵泡内不见卵母细胞或放射冠,卵泡周围颗粒细胞排列松散,层数变薄甚至消失,而卵泡膜细胞有增生,对照组大鼠卵巢切面可以看见许多处于不同发育时期的卵泡,并有多个黄体形成,成熟的卵泡内可见卵母细胞及放射冠,其周围颗粒细胞排列整齐,层数较厚,可达8 ~ 9层。PCOS组大鼠子宫内膜腺体数目与对照组相比明显减少,腺体多为单个分散排列,腺腔比较小,少有纡曲,而对照组大鼠子宫内膜腺体数目较多,腺体多呈簇状排列,腺腔较大,纡曲较多。见图1。
2 免疫组织化学染色观察DR5、DcR2的表达DR5、DcR2的阳性表达主要表现为细胞胞质和胞膜的棕黄色染色,二者在PCOS组和对照组大鼠子宫中均有阳性表达,主要表达于子宫内膜腺上皮细胞,经统计分析,DR5在PCOS组大鼠子宫内膜腺上皮细胞中的表达较对照组明显减弱(P=0.000),而DcR2在两组大鼠子宫内膜腺上皮细胞的表达无统计学差异(P=0.720)。见表1,图2。

表1 DR5、DcR2在各组大鼠子宫内膜中的表达Tab. 1 Expression of DR5 and DcR2 in the endometrium of rats in each group
3 Western blot检测DR5、DcR2蛋白的表达水平
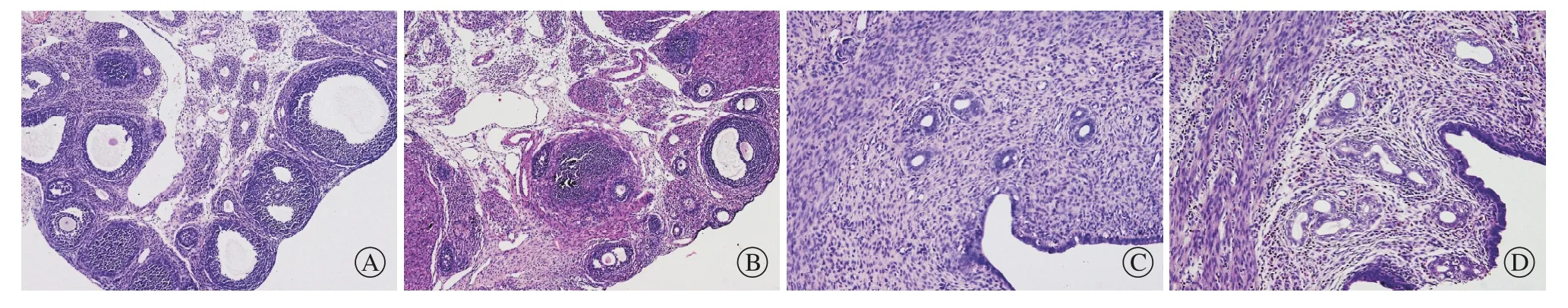
图1 大鼠卵巢及子宫组织切片光镜检查结果。 PCOS组大鼠卵巢切面沿包膜下可见多个卵泡呈囊性扩张,而对照组大鼠卵巢切面可以看见许多处于不同发育时期的卵泡。 PCOS组子宫内膜腺体数目与对照组相比明显减少,腺腔较小,且少有迂曲 A, B:卵巢组织切片(×100); C, D:子宫组织切片(×200); A, C: PCOS组; B, D: 对照组Fig. 1 Histological features of ovarian tissue (A, B. HE staining, ×100) and uterine tissue (C, D. HE staining, ×200). A, C) PCOS group. B, D)Control group. In the PCOS group, multiple follicles showed cystic dilatation along the subcapsular ovary, while many ovarian cuts in the control group showed follicles at different developmental stages. The number of endometrial glands in the PCOS group signif i cantly reduced compared with the control group. The glandular cavity was small, and there was little distortion
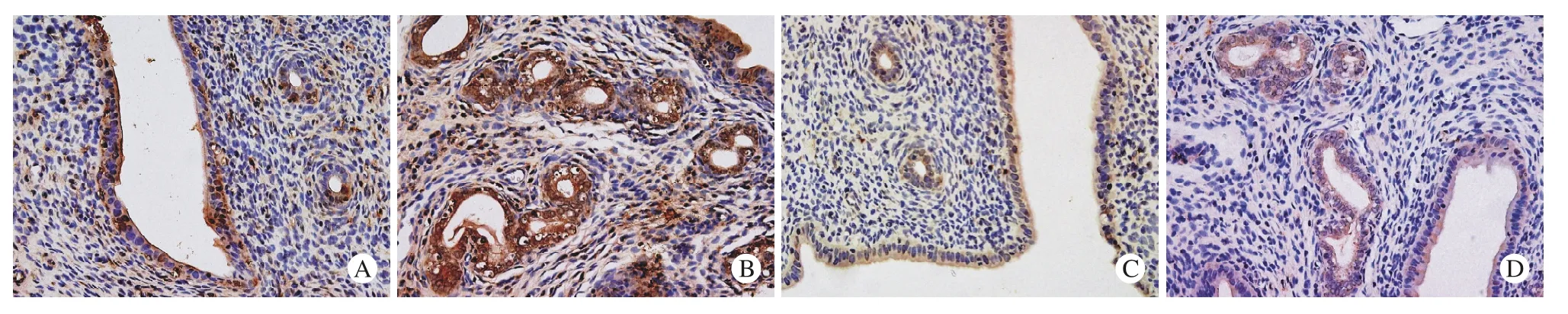
图2 大鼠卵巢及子宫免疫组织化学检查结果。 DR5和DcR2主要表达于子宫内膜腺上皮细胞,DR5在PCOS组中的表达情况较对照组明显减弱,DcR2在两组中的表达无显著差异 A, B: DR5免疫组化染色技术应用切片(SABC法,×400); C, D: DcR2免疫组化染色技术应用切片(SABC法,×400); A, C:PCOS组; B, D: 对照组Fig. 2 Immunohistochemical staining images showed DR5 and DcR2 expression in uterine tissue (SABC method,×400). (A) Lack of DR5 expression in PCOS group. (B) Strong membrane expression of DR5 in control group (C) Lack of DcR2 expression in PCOS group. (D)Lack of DcR2 expression in control group
DR5在PCOS组和对照组大鼠子宫中相对表达量分别为0.997±0.021、1.282±0.015,差异有统计学意义(P=0.000),PCOS组大鼠子宫DR5蛋白的表达明显降低;DcR2在PCOS组和对照组大鼠子宫中相对表达量分别为0.906±0.078、0.860±0.064,差异无统计学意义(P=0.474)。见图3。
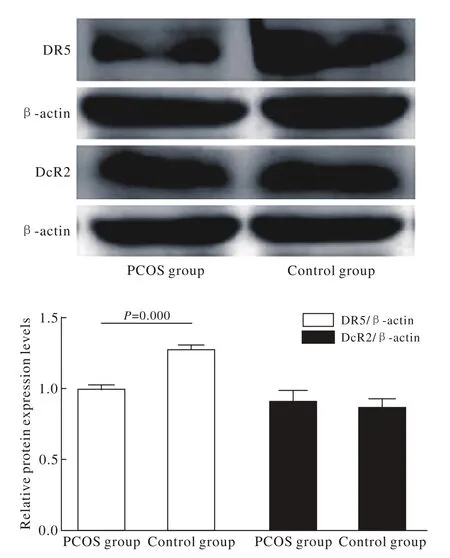
图3 Western blot检测DR5、DcR2蛋白的表达水平Fig. 3 Western blot was used to detect the expression of DR5 and DcR2 proteins
讨 论
自1976年Hopwood和Levison[9]发现人的子宫内膜存在细胞凋亡小体以来,越来越多的研究表明子宫的许多病理变化都与细胞凋亡密切相关。Yan等[10]通过对PCOS患者子宫内膜进行研究发现,PCOS患者种植窗期子宫内膜的凋亡指数与对照组相比显著降低,他们还发现9种与细胞凋亡相关基因的表达发生了变化,其中B淋巴细胞瘤-2基因(B-cell lymphoma-2,BcL-2)的表达显著上调,Fas相关死亡域蛋白(Fas-associated with death domain protein,FADD)的表达显著下调。Kuyucu等[1]研究表明PCOS大鼠子宫内膜的凋亡情况与对照组相比明显增加,细胞凋亡过程中主要的效应因子Caspase-3的表达也显著升高,这些研究均表明PCOS子宫内膜的凋亡情况发生了改变。
肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis inducing ligand,TRAIL)作为肿瘤坏死因子超家族的一员,它通过与4种高亲和力的受体结合在细胞凋亡过程中发挥着重要作用,其中DR4和DR5与TRAIL结合后会诱导细胞凋亡,DcR1和DcR2由于缺乏内源性死亡结构域,它们与TRAIL结合后不仅不会诱导细胞凋亡,还可以与死亡受体竞争结合TRAIL而起到保护细胞的作用[11]。这说明TRAIL受体的表达水平影响着由TRAIL介导的细胞凋亡情况。有许多学者对TRAIL受体在子宫内膜癌中的表达情况进行过研究[12-14]。但是有关于TRAIL受体在PCOS子宫内膜中表达情况的研究目前鲜有报道。
本研究中,我们首先构建了PCOS大鼠模型,然后通过免疫组织化学法和免疫印迹法检测DR5和DcR2的表达情况,结果发现这两种TRAIL受体主要表达于子宫内膜腺上皮细胞,DR5在PCOS大鼠子宫内膜的表达水平较对照组降低,DcR2在两组大鼠子宫内膜中的表达水平无明显差异。我们推测,在正常的子宫内膜中,TRAIL及其受体的表达水平之间可能存在一定比例,使TRAIL所介导的促细胞凋亡作用和抗细胞凋亡作用之间维持着一种平衡,而在PCOS大鼠子宫内膜中,由于DR5的表达水平发生了变化,破坏了这一比例,导致了TRAIL所介导的促凋亡和抗凋亡作用的失衡,从而影响了PCOS大鼠子宫内膜的凋亡情况,进而对内膜的功能造成了一定影响。
EC是发生于子宫内膜的一组上皮性恶性肿瘤,为女性生殖道三大恶性肿瘤之一,近年来发病率呈上升趋势[15]。Haoula等[16]研究表明,与没有患PCOS的女性相比,患有PCOS的女性发生EC的可能性大约是前者的3倍,但是PCOS与EC之间的确切联系目前还不清楚。Gottwald等[12]发现在子宫内膜样腺癌中,DR5的表达较正常子宫内膜是显著降低的,李晓兰等[17]发现在EC的早期阶段,DR5的表达明显减少,DcR2的表达无明显改变。由于DR5的下调可以减少TRAIL所诱导的肿瘤细胞凋亡[18],有学者认为在EC的早期,子宫内膜癌细胞发生了凋亡逃逸,导致肿瘤细胞快速生长,从而发展成为EC。由于PCOS患者发生EC的风险较高,在本次研究中TRAIL受体DR5和DcR2在PCOS大鼠子宫内膜的表达情况又与EC早期相似,由此我们推测DR5在子宫内膜表达水平的降低可能是导致PCOS发生EC的因素之一,但其中的具体机制尚不明确,仍需我们进一步研究。
综上所述,我们认为DR5和DcR2在PCOS大鼠子宫内膜的表达变化可能在PCOS子宫内膜功能发生失常的过程中起到了一定作用,这为阐释PCOS子宫内膜功能失常的机制提供了一个新的可能,也为临床上降低PCOS患者移植失败率、自发性流产率以及子宫内膜癌发生率等提供了更多的理论依据。

