慢性尿路感染大鼠模型的动态变化研究*
钟志勇 冯学轩 严家荣 刘盛来 刘骥德 郑玉连 唐小江
(广东省医学实验动物中心,广州 528248)
慢性尿路感染(Chronic urinary tract infection, CUTI)是临床常见的泌尿系统感染性疾病,主要指细菌、真菌等微生物病原体在尿路中异常生长、繁殖、侵犯黏膜或组织,继而引起以尿路刺激症状为主要临床特征的泌尿系统常见病[1-3]。现代医学对于CUTI的研究表明,肠道革兰氏阴性菌中的大肠埃希菌为CUTI的常见致病菌,约占70%~90%[4-6]。患者感染后可出现腰膝酸软、尿频、尿急、尿痛、排尿淋漓不尽、下腹坠胀等症状[7],此病发病率高,受累群众广[8],严重影响患者的心理和生理健康。因此,研发有效的治疗药物显得尤为迫切,但要进行药物的研究和筛选,必须建立合适的实验动物模型,这样才能更好地“对症下药”。目前,针对CUTI的研究大多局限于造模—给药—指标检测这样的研究模式当中,对于CUTI动物模型的动态变化并没过多的研究,因此对于模型发病高峰,病程,病情的发展也并没太多的了解,此举极有可能造成在实验过程中用药时机不当,进而影响药效的评价,得出假阴假阳的结果。
据此,本文拟通过膀胱内注入定量大肠埃希菌,建立慢性尿路感染大鼠模型,并在疾病发展过程中定期进行体温、尿菌、尿白细胞、尿素氮(BUN)、肌酐(Cr)、血常规等动态监测,并设左氧氟沙星阳性对照组,首次探讨此类造模方法建立的CUTI模型的动态变化情况以及抗菌药物干预后的疾病发展情况,为日后CUTI模型的完善及应用于药物开发提供基础的实验资料及参考。
1 材料与方法
1.1 实验材料
1.1.1实验动物和饲养环境:SPF级SD大鼠,30只,雌性,由广东省医学实验动物中心提供,合格证号:44007200014887;动物饲养在广东省医学实验动物中心SPF级动物房的IVC系统中,实验动物使用许可证号:SYXK(粤)2013-0002。单笼饲养,饲养温度与湿度:20~26 ℃,40%~70%,采用10 h∶14 h昼夜间断照明。动物自由进食和饮水,所有饲料和饮用水均由广东省医学实验动物中心提供。
1.1.2药物及主要试剂:盐酸左氧氟沙星片:批号A1401001、A1401002,哈药集团制药总厂,按100 mg∶20 mL的质量体积比配制成5 mg/mL的药液;尿素氮(BUN)试剂盒:批号20140332,上海科华生物工程股份有限公司生产;肌酐(Cr)试剂盒:批号20140112,上海科华生物工程股份有限公司生产;大肠杆菌O111B4菌株:由广东省中医院微生物检测室赠送。
1.1.3主要仪器:BS-3000A电子分析天平:精度0.1 g,上海友声衡器有限公司;DHG-9245A电热恒温鼓风干燥箱:上海一恒科技有限公司;LMQ.C立式灭菌器:山东新华医疗器械股份有限公司;RM2135轮转切片机:德国LEICA公司;TS-12C生物组织全自动脱水机:湖北孝感医用仪器有限公司;BM-VII生物组织包埋机及冷冻机:湖北孝感医用仪器有限公司;CS-VI摊片烤片机:湖北孝感医用仪器有限公司;RS-18生物组织全自动染色机:湖北孝感医用仪器有限公司;BX43病理图像分析系统:日本奥林巴斯。
1.2 方法
雌性SPF级SD大鼠,30只。检疫合格后,随机分为假手术组、模型对照组、盐酸左氧氟沙星组,10只/组。实验前大鼠禁食禁水12 h,术前大鼠经手按压膀胱使排空膀胱内残留尿液后,按0.2 mL/100 g体质量经腹腔注射3%戊巴比妥钠进行麻醉,仰位固定大鼠,下腹部剃毛后,医用酒精消毒,无菌操作下,在下腹膀胱位置,切开腹壁1~3 cm,暴露膀胱,手持镊子固定膀胱,用1 mL灭菌注射器吸取大肠杆菌液(密度为107个/mL),按0.5 mL/只的体积缓慢注入膀胱内,腹壁缝合、消毒,夹住尿道口两侧皮肤后放回笼内,继续禁水饲养6 h。假手术组不注入大肠杆菌,其余操作一致。盐酸左氧氟沙星组按2 mL/100 g体质量的剂量灌胃5 mg/mL盐酸左氧氟沙星片药液,假手术组和模型对照组给予等量纯净水,连续30 d。造模当天测量大鼠体温,采集血液测定血常规、收集尿液测尿白细胞及尿细菌数。
1.3 检测指标
1.3.1观察:每天观察动物的一般临床情况,若有死亡动物应及时进行解剖,并观察内脏各器官形态变化。
1.3.2体质量:实验期间每周测量体质量1次。
1.3.3体温: 实验期间每周测量体温1次。
1.3.4血常规、BUN、Cr的测定: 实验期间每周经眼眶采EDTA抗凝血测量血常规1次,采促凝血,4 ℃ 3 000 r/min离心10 min,取血清测定BUN及Cr含量。
1.3.5尿白细胞及尿细菌:实验期间每周采用代谢笼收集4 h尿液测定大鼠尿白细胞、尿细菌1次,代谢笼使用完毕立刻消毒。
1.3.6肾脏和膀胱脏器感染菌计数:实验结束当天(第30天),在无菌条件下,各组大鼠均取右侧肾脏及一半的膀胱组织,分别称重后剪碎,右肾加5 mL无菌生理盐水匀浆;一半膀胱加1 mL灭菌生理盐水匀浆。吸取50 μL匀浆液于琼脂平皿培养基上均匀铺开,置37 ℃ 培养箱中培养24 h 后,进行菌落形成数(colony formation unit, CFU) 计数。每只动物的菌落数以每毫克湿组织所能培养出的CFU 计算。
1.3.7病理学检测:各组大鼠取左侧肾组织及另一半膀胱组织,4%中性甲醛固定后,常规石蜡切片,HE染色,进行病理组织学检查,并按表1进行评分[10]。

表1 组织病理学评分表Table 1 Histopathological evaluation scale
1.4 统计方法
2 结果
2.1 体质量测量结果
与假手术组相比,模型对照组造模后第14、21天体质量明显降低,有统计学差异(P<0.05);与模型对照组相比,盐酸左氧氟沙星组体质量无统计学差异(P>0.05),见图1。
2.2 体温测量结果
与假手术组相比,模型对照组造模后第14、21天体温升高明显,有统计学差异(P<0.05);与模型对照组相比,盐酸左氧氟沙星组体温有所降低,但无统计学差异(P>0.05),见图2。
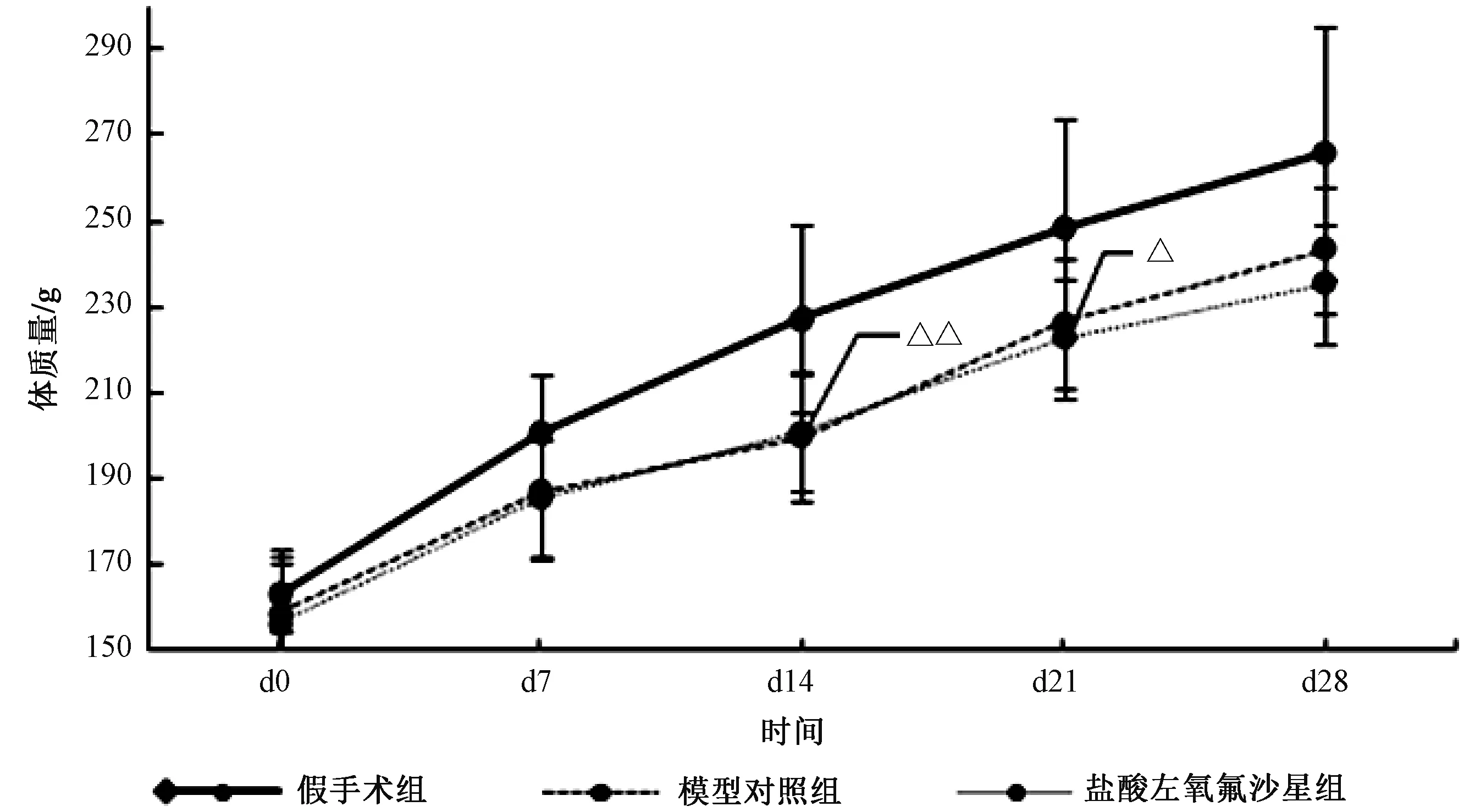
图1 实验期间各组大鼠体质量变化情况注:与假手术组相比,△P<0.05,△△P<0.01Fig.1 The body weight of each group during the experiment periodNote: Compared with the Sham group, △P<0.05,△△P<0.01
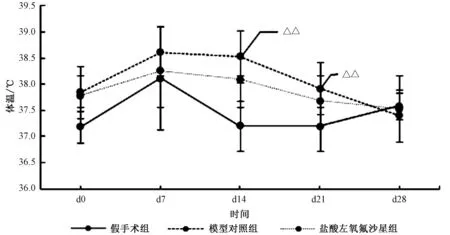
图2 实验期间各组大鼠体温变化情况注:与假手术组相比, △△P<0.01Fig.2 The body temperature of each group during the experiment periodNote: Compared with the Sham group, △△P<0.01
2.3 尿细菌数测定结果
造模前各组间尿细菌数无统计学差异(P>0.05)。造模后,与假手术组相比,模型对照组第7~28天各测定时间点尿细菌数明显增加,有统计学差异(P<0.05);与模型对照组相比,盐酸左氧氟沙星组第7~28天各测定时间点,尿细菌数明显减少,有统计学差异(P<0.05),见表2。
2.4 肾脏、膀胱感染菌结果
与假手术组相比,模型组膀胱染菌数和肾脏染菌数明显增加,有统计学差异(P<0.05);与模型对照组相比,盐酸左氧氟沙星膀胱染菌数和肾脏染菌数均明显减少,有统计学差异(P<0.05),见表3。
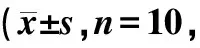
表2 各组大鼠尿细菌数变化情况♀)Table 2 Number of urine bacterial in each ♀)
注:采用重复测量方差分析方法进行统计分析。与假手术组相比,△△P<0.01;与模型对照组相比,**P<0.01
Note:Repeated measures anova was used for statistical analysis.Compared with the Sham group,△△P<0.01; Compared with the Model group,**P<0.01
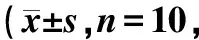
表3 各组大鼠肾脏、膀胱感染菌结果♀)Table 3 Number of kidney and bladder bacterial in♀)
注:肾脏染菌数采用sin转换后方差分析,膀胱染菌数采用秩和检验的统计方法进行分析。与假手术组相比,△△P<0.01;与模型对照组相比,**P<0.01
Note:Anova was used after sin transformation for kidney bacterial statistical analysis. Rank sum test was used for bladder bacterial statistical analysis。Compared with the Sham group,△△P<0.01; Compared with the Model group,**P<0.01
2.5 血清BUN值、血清Cr值:
各组动物在各测定时间点的血清BUN值、Cr值均未见有统计学意义(P>0.05)。
2.6 血常规
2.6.1白细胞数及分类:与假手术组相比,模型对照组第7、14、21天白细胞数升高有统计学差异(P<0.05),在白细胞分类中,淋巴细胞数、嗜碱性粒细胞数、单核细胞数、中性粒细胞数、嗜酸性粒细胞数在各测定时间点上均未见统计学差异(P>0.05);与模型对照组相比,盐酸左氧氟沙星组第0、7、14天嗜酸性粒细胞数升高有统计学差异(P<0.05),其余白细胞指标无统计学差异(P>0.05),表4~6。
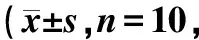
表4 各组大鼠白细胞、淋巴细胞数♀)Table 4 The number of white blood cells and lymphocytes in each ♀)
注:采用重复测量方差分析方法进行统计分析。与假手术组相比,△P<0.05
Note:Repeated measures anova was used for statistical analysis. Compared with the Sham group,△P<0.05
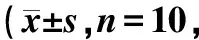
表5 各组大鼠单核细胞、中性粒细胞数♀)Table 5 The number of monocytes and neutrophils in each ♀)
注:采用重复测量分析方法进行统计分析
Note:Repeated measures anova was used for statistical analysis
2.6.2红细胞及血红蛋白浓度:与假手术组相比,模型对照组第0、7、14、28天红细胞数升高,第7、14天血红蛋白浓度升高有统计学差异(P<0.05);与模型对照组相比,盐酸左氧氟沙星组红细胞及血红蛋白浓度在各测定时间点无统计学差异(P>0.05),表7。
2.6.3血小板数:各组动物在各测定时间点的血小板数均未见有统计学意义(P>0.05),表8。
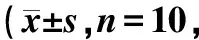
表6 各组大鼠嗜酸性粒细胞、嗜碱性粒细胞数♀)Table 6 The number of eosinophil and basophil in each ♀)
注:采用重复测量方差分析方法进行统计分析。与模型对照组相比,*P<0.05,**P<0.01
Note:Repeated measures anova was used for statistical analysis. Compared with the Model group,*P<0.05,**P<0.01
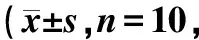
表7 各组大鼠红细胞数、血红蛋白浓度♀)Table 7 Results of erythrocyte count and hemoglobin concentration in each ♀)
注:采用重复测量方差分析方法进行统计分析。与假手术组相比,△P<0.05,△△P<0.01
Note:Repeated measures anova was used for statistical analysis. Compared with the Sham group,△P<0.05,△△P<0.01
表8 各组大鼠血小板数♀)Table 8 The number of platelet in each ♀)
注:采用重复测量分析方法进行统计分析
Note:Repeated measures anova was used for statistical analysis
2.7 组织病理学检测
2.7.1评分结果:与假手术组相比,模型对照组病理学评分升高有统计学差异(P<0.05)。与模型对照组相比,盐酸左氧氟沙星组病理学评分下降有统计学差异(P<0.05),见表9。
2.7.2组织病理学观察:假手术组膀胱及肾脏结构均无异常。模型组所有动物膀胱可见黏膜下层炎性细胞浸润,20%的动物可见黏膜下层血管扩张充血;部分动物肾脏局部间质内可见炎性细胞聚集。盐酸左氧氟沙星组只有20%的动物膀胱可见黏膜下层少量炎性细胞浸润,其余动物膀胱组织结构均未见异常;有1只动物肾脏可见少量炎细胞浸润,其余动物肾脏组织结构未见异常,见图3、图4。

表9 各组别病理学评分中各分值的动物数Table 9 The number of animals of eachpathological grade in different groups
注:采用卡方检验的分析方法进行统计分析。与假手术组相比,△△P<0.05;与模型对照组相比,**P<0.05
Note:Chi-square test was used for statistical analysis. Compared with the Sham group,△△P<0.05; Compared with the Model group,**P<0.05

图3 慢性尿路感染大鼠膀胱病理学结果(×100)——200 μmFig.3 The bladder histopathological results of chronic urinary tract infected rats
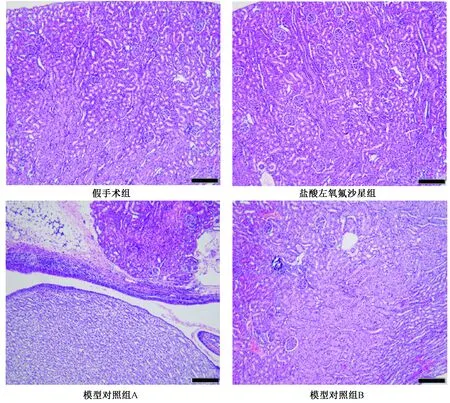
图4 慢性尿路感染大鼠肾脏病理学结果(×100)——200 μmFig.4 The kidney histopathological results of chronic urinary tract infected rats
3 讨论
任何药物的开发,都必须在人类疾病动物模型上确认有效,才能以人作为无危害的受试者。因此,在进行慢性尿路感染(CUTI)的药物开发时,对CUTI动物模型的动态变化研究也应成为其研究的重点之一。立足于此,本文根据CUTI的发病特点[6, 9-11](女性发病率高、大肠杆菌为主要病原菌,上行感染为常见的感染类型),采用大肠杆菌逆行感染法成功建立雌性大鼠的CUTI模型[10, 12],并首次对疾病模型的发展情况进行动态监测。
在以往的造模方法中,大多采用逆行感染法进行造模,但对于保证大肠杆菌在尿路中的黏着时间缺乏足够的重视,没有为大肠杆菌提供良好的黏着条件。在本实验中,我们采用挤压膀胱排空尿液,注意造模前后的禁水以及采用夹闭尿道口的方法为大肠杆菌提供良好的尿路黏着环境,以利于成功建模。在实验过程中发现,造模后在第14、21天的监测点,模型动物体温上升最为明显,尿液细菌数也在这两个监测点达到最大值,与之对应的血液白细胞数在第7、14、21天这三个监测点与假手术组存在显著差异。建模第30天结束实验时发现,模型动物肾脏和膀胱菌数大幅度升高,病理检查结果显示模型动物均出现膀胱炎,黏膜充血,部分动物出现肾炎,且病理评分高分值的动物数显著增多,具有明显的尿路感染特征。根据感染部位的不同,CUTI可分为上尿路感染,主要指的是肾盂肾炎,以及下尿路感染,包括尿道炎和膀胱炎[1]。因此,从上述的动态监测结果及病理诊断结果可判断,在本实验的造模条件下,可建立具有明显下尿路感染症状和具有一定的上尿路感染症状的动物模型,此模型的疾病严重程度属于中等程度,且在这模型中,CUTI动物的发病最高峰主要集中在细菌接种后的第14~21天,这段时间炎症发生明显,疾病表现会最为突出,同时也最适合对药物进行药效学观察,但是,药物的干预则应在这段时间之前进行。此外,为证明此模型是否适合用于药效学研究,本实验同时设置了盐酸左氧氟沙星干预组,实验过程发现,给予抗生素干预,CUTI动物无论在感染菌数还是组织炎症上,均有好转趋势。
在进行药效研究时,用于初步药效学观察的动物疾病模型建模不宜过于严重,否则容易掩盖药效,从而错误地淘汰了具有潜在开发价值的药物。在本实验的造模条件下,建立的是中等程度的慢性尿路感染动物模型,可用于药物的初步药效学筛选,同时本实验还提供了模型的动态变化检测结果,为何时进行药物干预、药效观察提供了实验基础上的参考。

