C57BL/6小鼠实验性变态反应性脑脊髓炎模型的建立*
练高建 杨神书 何理平 尹倩梅 谭翔文 吴端生 苏泽红
(1.南华大学实验动物学部,衡阳 421001)(2.南华大学药学与生物科学学院生物科学系,衡阳 421001)
人类多发性硬化症(Multiple sclerosis, MS)是以中枢神经系统慢性炎性浸润,脱髓鞘,轴突损害及脑萎缩为主要特征的一种复杂基因疾病。很多研究证明MS的发生具有很强的基因背景[1-3];自身的激活反应性T细胞也参与调节多发性硬化症的病理生理学进程。目前光学相干断层成像扫描技术(optical coherence tomography, OCT)已应用于MS病理组织观察[4],但MS的发病机理仍不清楚。
实验性变态反应性脑脊髓炎(Experimental Allergic Encephalomyelitis, EAE)是由针对CNS髓鞘发生免疫攻击的CD4+T细胞介导的自身免疫性疾病,抗原致敏的T细胞穿过血脑屏障进入中枢,诱发对自身髓鞘抗原的免疫应答,导致脑及脊髓的免疫损伤。EAE是人类MS的经典模型,通过对EAE发病机制、病情发生发展规律、临床及病理改变、治疗及预防等方面的深入研究,可为MS的治疗提供充分的实验依据[5]。
因此,本文以C57BL/6小鼠为实验对象,在国内外使用的方法基础上加以改进,成功建立起病程稳定、发病率高的EAE模型,为研究人类MS的发病机理及筛选有效的临床防治药物提供可靠的小鼠模型。
1 材料与方法
1.1 实验动物及分组
SPF级7~9周雄性C57BL/6小鼠(16~20 g),购自南华大学实验动物学部。所有小鼠均饲养于屏障环境中,随机分为EAE模型组和实验对照组,每组10只。
1.2 试剂
髓鞘少突胶质细胞糖蛋白MOG35-55多肽(Myelin Oligodendrocyte glycoprotein (MOG) 35-55 peptide)购自上海信裕生物科技有限公司,预先用PBS配制成10 mg/mL,储存于-20 ℃,工作浓度:0.5 mg/mL。百日咳毒素(已灭活)(Pertussis toxin, PTX)购自北京博蕾德生物科技有限公司,预先用PBS配制成100μg/mL,储存于-20 ℃,用前用PBS稀释100倍,腹腔注射0.2 mL/只。结核分支杆菌(已灭活)(Mycobacteriumtuberculosis, MT)购自西宝生物科技(上海)股份有限公司。不完全弗氏佐剂(incomplete Freund’s Adjuvant,IFA),购自北京索莱宝科技有限公司,预先准备4 mg/mL MT-IFA混合液:80 mg 结核分支杆菌与20 mL不完全弗氏佐剂充分混匀后,转移至50 mL玻璃匀浆器,按照10 min反复研磨,然后置于冰上10 min的节奏,至少重复3遍以上(注意:准备时应戴上口罩)。
MOG33-35与MT-IFA混合液的准备:先用一支注射器吸取0.5 mg/mL的MOG33-35工作液,另一支注射器吸取与MOG33-35工作液等体积的MT-IFA工作液,小心地去除2支注射器中的空气后,用3向旋塞阀连接2支注射器(根据混合体积选择合适的注射器),反复抽打5 min,然后置于-20 ℃ 5~10 min,如此反复3次以上直至形成混合良好的油包水型乳化剂。
1.3 EAE的构建
将小鼠麻醉后,先以0.2 mL/只小鼠的剂量腹腔注射准备好的1 μg/mL的百日咳毒素工作液,然后每只小鼠注射0.2 mL上述方法准备好的MOG-MT-IFA抗原混合液,背部约前肢肩胛骨及后肢髋关节部位分4点皮下注射各50 μL。于48 h后再每只小鼠分别腹腔注射1μg/mL的百日咳毒素工作液0.2 mL。对照组小鼠仅注射PBS。
1.4 EAE进程监测及临床症状分级
自第2次注射百日咳毒素后,每日观察小鼠状态。采用双盲法,按照Goverman等[6]提出的标准判断小鼠发病程度:0分,小鼠各项指标正常;1分,尾无力及下垂;2分,步态不稳,人为翻身后不能迅速复位;3分,后肢无力或单侧后肢瘫痪;4分,后肢拖行,完全瘫痪;5分,后肢完全瘫痪伴随前肢无力或瘫痪。
1.5 取材及组织学分析
EAE小鼠发病至高峰期,用异氟烷深度麻醉小鼠,打开小鼠胸腔,用注射器经左心室灌注PBS至肝脏发白,取出脊髓,用10%多聚甲醛固定,6 μm石蜡切片,经常规苏木素-伊红(H&E)染色,或神经髓鞘固蓝(Luxol fast blue,LFB)/过碘酸雪夫氏(Periodic Acid-Schiff, PAS)双重染色,或免疫组织化学染色后,光镜下观察分析炎性细胞浸润,脱髓鞘状况及鉴定浸润炎性细胞类型。
2 结果
2.1 EAE发生发展情况
自抗原免疫后第10天起,EAE实验组小鼠开始陆续出现EAE临床症状,至15 d达到发病高峰,发病率达到100%。EAE实验组小鼠发病后表现为:行动迟缓,活动减少,食欲下降伴随体质量减轻,身体状态明显差于对照组小鼠。临床症状则随时间的推移逐渐加重,具体表现为:从尾巴松弛下垂开始,至步态摇摆、人为翻身不能自主快速复位,再进至单侧后肢瘫痪、双后肢瘫痪,最终发展为四肢瘫痪。 而对照组所有动物至实验结束时表现正常,状态良好,未出现发病情况,且小鼠体质量正常增加。按照动物福利规定要求,我们的实验最高评分为4分,动物达到4分标准后即麻醉处死取材分析。实验结果如图1。
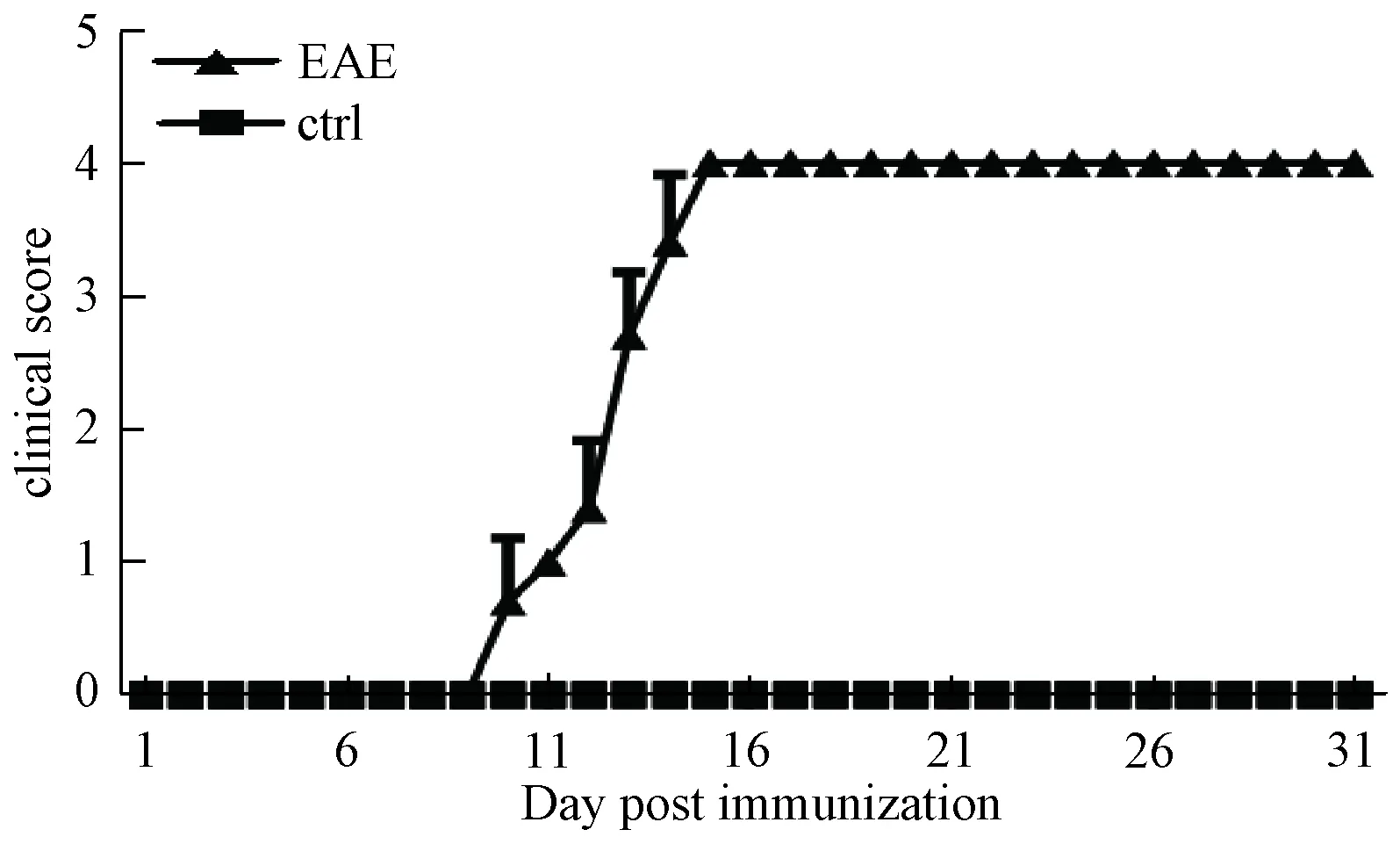
图1 C57BL/6小鼠神经功能评分Fig.1 Neural function score of C57BL/6 mice
2.2 HE 结果
小鼠脑脊髓组织HE染色结果显示,模型组(图2 A)中出现大量的炎性细胞浸润,尤其以腰部脊髓炎性细胞浸润最为严重。而正常对照组(图2B)则未发生炎性细胞浸润。

图2 HE 染色显示脊髓炎性细胞浸润 (×100)注: A. EAE组;B. 正常对照组Fig.2 Inflammatory cells infiltration in spinal cord, HE staining (×100)Note:A. EAE group; B. Control group
2.3 免疫组织化学结果
为进一步确定浸润的炎性细胞的类型,我们分别进行了淋巴细胞及巨噬细胞的免疫组化染色反应研究,结果显示,模型组浸润的炎性细胞中,少量为淋巴细胞,大部分为巨噬细胞(图3A),而正常对照组(图3B)则没有出现任何炎性细胞浸润。
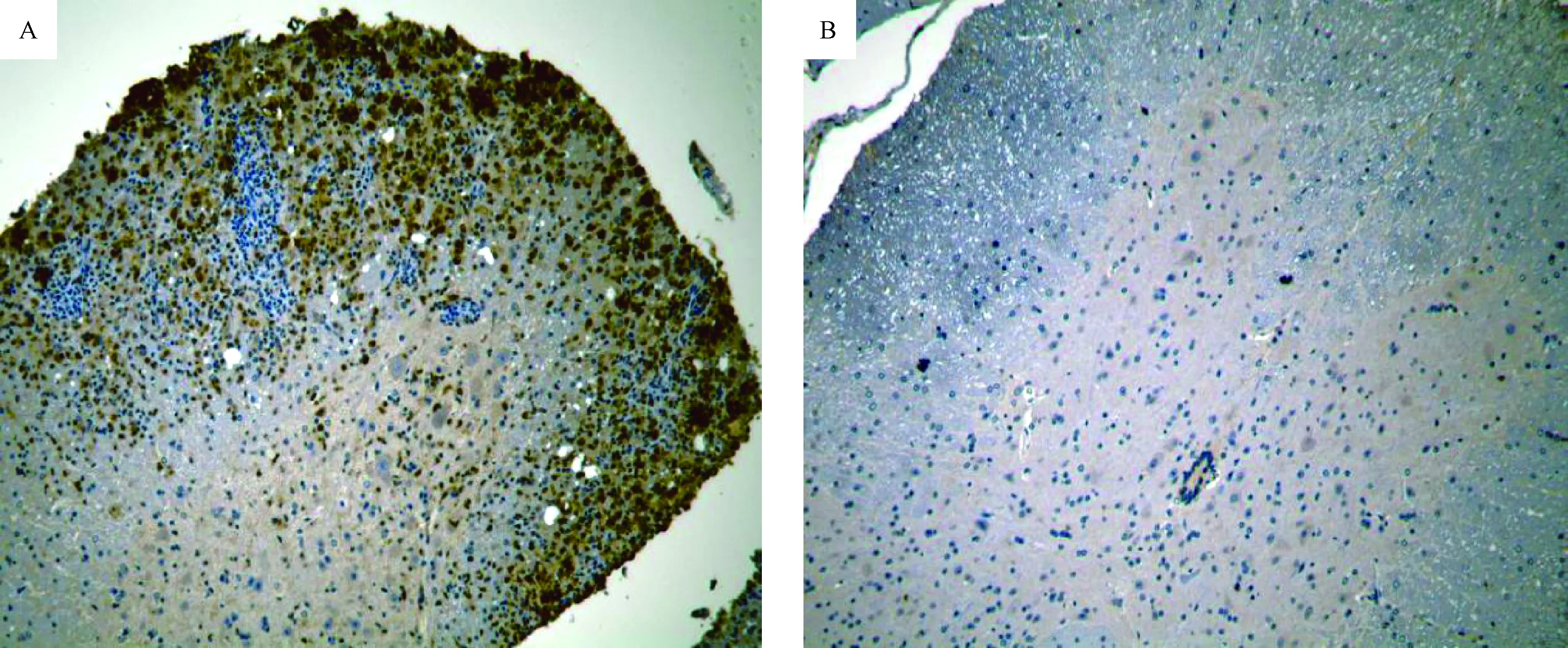
图3 免疫组化反应显示脊髓中浸润细胞类型 (×100)注:A. EAE组;B. 正常对照组Fig.3 Inflammatory cells infiltration in spinal cord, Immunohistochemistry assay (×100)Note:A. EAE group; B. Control group
2.4 LFP/PAS 双重染色结果
为同时表现炎性细胞浸润及脱髓鞘病理变化,我们进行了LFP/PAS双重染色反应,结果显示,模型组出现明显的细胞浸润和脱髓鞘病理改变(图4中箭头所示),而正常对照组则无此现象发生。

图4 神经髓鞘固蓝(LFB)/过碘酸雪夫氏(PAS)双重染色显示脊髓中炎性细胞浸润及脱髓鞘状况 (×100)注: A. EAE组;B. 正常对照组Fig.4 Inflammatory cells infiltration and demyelination in spinal cord, LFB/PAS double staining (×100)Note:A. EAE group; B. Control group
3 讨论
虽然至今仍然未能阐明MS的发病机理,但大量的研究表明,髓鞘特异性的TH17细胞过度的免疫反应以及具有免疫耐受作用的调节性T细胞的功能紊乱,在MS的病理进程中扮演了重要角色。TH17 cells 对中枢神经系统的浸润和在外周免疫器官的累积,及其特征性细胞因子-IL-17通过不同的作用机制也对MS及EAE的病理进程起了极大的作用[7-8]。因此,建立起能准确模拟MS发病过程并具有类似临床表现的动物模型,能为阐明MS的发病机制及筛选防治MS的有效药物打下坚实的基础。
不同品种或同一品种不同品系动物对EAE的易感性主要受免疫反应基因(Ir基因)影响,Ir基因的调节作用表现为T细胞表面受体对髓鞘碱性蛋白(MBP)的特异性表达。动物的种类不同,其受体表达能力不同,对自身抗原的反应性不同,因而对EAE的易感性也不同,因此在选择动物时需要寻找EAE敏感的模型动物。 鉴于对EAE敏感的Lewis、DA大鼠,PL/J,SJL/J小鼠的价格昂贵、不易获得且难以饲养,国内多采用廉价易得的Wistar大鼠,但其敏感性不及前者。本研究中我们选用的C57BL/6小鼠,在国内应用十分广泛,且遗传背景明确并早已标准化繁育,使用起来非常方便且价格便宜,得到的实验结果准确、可靠。比较起目前国内常用的Wistar大鼠,操作起来也更为容易。
本实验采用髓鞘少突胶质细胞糖蛋白MOG35-55多肽与结核分支杆菌及不完全弗氏佐剂充分混匀、乳化制成免疫原,以加强免疫原性并延长抗原在小鼠体内的停留时间,从而充分诱导免疫反应,同时结合2次腹腔注射百日咳毒素,以利于炎性细胞穿过血脑屏障进入中枢神经系统,成功建立起的EAE小鼠模型,不仅模型稳定,病理上则表现出炎性细胞浸润,尤其是以巨噬细胞浸润为主,并出现明显的脱髓鞘现象,这些表现均与人类多发性硬化症极为相似。而且发病率高达100%,从而在实验中可以排除模型构建成功与否对实验结果的干扰,方便对所筛选的药物是否有效或疗效如何作出准确判断。因此,值得在今后的研究中进一步探讨,并将其应用于MS发病机理及预防治疗的课题研究中。

