含黄油的高脂饲料诱导高脂血症小鼠模型特征的研究*
李 静 杨俐萍 朱顺星 邵晶晶 刘玉山 陈旭东
(1.南通大学附属肿瘤医院肿瘤研究所中心实验室,南通 226361)(2.南通大学实验动物中心,南通 226001)(3.南通大学附属肿瘤医院病理科,南通 226361)
高脂血症(Hyperlipidemia)是血清中总胆固醇(total cholesterol,TC)、甘油三酯(total triglyceride,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)过高或血清高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)过低的一种全身脂代谢紊乱的疾病,是诱发动脉粥样硬化、脂肪肝、心脑血管疾病等的主要危险因素之一,其中胆固醇的代谢紊乱与动脉粥样硬化以及冠心病的发生密切相关[1-2]。随着人类生活水平的提高,脂类物质在膳食中的比例不断增加,高脂血症的发病率逐年攀升且趋于年轻化,严重影响人类的身体健康和生活质量[3-4]。高胆固醇血症(hypercholesterolemia)是一种常见的高脂血症,主要由肝脏胆固醇代谢紊乱引起。普遍认为血中TC或LDL-C过高是诱导动脉粥样硬化疾病的危险因子,是导致心脑血管疾病的重要危险因子之一[5-6]。文献资料报道,在发展中国家,心血管疾病的发病率和死亡率逐渐同发达国家居民相近,也是我国居民死亡的首要原因,中国每年有约300万人死于心血管疾病[7]。因此研制具有改善血脂的药物或保健食品对人类心脑血管健康有着重要意义,而高胆固醇血症动物模型的建立,为筛选抗动脉粥样硬化以及冠心病药物的研究提供动物实验基础。
近年关于对高脂血症动物模型建立的研究较多,资料表明,高脂血症动物模型主要有先天性、转基因和化学物质诱导等3种,其中高脂饲料喂养法相对而言操作简便,为目前国内常用方法[8]。应当指出的是,这些动物模型以血清中TC 和TG 均升高为特征,而且饲料中的脂肪成分是以猪油为主[9-12]。有资料表明,富含牛奶和黄油的饮食是高胆固醇血症发生的主要因素[13],黄油中的脂肪酸可以明显提高血浆TC及LDL-C浓度[13-15]。在牛奶及黄油中含有丰富的饱和脂肪及胆固醇,摄入过多时可引起明显的高胆固醇血症[13-14],从而导致冠心病。因此不难理解,为什么在西方国家认为乳制品摄入量是与冠心病发病率相关的主要原因之一。基于上述资料,本研究通过建立单纯的高胆固醇血症的小鼠模型,采用在诱导饲料中添加黄油替代传统方法中的猪油,观察实验小鼠血清TC,TG的变化特征,以及肝脏脂肪变性情况,为抗动脉粥样硬化的降血脂药物的研究提供动物实验基础。
1 材料与方法
1.1 实验动物
实验小鼠,来源于瑞典LUND大学实验动物中心(2012年由段瑞冬教授馈赠),经中国海关安全检查后入驻南通大学SPF动物中心,并饲养繁殖。该小鼠遗传背景为C57BL/6,近交系,由南通大学实验动物中心提供[SCXK(苏)2014-0001]。动物的饲养繁殖以及实验在南通大学实验动物中心进行[SYXK(苏)2012-0031],并通过南通大学实验动物伦理委员会的审批,批准号为NTU-KO-2017-0228-001。
1.2 高脂饲粮(high fat diet,HFD)配方及供应
基于已有报道高脂模型诱导饲料的配方,委托北京科澳协力饲料有限公司按以下成分及比例加工高脂饲料,黄油:15%,胆固醇:2%,玉米油:2%,奶粉:20%,蛋黄粉:10%,胆盐:0.5%,基础料:50.5%,其中胆固醇和蛋黄粉含量与文献报道相近或相同[16-17]。
1.3 动物分组饲养及观察指标
取同窝雄性小鼠20只,鼠龄为4~6周,分别随机分成2 组,每组10只,分别饲喂普通鼠粮(normal diet,ND)(不含黄油)和HFD。自由采食,自由饮水,实验期为120 d。实验过程中,每天观察实验小鼠外观形态变化、采食行为及其对外界反应等,每周测量小鼠体质量,每4周检测血中脂类浓度变化。在HFD喂养120 d后,处死小鼠并取材。
1.4 取材及检测方法
采血:禁食12 h后行小鼠眼内眦取血,取血量为每次80~100 μL/只,将小鼠全血置干燥管中,3 000 r /min离心10 min,保留上层血清,血清量为40~50 μL/只。每次取血结束后用无菌棉球按压止血。上机检测前用0.9%生理盐水进行1∶1稀释补足总量,最终血清学指标数值=检测值×稀释倍数。采用日立7600全自动生化分析仪测定总胆固醇(TC),总甘油三酯(TG),高密度脂蛋白(HDL)及低密度脂蛋白(LDL)的含量,其中TG和TC 含量采用液体双试剂酶法检测,HDL 和LDL 含量采用直接法检测。
内脏器官摘取:HFD喂养第120 d,给与小鼠禁食12 h后,采用麻醉机,给予小鼠七氟烷吸入性麻醉后,心脏取血 500~600 μL,3 000 r /min 离心10 min后,分离出上层血清,-80 ℃冰箱保存备用。断颈处死小鼠,摘取腹部脂肪、心脏、肝脏、脾脏和肾脏并称质量,计算脏器系数, 脏器系数=内脏湿重/体质量×100%。
肝脏病理学检查:用预冷生理盐水冲洗摘取的肝脏后,去除多余结缔组织,滤纸吸干。在肝脏最大叶距边缘5 mm 处取小块肝组织用10%中性甲醛溶液固定,制作切片,苏木精-伊红(HE)染色,光镜观察病理形态学变化。油红O染色: 切片以蒸馏水漂洗后加入油红O 染液15 min,用60%异丙醇漂洗1 min,即可镜下观察拍照。
1.5 统计方法

2 结果
2.1 一般情况
两组小鼠均未见死亡。HFD组小鼠毛发油亮,体型肥胖,行动稍缓慢(图1右)。ND组小鼠毛发及体型正常,活动灵活(图1左)。两组小鼠饮食、粪便均正常。
2.2 体质量的动态变化
从造模开始,动态记录各组小鼠体质量变化。造模开始后,HFD组小鼠体质量持续上升,第50天开始HFD组小鼠体质量与ND组比较差异有统计学意义(P<0.01)(图2)。第120天,HFD组小鼠体质量增长是ND组的3倍,两组比较差异有统计学意义(P<0.001)(表1)。

图2 各组小鼠体质量变化情况注:蓝色代表正常饮食组小鼠增长曲线;红色代表高脂饮食组小鼠增长曲线,高脂饲养小鼠的体质量增加值为同时间点的正常组值的倍数Fig.2 Changes of body weight in each groupNote:Blue represents the growth curve of mice in ND group;Red represents the growth curve of mice in HFD group. Increased fold of body weight in HFD group is based on the body weight of ND group

分组group0 d体质量/g0 d weight/g120 d体质量/g120 d weight/g质量增加/gWeight gain/g正常饮食组ND group21.92±3.5725.28±4.163.36±1.21高脂饮食组HFD group20.91±0.5331.45±2.1610.54±1.80∗∗∗
注:与正常饮食组比较,***P<0.001,n=10
Note:compared with ND group,***P<0.001,n=10
2.3 小鼠脏器系数变化
从表2可见,在120 d饲养后的小鼠, HFD组小鼠腹部脂肪质量系数及肝脏质量系数均显著增加,与ND组相比的差异有统计学意义(P<0.001),心脏、肾脏、脾脏器官的脏器系数均无明显变化。
2.4 小鼠血脂变化
造模30 d时,HFD组小鼠血清TC开始上升,第120天血清TC增高水平明显高于对照ND组,两组比较的差异有统计学意义(P<0.001)(表3)。其他血清学指标检测结果显示HFD组小鼠血清LDL值显著高于对照组(P<0.001),但是TG和HDL两组都未检测到升高变化(表3)。
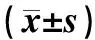
表2 两组小鼠脏器系数的变化Table 2 Changes in organ coefficient ofmice in each group
注:与正常饮食组比较,***P<0.001,n=4
Note:Compared with ND group,***P<0.001,n=4

表3 高脂饲料喂养120 d后小鼠血清学指标的变化Table 3 Changes in serum markers of micefed with HFD for 120 days
注:与正常饮食组比较,***P<0.001,n=10
Note:compared with ND group,***P<0.001,n=10
2.5 肝脏的病理学变化
肉眼观察喂养小鼠120 d后的肝脏,可见ND组小鼠的肝脏呈红褐色,表面光滑,边缘锐利,质软有弹性(图3 A),而HFD组小鼠的肝脏呈黄褐色,体积均匀性增大,肝脏质地较硬,包膜紧张,边缘钝而厚,表面及切面呈灰黄色,有油腻感(图3B)。HE染色后,ND组小鼠肝脏未见脂肪变性,小鼠肝细胞形态正常,肝索排列整齐,肝小叶结构正常,肝细胞中央有大而圆的核,无明显脂肪滴,未见明显的炎症细胞(图3C)。HFD组小鼠肝细胞核的相对大小不均,发生脂肪变性并伴有肝细胞坏死和炎性细胞浸润(图3D)。在油红O染色后,ND组小鼠肝脏有少量的脂肪滴红染(图3E),而HFD组小鼠肝脏有明显的红色脂肪滴(图3F)。

图3 高脂饲料诱导小鼠肝脏病理学变化注:A、C、E:正常饮食组小鼠肝脏外观及病理学改变;B、D、F:高脂饮食组小鼠肝脏外观及病理学改变。Fig.3 HFD induced pathological changes of liver in miceNote:A, C, E:Appearance and pathological changes of ND group mice liver; B、D、F:Appearance and pathological changes of HFD group mice liver
3 讨论
高脂血症诱发的心脑血管疾病严重危害人类健康。高脂血症本身引起的死亡并不多见,但在高脂血症由于脂质代谢紊乱、脂质过氧化、血液流变学异常、前列环素/血浆血栓素A2失衡[18]等情况时,易引起动脉粥样硬化、冠心病、高血压、糖尿病等多种疾病[1-6, 18-19]。这些疾病的发生多与饮食结构有关,心脑血管疾病在西方人多发与他们以高脂高蛋白为主的饮食习惯有关[3,6],而在我国特别是经济发达地区以高脂饮食为主的饮食结构已经逐步取代了低脂高纤维饮食,也出现高脂血症的发病率逐渐升高趋势[4]。因此,寻找高脂血症尤其是高胆固醇血症的发病原因,探讨高脂血症的预防和治疗,对人类健康有着深远的意义。为此,建立高脂血症特别是高胆固醇血症的动物模型是一个重要的前提。
本研究立足于建立单纯高胆固醇血症动物模型,在传统的高脂鼠料基础上[16-17],去除猪油成分而用牛奶制品黄油饲养小鼠。结果发现,经120 d含有牛奶黄油饲料喂养后,HFD组小鼠体质量增长非常明显,是ND喂养小鼠组体质量增长的3倍。有意义的是,HFD组小鼠血中TC和LDL明显升高,而TG及HDL无明显改变。此外,HFD组小鼠肝脏出现严重的脂肪变性及炎性细胞浸润。在我们的实验模型出现黄油诱导小鼠的血脂变化是符合人类高胆固醇血症形成的特点,即以TC和LDL升高为主。
黄油诱导肝脏脂肪变化和炎症与高胆固醇血症密切相关。机体摄入的胆固醇主要在肝脏中代谢,当摄入过多胆固醇或各种原因引起的胆固醇在肝脏中代谢障碍,导致胆固醇在肝脏中蓄积,肝脏出现严重的脂肪变性[19-20]。本研究中,HFD对小鼠肝脏质量影响明显,并且其肝脏颜色呈灰黄色,提示肝脏细胞有大量脂肪沉积,经HE染色后,可见HFD组小鼠肝脏被广泛的脂滴占据,并伴有肝细胞坏死和炎性细胞浸润。这些结果提示,过量摄入黄油引起高胆固醇血症最终导致脂肪肝及非特异性肝炎。本研究表明,饲料中添加黄油饲养可以成功地建立高胆固醇血症动物模型,其血脂变化是以TC,LDL明显升高而TG没有变化为特征,与人类高胆固醇血症的体征相似,并且具有肝脏脂肪变性及炎性细胞浸润的特点。本模型为高胆固醇血症及脂肪肝的研究提供一个很好的动物模型。
致谢:本研究中使用的实验小鼠来源于瑞典LUND大学实验动物中心(2012年由段瑞冬教授馈赠),感谢段瑞冬教授对本研究的悉心指导及无私帮助。感谢刘焕良及夏新龙给予的小鼠实验操作的技术帮助。

