生脉散对2型糖尿病大鼠胰岛β细胞NF-κB/IκB及VEGF表达的影响
吴小慧,刘菲,段忠心
(南华大学附属第二医院,湖南衡阳421001)
2型糖尿病(T2DM)发生、发展的始动因素是胰岛素抵抗[1],而胰岛素抵抗还是一个慢性亚临床炎症反应过程[2]。NF-κB/IκB信号通路是炎症导致胰岛素抵抗和胰岛β细胞功能减退以及动脉粥样硬化的重要途径之一[3]。中医认为,糖尿病的发病机制主要为阴津亏损、燥热偏盛。生脉散是益气养阴的基础方,临床常用于治疗糖尿病,但目前对其作用机制尚不清楚。2015年3~12月,本研究观察了生脉散对T2DM大鼠胰岛素抵抗、胰岛β细胞NF-κB/IκB表达及血管内皮生长因子(VEGF)表达的影响,旨在探讨生脉散治疗T2DM的作用机制。
1 材料与方法
1.1 实验动物 健康雄性SD大鼠120只,清洁级,8周龄,体质量180~225 g,购自南华大学实验动物学部,动物许可证号:SYXK(湘)2015-0001。本研究经南华大学动物伦理委员会批准。
1.2 主要药物、试剂及仪器 生脉散组方:人参9 g、麦门冬9 g、五味子6 g,购自湖南三湘中药饮片有限公司,经加工研制成汤剂,由南华大学附属第二医院中药房提供;SYBRGreen qPCR试剂盒(上海达为科生物科技有限公司),链脲佐菌素(美国Sigma公司),阿司匹林肠溶片(湖南新汇制药股份有限公司);PCR仪器(美国ABI公司),离心机(长沙湘仪离心机仪器有限公司),血糖仪(长沙三诺生物传感股份有限公司)。
1.3 动物分组、模型制备及药物干预 将120只SD大鼠随机分为A组20只和造模组100只。A组予以基础饲料喂养。造模组基础饲料适应性喂养1周,给予高脂饲料(碳水化合物热卡占20%,脂肪热卡占61%,蛋白质热卡占19%,脂肪成分主要为熟猪油)喂养8周,一次性腹腔注射0.25%链脲佐菌素30 mg/kg(用pH 4.4的0.1 mol/L无菌枸橼酸缓冲液配制)。注射72 h测血糖>16.7 mmol/L,表明造模成功。造模组建模成功70只,随机分为B、C、D、E、F组,每组14只。B组给予等量生理盐水灌胃,C组给予0.2 g/(kg·d)阿司匹林灌胃,D、E、F组给予4.7、9.4、18.8 g/(kg·d)生脉散汤剂灌胃,持续治疗4周。实验期间,A、B、C、D、E、F组分别死亡6、3、1、2、1、3只。
1.4 空腹血糖(FPG)、空腹胰岛素(FINS)检测及胰岛素敏感性指数(ISI)、胰岛素抵抗指数(HOMA-IR)计算 治疗前及治疗4周,大鼠进食12 h,尾静脉取血约5 mL,离心留取血清,-20 ℃冰箱保存。分别采用血糖仪和ELISA法检测FPG、FINS,计算ISI、HOMA-IR。ISI=1/FBG×FINS,HOMA-IR=FBG×FINS/22.5。
1.5 血清VEGF检测 大鼠麻醉后球后取血5 mL,按ELISA试剂盒说明书进行加样,封膜板盖住反应板,恒温箱温育约60 min,洗涤后加入显色剂,恒温避光显色12 min,加入终止液,10 min后采用酶标仪依序测量各孔的吸光度。根据标准品曲线,计算血清VEGF水平。
1.6 主动脉血管结构观察 大鼠麻醉后,迅速取出主动脉组织,4%多聚甲醛固定,石蜡包埋,4 μm厚连续冠状切片。切片分别予二甲苯脱蜡、梯度乙醇脱水、苏木素-伊红染色、乙醇复脱、二甲苯透明,树胶封片,显微镜下观察。
1.7 胰腺组织NF-κB、IκB mRNA检测 大鼠麻醉后,迅速取出胰腺组织,- 80 ℃保存,按照试剂盒和逆转转录试剂盒说明书进行RNA提取和cDNA制备,然后进行PCR扩增。NF-κB上游引物:5′-AGTTGGAGCAGCTGCAGCGC-3′,下游引物:5′-GGAGGGCTCCGCTGGTT-3′;IκB上游引物:5′-GCAACCCAGTGGTGGCCCAG-3′,下游引物:5′-CTCCCGCTGGCTGACCTGGA-3′;β-action上游引物:5′-AGAACATCATCCCTGCATCC-3′,下游引物:5′-TGGATACATTGGGGGTAGGA-3′。经吸光度扫描仪扫描,PCR条带用软件进行定量分析,基因表达量用β-action内参进行标准化。
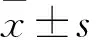
2 结果
2.1 各组治疗前后FPG、FINS比较 见表1。
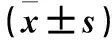
表1 各组治疗前后FPG、FINS比较
注:与同组治疗前比较,aP<0.05;与B组治疗同期比较,bP<0.05;与C组治疗同期比较,cP<0.05。
2.2 各组治疗前后ISI、HOMA-IR比较 见表2。
2.3 各组治疗前后血清VEGF水平比较 A、B、C、
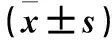
表2 各组治疗前后ISI、HOMA-IR比较
注:与同组治疗前比较,aP<0.05;与B组治疗同期比较,bP<0.05;与C组治疗同期比较,cP<0.05。
D、E、F组血清VEGF水平分别为(211.430±11.359)、(273.910±4.527)、(258.690±4.423)、(262.170±5.149)、(247.080±4.907)、(245.450±3.532)pg/mL。与A组比较,B、C、D、E、F组血清VEGF水平均明显升高(P均<0.05);与B组比较,C、D、F组血清VEGF水平均明显降低(P均<0.05);与C组比较,E、F组血清VEGF水平均明显降低(P均<0.05)。
2.4 各组主动脉血管结构比较 A组血管内侧壁平整光滑,平滑肌细胞排列整齐;与A组比较,B组血管内侧壁内膜粗糙,平滑肌细胞排列紊乱;与B组比较,C、D、E、F组血管内侧壁内膜稍粗糙,平滑肌细胞排列不规则,E、F组血管壁结构损伤较C、D组有所缓解。
2.5 各组胰岛β细胞NF-κB、IκB mRNA表达比较 见表3。
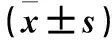
表3 各组胰岛β细胞NF-κB、IκB mRNA相对表达量比较
注:与B组比较,aP<0.05;与C组比较,bP<0.05。
3 讨论
目前,国内糖尿病患者数量超过1亿,其中T2DM约占90%[4]。在T2DM患者中,胰岛素抵抗的发生率超过80%[5],胰岛素抵抗与NF-κB信号转导通路关系密切。糖尿病状态下,高血糖、高血脂及胰岛素抵抗等病理机制诱发的炎症反应,是导致糖尿病冠状动脉粥样硬化性心脏病发生、发展的重要原因[6],通过降低炎症反应、改善胰岛素抵抗、控制血糖水平是防治糖尿病性冠心病的重要途径。
糖尿病在中医学中属于“消渴”范畴,主要病机为阴虚为本、燥热为标。生脉散出自《医学启源》一书,方中人参甘温,有益元气,具有生津液、补肺气的作用,用以为君;麦门冬甘寒,具有润肺生津、养阴清热的作用,是为臣药;人参与麦门冬合用,更彰显益气养阴之效;五味子酸温,有敛肺止汗、生津止渴之功,为佐药;三药合用,一补一润一敛, 益气养阴,气充脉复,为益气养阴的基础方,临床上常用于治疗糖尿病[7,8]。但目前对其作用机制尚不清楚。
NF-κB是一个具有多向转录激活功能的调节因子,是炎症介导胰岛素抵抗和胰岛β细胞功能减退的重要途径,属于炎症反应过程的关键调控因子,主要通过氧化应激引起炎症反应,继而导致糖尿病及其并发症的发生[3]。IκB位于细胞质内,主要在非激活状态下通过拦截NF-κB的核定位序列阻止NF-κB的核定位,抑制其激活,IκB受IκK的调节,使其丝氨酸残基磷酸化[9],诱导IκB快速分解,充分暴露NF-κB的核定位序列,激活后迅速移位,与κB的位点结合,调节靶基因转录,参与炎症反应和细胞分化,引起胰岛素抵抗和胰岛β细胞功能减退。同时,NF-κB还能诱导外周血单个核细胞,使单核细胞向动脉内膜迁移形成泡沫细胞,加速动脉粥样硬化,引起糖尿病相关并发症[10]。VEGF能够增加血管通透性,对单核细胞和巨细胞有化学趋化作用,是糖尿病血管病变的高危因子[11,12],可引起血管壁结构改变,加速动脉粥样硬化形成。
本研究结果显示,E、F组能显著降低FBS、FINS和HOMA-IR,升高ISI,降低血清VEGF水平,改善血管壁结构,降低NF-κB mRNA,提高IκB mRNA表达,效果优于C组;而D组上述效果与C组比较无明显统计学差异,说明精确的剂量控制才能使生脉散发挥最佳的治疗效果。
总之,生脉散能够明显改善T2DM大鼠胰岛素抵抗,降低血清VEGF水平,改善血管壁结构,其作用机制可能是通过抑制NF-κB/IκB表达实现的。

