云南红河州小反刍兽疫的血清学及分子流行病学调查
张容萍,王 薇,刘佳升,李晓红,段锐锐,郑玉芳,陈培富*
(1.云南农业大学动物医学院,云南昆明 650201;2.红河州动物疫病控制中心,云南蒙自 661100)
小反刍兽疫(Peste des petits ruminants,PPR)俗称羊瘟,是一种以发热、眼和鼻浆(脓)液性分泌物、坏死性口腔炎、胃肠炎和支气管肺炎为特征的急性、接触性传染病[1]。该病后期因动物继发细菌或寄生虫感染,病死率很高,最高可达100%[2],由此造成巨大经济损失[3]。其病原为副黏病毒科(Paramyxoviridae)麻疹病毒属(Morbillivirus)中的小反刍兽疫病毒(Peste des petits ruminants virus,PPRV),有明显的淋巴组织和上皮组织嗜性。该病毒粒子呈圆形,由核衣壳蛋白(N)、磷蛋白(P)、大蛋白(L)等成分构成[4]。PPRV分为4个基因系[5],但只有1个血清型[6]。该病毒主要感染山羊和绵羊,引起的临床症状和病理变化与牛瘟(Rinderpest,RP)极为相似,抗原性与RPV相近并具有血清学交叉保护作用[7],甚至可引起牛无症状和不排毒的自然感染,于是有人曾提出PPRV是牛瘟病毒(Rinderpest virus,RPV)适应小反刍兽的一个变种的说法[8],但后来证明并不同于RPV[9]。由于可使用RP疫苗预防PPR[10],很多国家和地区忽视了对PPR的研究和防控,并由于PPRV不断变异使RP疫苗不再提供交叉保护作用,以致形成PPR在非洲和亚洲快速扩散的局面。
2006年初,孟加拉国、印度、尼泊尔、巴基斯坦、哈萨克斯坦、塔吉克斯坦、蒙古等邻近国家先后暴发大规模PPR疫情[11-12]。2007年,PPR首先传入我国西藏,2013年年底扩散至新疆,随后仅仅2个月,就在甘肃、内蒙古、宁夏、湖南、辽宁、安徽和重庆7个省份发生。截止2014年年底,我国共有22个省份261个县发生疫情,总体呈从西向东扩散趋势[13-14],其中云南发病数最多[15]。从2017年起,PPR已被我国农业部列入国家强制免疫计划。为了解小反刍兽疫在红河州的流行情况及防控现状,我们对近年采集自当地的样品,应用酶联免疫吸附试验(ELISA)和反转录-聚合酶链反应(RT-PCR)进行小反刍兽疫的血清学及分子流行病学调查。
1 材料与方法
1.1 材料
1.1.1 动物样品 样品包括来自2014年3月—2016年10月接种新疆天康公司小反刍兽疫减毒疫苗(Nigeria 75/1弱毒株)的山羊血清和组织,具体包括采集自红河州13个县市、132个乡镇抽检的免疫羊血清920份,采集自红河州10个县市、132个乡镇采集的结膜分泌物及鼻、口腔、直肠等拭子,以及淋巴结、扁桃体、脾、肺、大肠等组织215份。
1.1.2 主要试剂和仪器 ELISA试剂盒,国家级动物虫媒病检测重点实验室产品;Arthos 2010型酶标仪,郑州博赛安图公司产品;蛋白酶K,MERCK公司产品;AxyPrep体液病毒,Axygen公司产品;10×one step RNA PCR buffer,宝生物工程(大连)有限公司产品;dNTP Mixture,上海生工生物工程技术服务有限公司产品;PCR仪,Tadvanced公司产品。
1.1.3 引物及参考序列 以GenBank EU360596.1为参考序列,设计扩增病毒N基因大、小片段的PCR引物。小片段正向引物(PPRV-F1)为TCT CGG AAA TCG CCT CAC AGA CTG,反向引物(PPRV-R1)为CCT CCT CCT GGT CCT CCA GAA TCT,预期扩增片段长度339 bp。大片段(含全长N基因)正向引物为(PPRV-F2)GAG GAG GAG GAG CAA GAT CTC TGA TT,反向引物(PPRV-R2)为TCT CGT CAC TGA TTT CGA CAG AGG GT,预期扩增片段长度1 694 bp。用于比对的国内外毒株参考序列有17条(表1)。

表1 PPRV参考毒株
1.2 方法
1.2.1 ELISA竞争法检测血清抗体 待血液凝固,收集血清,放入4℃冰箱保存。按照ELISA试剂盒说明书测定血清抗体,由酶标仪读取OD值,计算抑制百分率(PI)值,PI=100-(被检血清平均OD值/单克隆抗体对照平均OD值)×100。结果判定标准:PI≥50的为PPRV感染阳性(50~79之间为弱阳性,大于80为强阳性);PI<50的为PPRV感染阴性。
1.2.2 RT-PCR扩增分析PPRV核酸片段
1.2.2.1 RNA的提取 取一小块组织病料,剪碎后放入一个1.5 mL灭菌Eppendorf管,加入200 μL组织裂解液,用大口径枪头吹打混匀;然后加入20 μL蛋白酶K,颠倒使之充分混匀;将裂解物放置在55℃水浴3 h或者直至组织消化完全。按AxyPrep体液病毒DNA/RNA小量试剂(离心柱型)使用说明,提取病毒RNA,置-80℃冻存备用或立即做反转录。
1.2.2.2 RT-PCR扩增 按照RT-PCR一步法试剂盒说明书,配制50 μL反应体系,其中10×One step RNA PCR buffer 5 μL,MgCl2(25 mmol/L)10 μL,dNTP Mixture(10 mmol/L)5 μL,RNase inhibitor(40 U/μL)1 μL,AMV RNase XL(5 U/μL)1 μL,AMV-OptimizedTaq(5 U/μL)1 μL,Forward primer(20 pM)1 μL,Reverse primer(20 pmol/L)1 μL,RNase-free H2O 24 μL,RNA模板1 μL。扩增条件:42℃ 60 min;94℃ 5 min;94℃ 1 min,55℃ 30 s,72℃ 30 s,共35个循环;72℃ 10 min。取PCR扩增产物进行10 g/L琼脂糖凝胶电泳,应用BDA live分析系统检查扩增结果。切下含有目的条带的凝胶块,放入离心管,按DNA回收纯化试剂盒操作纯化,置-20℃保存备用。
1.2.3 阳性RT-PCR产物测序鉴定及序列的分析比对 选取N基因大片段扩增呈阳性的PCR产物,送样由上海生工生物工程技术服务有限公司进行双向核苷酸序列测定。应用DNA Star软件将所获7条核苷酸序列和搜索自GenBank的17条PPRV参考序列保存为*.Seq和*.Pro格式文件,并调用MegAlign程序进行Clustal W模式比对,然后在Veiw菜单中Sequence Distance和Phylogenetic Tree提取序列比对结果和进化树图。结合毒株时空分布情况,分析红河州PPRV毒株的来源及演变特征。
2 结果
2.1 ELISA检测结果
在被检920份羊血清样品中,抗体阳性650份,即阳性率为70.65%,除绿春县和屏边县外,全州其余县市的免疫血清抗体阳性率均较高(图1)。从采集血清样品的时期看,以2015年3月的样品阳性检出率最低。
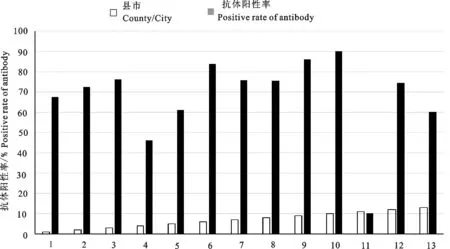
1.个旧;2.开远;3.蒙自;4.屏边;5.建水;6.石屏;7.弥勒;8.泸西;9.元阳;10.红河;11.绿春;12.金平;13.河口
1.Gejiu;2.Kaiyuan;3.Mengzi;4.Pingbian;5.Jianshui;6.Shiping;7.Mile;8.Luxi;9.Yuanyang;10.Honghe;11.Lüchun;12.Jinping;13.Hekou
图1红河州不同县市PPR免疫抗体阳性率分布情况
Fig.1 Distribution of positive rates of serum antibodies against PPR vaccine in counties of Honghe prefecture
2.2 RT-PCR检测结果
在被检215份组织样品中,屏边县样品病毒核酸阳性率最高,为59.46%,其次是绿春县33.33%、蒙自市20%、建水县14.29%、个旧市13.16%和元阳县8.33%,其余县市为阴性。RT-PCR扩增呈阳性的条带与疫苗株阳性对照条带相符(图2)。
2.3 PPRV N基因同源性比较和遗传进化分析
2.3.1 PPRV N基因核苷酸的同源性比较结果 就N基因核苷酸同源性而言,红河州PPRV毒株与新疆伊犁XJYL2013株、西藏3个毒株、河南省3个毒株、北京市毒株及广东毒株的同源性分别为99.7%~100%、97.8%~98.1%、99.6%~99.9%、98.9%~99.2%和27.9%~30.4%,均高于与Nigeria /75 /1疫苗株的同源性(93.3%~93.6%)。与国外毒株相比,红河州毒株与其他国家毒株的核苷酸同源性范围为88.6%~98.1%(图3),以India 2003株最高,以Uganda 2012株最低。

M.DNA标准DL 2 000;1、2.不同县市来源的阳性样品;3.疫苗株阳性对照;4.阴性对照
M.DNA Marker DL 2 000;1,2.Positive samples from different counties;3.Nigeria75/1 vaccine strain;4.Negative control
图2 PPRV阳性样品RT-PCR扩增产物电泳分析
Fig.2 Electrophoresis analysis of RT-PCR products from partial PPRV positive samples

图3 PPRV N基因核苷酸的同源性比较
2.3.2 与标准株的N基因片段序列比对结果 所获7条红河州PPRV核苷酸序列与国内其他毒株比对,未见颠换、缺失或插入现象,均为转换位点。当地流行毒株与新疆伊犁和河南毒株最为相似,偶见636位点存在C→T转换,与北京和西藏毒株相比则存在多位点突变,与国外毒株碱基差异较大(表2)。
2.3.3 N基因遗传进化树分析结果 N基因系统进化树显示,2015年中国云南省红河州毒株与中国西藏毒株、新疆毒株和中国2014年内地毒株均属于基因Ⅳ系PPRV,但2013年—2015年毒株与中国西藏毒株划分为2个不同的小分支,中国株与印度株和土耳其株进化关系最近(图4)。

表2 N基因序列比较

图4 基于PPRV N基因建立的遗传进化树
3 讨论
本试验采用竞争ELISA检测血清,发现抗体阳性率为70.65%,表明疫苗免疫效果较好。疫苗接种是防控PPR的主要手段[16]。目前用Vero细胞传代研制的小反刍兽疫减毒疫苗有Nigeria 75/1、Sungri/96、Arasur/87和Coimbatore/97等4株[15,17]。本次调查羊群接种的疫苗为Nigeria 75/1株(基因Ⅱ系毒株),发现有的县市抗体合格率不是很高,提示可能存在保护不全、传入疫病的风险。由于云南山区较多,养殖户分散且偏远,疫苗在运输过程中若保存不当,很容易失效。就PPR而言,羊群的发病率和病死率主要由动物免疫状态和毒株毒力共同决定。当地农户采取以放牧为主的养殖模式,以及牲畜交易,使PPRV有机会感染未有效免疫的羊群。虽然疫苗接种对控制该病非常重要,但由于PPRV还可自然感染羚羊、鹿等野生动物[8],根除该病是很困难的。
应用RT-PCR检测组织样品携带PPRV保守性N基因核酸片段的情况,发现阳性率为20.46%,进一步研究发现,当地PPRV流行毒株基因型与印度株和土耳其株很近。有学者根据PPRV基因序列的差异,将其划分为4个系:Ⅰ系分布在西非,Ⅱ系在非洲北部的尼日利亚和喀麦隆,Ⅲ系主要分布在东非,而Ⅳ系主要分布在中东和西亚。本次检出的流行毒株与国内其他地区的流行毒株均为基因Ⅳ系,与周边国家一致,故其传播来源应为与中国接壤的西部或西南部国家[14]。云南省有较长的边境线,与PPRV流行的多个国家相邻,存在跨境传入疫病的风险,但从本次调查结果来看,当地流行毒株与国内其他流行毒株的N基因同源性最高,与印度株和土耳其株次之,推测最初从国外传入,再伴随引种传入云南。由于我们未开展流行毒株的分离培养和全基因组测序分析,所检流行毒株的具体来源有待确定。总之,严格检疫是除疫苗接种外的PPR防控必要手段。
[1] Bao J Y.Sequence analysis of the nucleocapsid gene and genome promoter region of peste des petits ruminants virus of Chinese origin[J].Bing Du Xue Bao,2008,24(6):464-471.
[2] Torsson E,Kgotlele T,Berg M,et al.History and current status of peste des petits ruminants virus in Tanzania[J].Infect Ecol Epidemiol,2016,6:10.
[3] Banyard A C,Parida S,Batten C.Global distribution of peste des petits ruminants virus and prospects for improved diagnosis and control[J].Gen Virol,2010,91(12):2885-2897.
[4] Yang Y,Qin X D,Song Y M,et al.Development of real-time and lateral flow strip reverse transcription recombinase polymerase amplification assays for rapid detection of peste des petits ruminants virus[J].Virol J,2017,14(1):24.
[5] 肖 敏,包世俊,邢小勇,等.小反刍兽疫病毒甘肃株F基因的克隆、原核表达及多克隆抗体的制备[J].农业生物技术学报,2017,25(3):477-484.
[6] ShailaM S.Geographic distribution and epidemiology of peste des petits ruminants virus[J].Virus Res,1996,43(2):149-153.
[7] Rahman A,Abubakar M,RassoolM H,et al.Evaluation of risk factors for peste des petits ruminants virus in sheep and goats at the wildlife-livestock interface in Punjab province,Pakistan[J].Bio Med Res Int,2016(12):7826245.
[8] Hamdy F M.Immunologic relationship between rinderpest and peste des petits ruminants viruses[J].Proc Annu Meet U S Anim Health Assoc,1975,(79):168-179.
[9] Chandran N D,Kumanan K,Venkatesan R A.Differentiation of peste des petits ruminants and rinderpest viruses by neutralisation indices using hyperimmune rinderpest antiserum[J].Trop Anim Health Prod,1995,27(2):89-92.
[10] 王 竹.小反刍兽疫疫苗的研究进展[J].畜牧兽医科技信息,2011,8(2):3-4.
[11] 罗 静,何宏轩.小反刍兽疫病毒的分子生物学特性及其在全球的流行[J].河北师范大学学报:自然科学版,2009,33(4):543-550.
[12] 王志亮.家畜传染病学分会第十三次学术研讨会学术报告之二——我国小反刍兽疫的发现及其在匿藏地区自然演化规律的研究[J].兽医导刊,2009(10):10-11.
[13] 南文金.小反刍兽疫病毒分子生物学与疫苗研究进展[J].中国动物检疫,2009,26(1):62-65.
[14] 刘永宏,赵 丽,曹胜波,等.小反刍兽疫在中国的流行趋势及应对措施[J].动物医学进展,2015,36(1):110-113.
[15] 李金明,吴晓东,王志亮,等.我国小反刍兽疫的历史与现状[C]//中国畜牧兽医学会动物传染病学分会第十六次学术研讨会论文集,山东济南:2015:38-40.
[16] Hammami P,Lancelot R,Lesnoff M.Modelling the dynamics of post-vaccination immunity rate in a population of Sahelian sheep after a vaccination campaign against peste des petits ruminants virus[J].PLoS One,2016,11(9):e0161769.
[17] 苏 一. 小反刍兽疫疫苗研究进展[J].畜禽业,2015(4):9.

