防霉剂脱氢醋酸钠致大鼠出血试验
余峥嵘,吴银超,谢佳玉,谢 阳,李 楠,鲁倩倩,张雨梅,2*
(1.扬州大学兽医学院,江苏扬州 225009;2.江苏省动物重要疫病与人兽共患病防控协同创新中心,江苏扬州 225009)
脱氢醋酸钠(sodium dehydroacetate)对多种霉菌、酵母菌、细菌具有较好的抑制作用,是联合国粮农组织(FAO)和世界卫生组织(WHO)批准使用的一种食品防腐剂。我国《食品添加剂使用标准》(GB 2760—2014)规定其在食品中的一般使用量为0.3 g/kg~0.5 g/kg。被广泛应用于各类食品如酱油、酱菜、果汁、面包、蛋糕、广式月饼、人造奶油和腐乳、米面制品、月饼、汤料及饮料、鱼肉类、乳制品、豆制品、酱油等的防腐防霉[1-4],也可用于农产品的保鲜、饲料的防霉及化妆品、药物等的防腐[5-6]。
有关脱氢醋酸钠的毒性研究表明,大鼠经口LD50为1 000 mg/kg体重,小鼠经口LD50为1 330 mg/kg体重。脱氢醋酸钠对大鼠的亚慢性毒性试验表明,大鼠连续每日服用脱氢醋酸钠300 mg/kg,动物逐渐表现出食欲消退、体重减轻、胃黏膜不同程度出血、血中尿素氮含量升高等不同症状[7-8]。近年来还有脱氢醋酸钠引起过敏的报道[9-11]。
Yamashoji S等[12]检测脱氢醋酸钠对NIH/3T3和神经-2a细胞的IC50值分别为0.44 g/L和0.55 g/L,进而推算出脱氢醋酸钠的每日允许摄入量(ADI)为0.5 g/kg。而Priputina L S等[13]根据脱氢醋酸钠对大鼠的试验结果,推荐ADI为0.013 mg/kg。目前为止,WHO和食品添加剂联合专家委员会(JECFA)等权威机构均未发布脱氢醋酸钠的ADI。本文通过经口绐予大鼠不同剂量脱氢醋酸钠,测定凝血酶原时间(prothrombin time,PT)和活化部分凝血酶原时间(activated partial thromboplastin time,APTT),以及组织病理学分析,研究脱氢醋酸钠对大鼠可能导致的出血倾向,为脱氢醋酸钠作为食品、饲料添加剂的使用安全性评价提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 Wistar大鼠,体重180 g~200 g,公母各半,由扬州大学比较医学中心提供。动物生产许可证号:SCXK(苏)2012—0004,使用许可证号:SYXK(苏)2012—0029。饲喂经60Co照射饲料,24℃±2℃,湿度60%±20%,饮水为符合城市饮用水标准的自来水。试验前在实验环境中适应3 d,不限制饮水。
1.1.2 试剂与仪器 脱氢醋酸钠(纯度99.8%) , 江苏天成动物保健公司产品;PT测定试剂盒(冻干型)、APTT测定试剂盒(鞣花酸),上海太阳生物技术有限公司产品,4℃保存备用;戊巴比妥钠、柠檬酸三钠,上海市苏懿化学试剂有限公司产品。
TRON M4凝血仪,德国TECO Gmbh公司产品;切片机、倒置显微镜,德国Leica公司产品;高速台式冷冻离心机,德国Eppendorf公司产品;Synergy小型纯水系统,美国默克密理博公司产品。
1.2 方法
1.2.1 分组与处理 Wistar大鼠,随机分成5组,公母各半。试验分组分别为脱氢醋酸钠50、100、150、200 mg/kg组,对照组生理盐水。按1 mL/100 g体重灌胃给予,连续12 d。分别于第5、7、9、11、13、15天,每组大鼠公母各4只,经20 mg/mL戊巴比妥钠麻醉后腹主动脉采集血液用于PT和APTT测定。于第13天处死后剖检大鼠,观察内脏有无眼观病理变化,并取心脏、肝脏、脾脏、肺脏、肾脏等器官,固定后HE染色进行组织病理学观察。
1.2.2 体重及饲料消耗的测定 分别在给药后的第1、3、7、10、13天称取大鼠体重,并计算饲料消耗量。
1.2.3 PT和APTT的测定
Linsanity:翻译为中文是林书豪热、林疯狂。这个词就是:林书豪的姓的首字母L+insanity(疯狂)组合起来的新词。当时Jeremy Lin 的表现越来越神勇了,刚拿下NBA东部一周最佳球员称号,又在与猛龙的对决中最后0.5秒3分绝杀带领球队取得了六连胜。球迷们用新词“Linsanity”来对林书豪人气进行概括。
1.2.3.1 大鼠血浆的制备 血液与31.3 mg/mL柠檬酸酸钠按9∶1比例混匀,静置15 min~30 min后,3 500 r/min离心10 min。所得血浆按试剂盒说明书立即进行PT、APTT测定。
1.2.3.2 PT的测定 取大鼠待测血浆50 μL至样品杯中,放入血凝仪,37℃孵育3 min, 加入37℃预温的PT试剂100 μL,记录凝血酶原时间即为PT值。
1.2.3.3 APTT的测定 取大鼠待测血浆50 μL至样品杯中,加入37℃预温的APTT试剂50 μL,37℃孵育5 min。再加入37℃预温的0.025 mol/L CaCl2溶液50 μL,记录部分促凝血酶原时间即为APTT值。
1.2.4 组织病理学观察 将采集的大鼠心脏、肝脏、脾脏、肺脏和肾脏,用40 g/L甲醛固定后,按常规方法进行石蜡切片的制备。经HE染色后,显微镜下观察组织的病理学变化。
1.2.5 数据分析 数据采用GraphPad Prism软件进行数据分析,试验数据用平均值±标准差表示。采用单因素方差分析进行统计分析。
2 结果
2.1 脱氢醋酸钠对大鼠体重和饲料消耗的影响
2.1.1 脱氢醋酸钠对大鼠体重的影响 不同剂量脱氢醋酸钠对大鼠体重的影响见表1。
由表1可以看出,与正常组比较,50 mg/kg组雄性大鼠在用药期间与正常组大鼠体重相当;而100、150、200 mg/kg组,在给予脱氢醋酸钠10 d 后,雄性大鼠体重显著降低(P<0.05)。100 mg/kg~200 mg/kg组雄性大鼠试验期内总增重均显著低于对照组(P<0.05)。雌性大鼠在给予脱氢醋酸钠7 d后体重均低于对照组,50、150、200mg/kg组差异显著(P<0.05);100 mg/kg组在10 d 后也显著低于对照组(P<0.05)。50 mg/kg和100 mg/kg组总增重显著低于对照组,150 mg/kg和200 mg/kg组在用药期间体重负增长。
2.1.2 脱氢醋酸钠对大鼠饲料消耗的影响 不同剂量脱氢醋酸钠对大鼠饲料消耗的影响见表2。
由表2可以看出,在用药第3天后,脱氢醋酸钠各组大鼠饲料消耗均低于正常组,差异显著(P<0.05)。随着用药时间的延长,脱氢醋酸钠处理的各组雌性大鼠的饲料消耗明显低于雄性大鼠。7 d 时,雌性大鼠的饲料消耗比正常对照组减少了19%~28%;雄性大鼠的饲料消耗比正常对照组减少了15%~21%。至13 d时,雌性大鼠的饲料消耗比正常对照组减少了69%~76%;雄性大鼠的饲料消耗比正常对照组减少了62%~71%。
2.2 脱氢醋酸钠对大鼠PT、APTT的影响
2.2.1 对大鼠PT的影响 图1为脱氢醋酸钠处理后雄性及雌性大鼠的PT值。氢醋酸钠处理5 d 后,所有时间点的PT值均极显著高于正常对照组(P<0.01)。50 mg/kg~200 mg/kg间无明显剂量效应关系,雌性及雄性间PT值无明显差别。
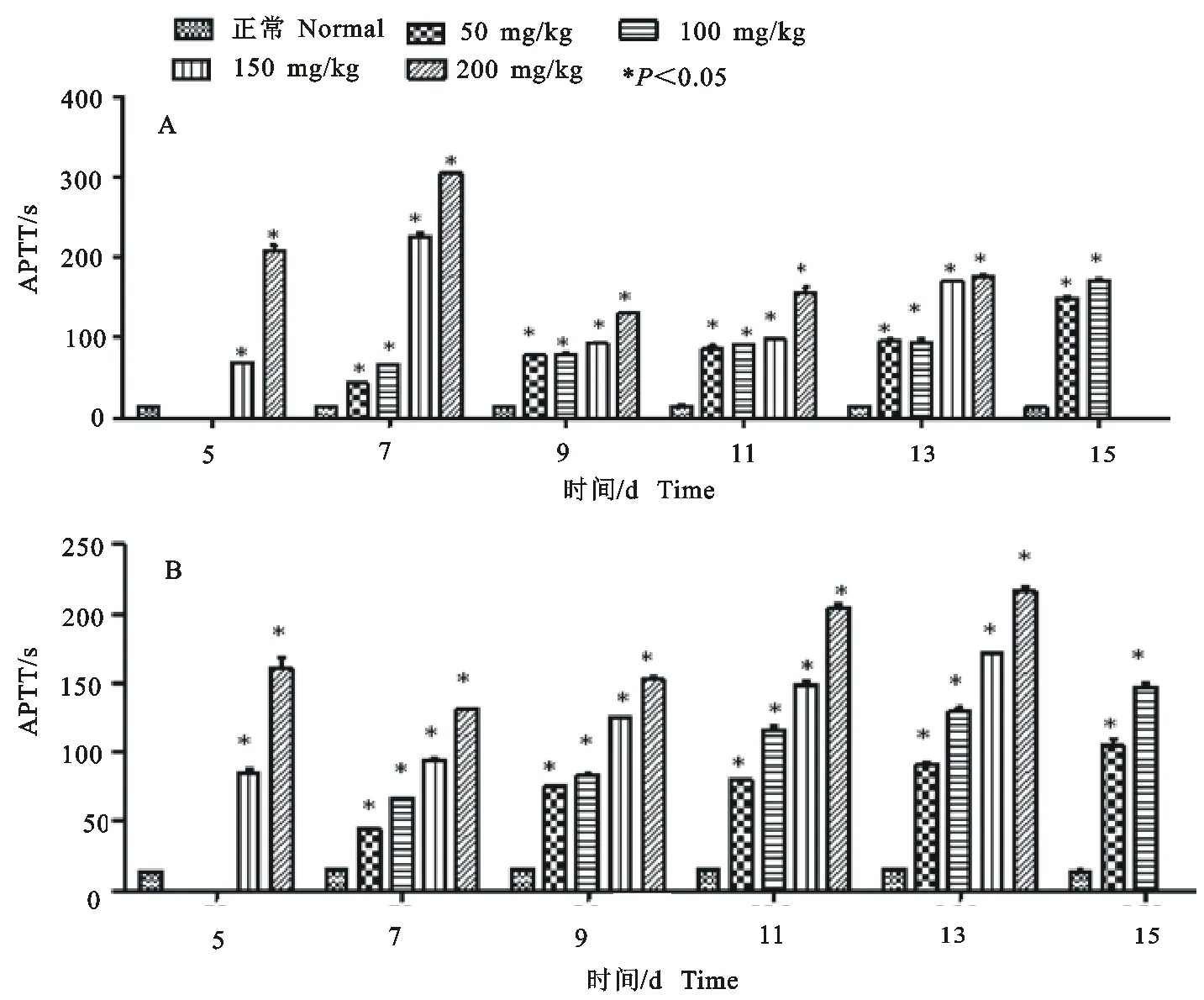
2.2.2 对大鼠APTT的影响 图2为大鼠APTT测定数据。从图2中可以看出,雄性或雌性大鼠服用脱氢醋酸钠后各组APTT值与对照组比较极显著延长(P<0.01)。给予200 mg/kg脱氢醋酸钠5 d~7 d时,雄性大鼠的APTT值高达200 s~300 s,远高于雌性大鼠的160 s~130 s。雌性大鼠在7 d~13 d间,APTT值随剂量的增加而增加,有较明显的剂量效应关系;100 mg/kg~200 mg/kg剂量组,APTT值随时间延长而增加,表现出时间效应关系;200 mg/kg 组13 d时超过200 s。而150 mg/kg和200 mg/kg雄性大鼠在第7天APTT出现峰值后,维持在相对稳定的水平(150 s~170s)。
2.3 脱氢醋酸钠致大鼠主要脏器出血情况
在给予脱氢醋酸钠后第13天处死后剖检大鼠,偶见皮下组织、肝脏和肾脏表面有出血点,未见明显较多出血。其他组织无眼观出血现象。
2.3.1 致大鼠肝脏出血 不同剂量脱氢醋酸钠处理后,大鼠肝脏的病理切片见图3。不同剂量脱氢醋酸钠均可引起大鼠肝脏表现出不同程度的出血倾向,随着脱氢醋酸钠剂量的增加,出血程度有所加重,特别是D和E在肝小叶间隙可以看到明显的出血点。

表1 脱氢醋酸钠对大鼠体重的影响
注:角标相同字母表示差异不显著(P>0.05);不同字母表示差异显著(P<0.05)。
Note:Values with same letters means no significant difference in the same column(P>0.05),and with different letters mean significant difference(P<0.05).

表2 脱氢醋酸钠对大鼠饲料消耗的影响
注:角标相同字母表示差异不显著(P>0.05);不同字母表示差异显著(P<0.05)。
Note:Values with same letters means no significant difference in the same column(P>0.05),and with different letters mean significant difference(P<0.05).
2.3.2 致大鼠脾脏、肺脏、肾脏和心脏出血 200 mg/kg脱氢醋酸钠处理后,大鼠的脾脏、肺脏、肾脏和心脏病理切片见图4。
由图4可以看出,200 mg/kg组大鼠服用脱氢醋酸钠后,心脏、脾脏、肺脏和肾脏有不同程度的出血现象,特别肺脏和肾脏出血较为明显。可见肺组织中弥漫性出血,肾脏皮质及髓质均有不同程度的出血,肾小管附近出血更明显。
3 讨论
脱氢醋酸钠作为防霉剂能够延长食品的储存时间,但是过量添加会给动物健康带来潜在的危害。国内外对脱氢醋酸及其钠盐作为添加剂使用,其使用范围和使用量都有严格的规定。我国《食品添加剂使用标准》规定,脱氢醋酸及其钠盐在黄油和浓缩黄油、腌渍的食用菌和藻类、发酵豆制品及果蔬汁(浆)中的最大使用量为0.3 g/kg;腌渍的蔬菜及淀粉制品的最大使用量为1.0 g/kg;在面包、糕点、焙烤食品馅料及表面用挂浆、预制肉制品、熟肉制品、复合调味料中的最大使用量为0.5 g/kg[14]。脱氢醋酸钠对犬的毒性试验中,犬表现出食欲减退、体重减轻、呕吐、抽搐、运动失调、肠道出血等临床症状[15-16]。本试验中,随着脱氢醋酸钠剂量的增加,灌服时间的延长,大鼠饲料消耗显著减少、体重明显降低,特别是150 mg/kg和200 mg/kg组差异极显著,这与Sakaguchi Y等[8]的研究结果一致。

A.雄性;B.雌性
A.Male;B.Female
图1不同剂量脱氢醋酸钠对雌雄大鼠PT的影响
Fig.1 Effect of sodium dehydroacetate on the PT values of rats
A.雄性;B.雌性
A.Male;B.Female
图2不同剂量的脱氢醋酸钠对雌雄大鼠APTT的影响
Fig.2 Effect of sodium dehydroacetate on the APTT values of rats

A.正常对照组;B~E.50、100、150、200 mg/kg组;箭头示出血
A.Normal control;B-E 50,100,150 and 200 mg/kg sodium dehydroacetate groups;Arrow indicates haemorrhage
图3不同剂量脱氢醋酸钠处理大鼠肝脏的病理变化(HE,200×)
Fig.3 Pathological lesions of liver in rats treated with different doses of sodium dehydroacetate(HE,200×)
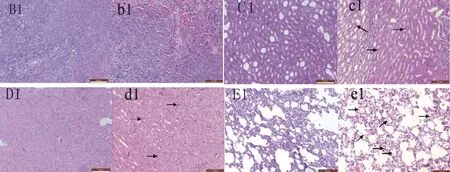
B1~E1.正常对照组脾脏、肾脏、心脏和肺脏;b1~e1.200 mg/kg组脾脏、肾脏、心脏和肺脏;箭头示出血
B1-E1.Spleen,kidney,heart and lung in normal rats;b1-e1.Spleen,kidney,heart and lung in 200mg/kg sodium dehydroacetate groups;Arrow indicates haemorrhage
图4 200 mg/kg脱氢醋酸钠致大鼠肾脏、脾脏、心脏和肺脏出血(HE,200×)
Fig.4 The haemorrhage in spleen,kidney,heart and lung of rats treated with 200 mg/kg sodium dehydroacetate(HE,200×)
PT和APTT是反映凝血功能的两个基本指标。PT和APTT延长表明血液凝固出现障碍,有出血或出血倾向。大鼠给予不同剂量脱氢醋酸钠后,PT值较正常对照组延长了2倍~2.5倍,雌雄大鼠间无明显差别。APTT值雄性大鼠5 d~7d 时延长了3倍~22倍,7 d后延长了5倍~12倍;雌性大鼠APTT值延长了3倍~15倍。雌雄大鼠间APTT值有明显差异。雌性大鼠的APTT值表现出随剂量、时间的增加而延长。从APTT这个指标来看,雌性大鼠似乎对脱氢醋酸钠的敏感性比雄性大鼠更高。但对器官的组织病理学并未观察到雌性大鼠有更明显的出血情况。高剂量时肝脏和肺脏的出血要比其他脏器明显。
脱氢醋酸钠较大剂量应用,可引起大鼠凝血障碍,存在出血倾向。提示较大剂量脱氢醋酸钠的应用,可能存在着安全风险。作为在食品、饲料中应用的防霉剂,此添加剂的用量在生产实际中不能随意加大,应限量使用。有关脱氢醋酸钠应用可能存在的出血现象及出血机制还有待进一步研究。
[1] 候立娟,林金盛,方东璐,等.脱氢醋酸钠对草菇外观品质和保护酶活性的影响[J].江苏农业学报,2014,30(6):1484-1489.
[2] Yan Q Q,Zhang J L,Dong H Z,et al.Properties and antimicrobial activities of starch-sodium alginate composite films incorporated with sodium dehydroacetate or rosemary extract[J].J Appl Polym Sci, 2013,127(3):1951-1958.
[3] 屈长波,李 博,张莉莉,等.高剂量脱氢醋酸钠对断奶仔猪生长性能血清生化指标和血常规指标的影响[J].动物营养学报,2015,27(3):878-884.
[4] 段会轲,周 辉.脱氢醋酸钠复合保鲜在低温肉食品中的应用[J].肉类工业,2008(9):14-16.
[5] 屈长波,孙得发,王 恬.饲料破坏法研究脱氢醋酸钠的防霉效果[J].饲料工业,2014,17(35):102-103.
[6] 侯立娟,林金盛,方东路,等.脱氢醋酸钠对草菇外观品质和保护酶活性的影响[J].江苏农业学报,2014,30(6):1484-1489.
[7] Spencer H C,Rowe V K,McCollister D D.Dehydroacetic acid (DHA).Ⅰ.Acute and chronic toxicity [J].J Pharmacol Exp Therap,1950,99:57-68.
[8] Sakaguchi Y,Suga S,Oshida K,et al.Anticoagulant effect of sodium dehydroacetate (DHA-S) in rats[J].J Appl Toxicol,2008,28:524-529.
[9] Foti C,Antelmi A,Guida S,et al.Sodium dehydroacetate:An emerging allergen[J].Dermat,2012,23(5):243-243.
[10] Foti C,Romita P,Ettorre G,et al.Allergic contact dermatitis caused by resorcinol and sodiumdehydroacetate in a patient with leg ulcers[J].Contact Dermat,2016,74(6):383-384.
[11] Milpied B,Collet E,Genillier N,et al.Allergic contact dermatitis caused by sodium dehydroacetate,not hyaluronic acid,in Ialuset (R) cream[J].Contact Dermat,2011,65(6):359-360.
[12] Yamashoji S,Isshiki K.Rapid detection of cytotoxicity of food additives and contaminants by a novel cytotoxicity test,menadione-catalyzed H2O2production assay[J].Cytotechnology,2001,37:171-178.
[13] Priputina L S,Ingre V G,Ol'shevskaya O D,et al.Experimental study on the possible use of dehydroacetic acid sodium salt as a food additive[J].Voprosy Pitaniya,1987,5:50-53.
[14] GB2760—2014.食品添加剂使用标准[S].
[15] Acid D.Final report on the safety assessment of sodium dehydroacetate and dehydroacetic acid [J].Int J Toxicol,1985,4(3):123-159.
[16] Uchida O,Naito K,Yasuhara K,et al.Studies on the acute oral toxicity of dehydroacetic acid, sorbic acid and their combination compound in rats[J].Bull Nat Ins Hyg Sci,1985,103:166-171.

