禽呼肠病毒在鸡胚成纤维细胞系中的增殖规律
沈文康,谢芝勋,王 盛,黄 莉,谢丽基,黄娇玲,曾婷婷,张艳芳,张民秀,罗思思,范 晴,谢志勤,邓显文
(1.广西大学动物科学技术学院,广西南宁 530004;2.广西壮族自治区兽医研究所/广西兽医生物技术重点实验室,广西南宁 530001)
禽呼肠病毒(Avian reovirus,ARV)是呼肠病毒科、正呼肠病毒属的成员,为双链RNA病毒,无囊膜,含10个节段,双衣壳结构,可感染鸡、火鸡、鹅、鸭及一些鸟类[1],临床主要症状包括病毒性关节炎、腱鞘炎、肠道病、矮小综合征、吸收不良综合征及免疫抑制等,是家禽养殖业中一类重要的传染病,严重危害着养殖业的健康发展[2]。
ARV于1954年由Fahey和Crawley从病鸡中分离得到[3];Olson等于1957年报道鸡群中有滑膜炎并分离出病原,1972年被确定为禽呼肠病毒[4]。自20世纪80年代以来,我国各省份及地区陆续报道了ARV感染的疫情,对ARV的研究也日渐深入,Vanderheide等用ARV S1133株生产出了第一代的商品化活疫苗应用于生产[5];2012年起,我国ARV感染疫情逐渐扩大,主要症状也呈现复杂化、多样化。目前,养殖场普遍存在ARV感染,给养禽业带来了不可估量的经济损失,严重阻碍养禽业的发展。研究表明,ARV的细胞亲嗜性较广,能在绿猴肾细胞(Vero)、犬肾细胞(MDCK)、鸡胚成纤维细胞(CEF)、乳地鼠细胞(BHK-21/13)等多种细胞系中增殖,且产生稳定典型细胞病变[6]。丁明洋等[7]用鸭呼肠病毒TH11感染BHK-21细胞后可有效增殖,出现了稳定病变;黄莉等[8]用ARV强、弱毒株分别接种Vero细胞,并分析了接毒后细胞蛋白表达的差异;余爱花等[9]研究了3株鸭源ARV对鸭胚成纤维细胞的致病性,分析了接毒后细胞TNF-α表达水平的差异性。
有关ARV的研究已经较为深入,但研究ARV在DF1细胞上的增殖特性还未见报道,本文就此展开研究。通过将ARV S1133毒株接种DF1细胞,研究其增殖特性,旨在为下一步ARV致病机理的研究和细胞灭活苗的研制奠定技术和理论基础。
1 材料与方法
1.1 材料
DMEM培养基、胎牛血清(FBS)、2.5 g/L胰酶,Gibco公司产品;PBS,Solarbio公司产品;禽呼肠S1133标准强毒株,中国兽医药品监察所提供;DF1细胞,由广西兽医生物技术重点实验室保存提供。
1.2 方法
1.2.1 引物设计及合成 参考NCBI上的ARV S1133株S2基因的核苷酸序列(登录号:KF741763.1),用Primer 5.0软件设计引物,并由华大基因公司合成,引物序列见表1。
1.2.2 ARV S1133接种DF1细胞 将ARV S1133接种至生长良好的DF1细胞上,37℃孵育2h,更换维持液(含20 mL/L FBS的DMEM培养基),在体积分数为5%的CO2中37℃培养,观察CPE。培养3 d后收细胞培养物,置-80℃冻存备用。取上述病毒液再接种细胞,培养3 d后收获细胞培养物,重复接毒3次。置-80℃冻存备用,测定第3代细胞培养物中的病毒滴度。
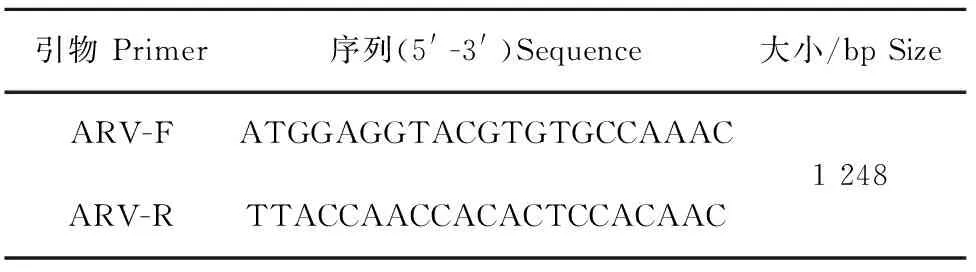
表1 ARV S2基因的核苷酸序列
1.2.3 RT-PCR检测 收获接毒后培养48 h的第3代细胞培养物,提取病毒RNA,用ARV通用引物反转录得到cDNA,将其作为模板用表1中的特异性引物进行PCR扩增,预期扩增片段大小为1 248 bp。PCR程序为94℃ 5 min;94℃ 1 min,55℃ 1 min,72℃ 70 s,循环数为35;72℃ 10 min。PCR产物用10 g/L的琼脂糖凝胶电泳检测。
1.2.4 一步生长曲线的绘制 将上述收获的第3代病毒液接种DF1细胞,分别收取接毒后12、24、36、48、72、96、120 h的病毒液,置-80℃冻存备用。将DF1细胞接种在96孔细胞板上,在体积分数为5%的CO2中37℃过夜培养,观察CPE及记录CPE孔数(重复此过程3次)。按Reed-Meunch法计算7个时间段的半数组织感染量(TCID50)(取3次重复试验的平均值),绘制ARV在DF1细胞上的一步生长曲线。
2 结果
2.1 细胞病变
接毒12 h后即可观察到CPE,在48 h时最明显,主要细胞病变为细胞萎缩、破碎,脱落,成团,边缘不清晰,个别胞体出现变大,死亡等特征,对照组细胞生长良好(图1)。

A.正常;B.接毒后24 h;C.接毒后48 h;D.接毒后72 h
A.Normal;B.Post-infection 24 h;C.Post-infection 48 h;D.Post-infection 72 h
图1 DF1细胞形态(400×)
Fig.1 Morpha of DF1 cells(400×)
2.2 RT-PCR检测结果
收取接种ARV S1133株的第3代DF1细胞培养物,用RT-PCR检测。结果扩增到一条1 248 bp大小片段(图2)。对片段序列与所选的参考株同源性在99.99%以上,说明ARV S1133毒株在DF1细胞上增殖。
2.3 ARV S1133毒株在DF1细胞系上的增殖规律
ARV S1133接种DF1细胞后,分别收取12、24、36、48、72、96、120 h的细胞培养物,测其TCID50, 每个时间点分别做3次重复试验,取平均值。7个时间点的TCID50平均值分别为10-2.49、10-3.5、10-6.84、10-8.9、10-7.86、10-5.38、10-3.64,绘制出生长曲线(图3)。该曲线显示,ARV接种DF1细胞后,0~12 h为静止期,12 h~48 h为快速增长期,在48 h达到最大的病毒效价,TCID50为10-8.9/0.1 mL。
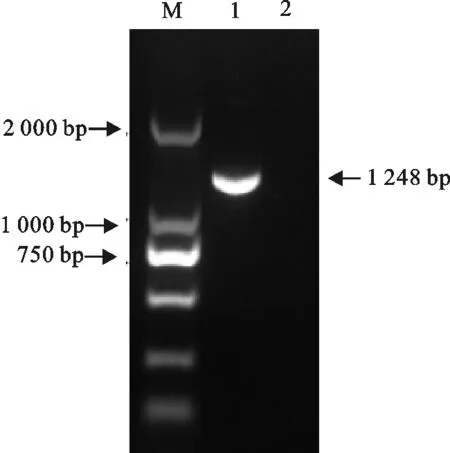
M.DNA 标准DL 2 000;1.PCR扩增产物;2.阴性对照
M.DNA Marker DL 2 000;1.PCR Product;2.Negative control
图2 ARV RT-PCR检测结果
Fig.2 Detection results of ARV by RT-PCR

图3 ARV S1133在DF1细胞上的生长曲线
3 讨论
随着养禽业的快速发展,禽病发生日益增多。近年来,多省份陆续有ARV感染疫情的发生,报道指出ARV有更广的宿主范围,更强的致病性,流行的疫区也日渐扩大,是一种严重危害养禽业健康发展的重要传染病[10]。目前,分离ARV一般采用鸡胚接种,此法虽然单次获毒较多,但需要的时间长,且操作繁琐,在快速获取大量病毒方面不具有时效性,在一定程度上反而限制了ARV的分离[11]。DF1细胞系来源于ELL鸡胚胎,该细胞无禽白血病病毒、肉瘤病毒内源性基因,同时在形态上呈纤维状,是一种稳定的、无肿瘤基因、自发无限增殖的细胞系。目前被广泛用于动物病毒研究、疫苗研制、癌症研究等诸多领域,是生命科学领域重要的病毒转染、培养生物材料。ARV基因组为RNA,而DF1细胞可用于反转录病毒的复制,DF1细胞系有助于ARV对细胞杀伤力的研究。为此,采用了细胞增殖病毒的方法,研究了ARV S1133毒株在DF1细胞上的增殖特性 ,大大缩短了获取大量病毒的时间,大幅提高了获毒效率。
定量描述病毒生长规律的实验曲线称为一步生长曲线,根据病毒的生长特点可划分为静止期、快速增长期、稳定期3个时期[12]。通常用来研究病毒在细胞上的增殖规律的方法主要有测定病毒的TCID50和病毒蚀斑试验[13-14]。本研究直接采取了测定病毒TCID50的方法,并用PCR检测、测序确定细胞仅有ARV感染,无其他病原污染。试验结果显示,ARV接种DF1细胞后,前24 h为静止期,24 h后进入快速增长期,并在48 h达到最大的病毒效价,即TCID50为10-8.9/0.1 mL。这一增殖规律可能与细胞的自身免疫机制有关,至于真正的原因,还待进一步的研究。本研究结果表明,ARV可在DF1细胞上有效地增殖,并伴有典型病变,在接毒48 h后出现病毒效价峰值,TCID50为10-8.9/0.1 mL。ARV感染DF1细胞的最佳收毒时间为接毒后的48 h。本研究结果可为下一步用DF1细胞研制ARV灭活苗及致病机理研究奠定基础[15]。
[1] Saif Y M.禽病学[M].12版.高 福,索 勋,译.北京:中国农业出版社,2012:355-379.
[2] 张昆丽,谢芝勋,黄 莉,等.禽呼肠病毒感染对SPF鸡外周血T细胞亚型变化和细胞因子转录的影响[J].动物医学进展,2015,36(1):1-4.
[3] Javier B,Jose M C.Avian reovirus:structure and biology[J].Virus Res,2006,123(2):105-119.
[4] Jones R C.Avian reovirus infection[J].Revue Scientifique Et Technique,2000,19(2):614-625.
[5] 谢丽基.禽呼肠孤病毒σ3基因的真核表达及σNS基因的原核表达与序列分析[D].广西南宁:广西大学,2006.
[6] Hedayati M,Shojadoost B,Peighambari S M.Detection of avian reoviruses causing tenosynovitis in breeder flocks in Iran by reverse transcription-polymerase chain reaction (RT-PCR) and restriction enzyme fragment length polymorphism (RFLP)[J].Acta Paediatrica,2013,50(4):385-386.
[7] 丁明洋,毕庄莉,朱英奇,等.新型鸭呼肠孤病毒TH11株在BHK21细胞系中的增殖特性[J].中国兽医科学,2015,45(9):918-922.
[8] 黄 莉,谢芝勋,谢丽基,等.禽呼肠孤病毒强毒株和弱毒疫苗株感染Vero细胞的蛋白质组学研究[J].畜牧兽医学报,2016,47(2):331-339.
[9] 余爱花.3株鸭源呼肠孤病毒对鸭胚成纤维细胞致病性研究[D].湖北武汉:华中农业大学,2012.
[10] 陈少莺,陈仕龙,林锋强,等.新型鸭呼肠孤病毒的分离与鉴定[J].病毒学报,2012,28(3):224-230.
[11] Heffels-Redmann U,Muller H,Kaleta E F.Structural and biological characteristics of reoviruses isolated from Muscovy ducks (Cairinamoschata)[J].Avian Pathol,1992,21(3):481-491.
[12] 韩 燕,朱 玲,周远成,等.犬细小病毒四川株的分离鉴定与一步生长曲线的测定[J].中国兽医学报,2014,34(3):379-383.
[13] 代洪波,陈 蕾,朱 玲,等.猪传染性胃肠炎病毒四川株的分离鉴定与一步生长曲线的测定[J].中国兽医科学,2012,42(12):1224-1229.
[14] 付玉志,张洪辉,李传峰,等.Ⅰ型鸭肝炎病毒在鸭胚成纤维细胞系中的增殖特性研究[J].中国预防兽医学报,2013,35(2):110-113.
[15] 孙永珍.传染性喉气管炎病毒LJS09株在LMH细胞上的生长特性研究及糖蛋白gG、gC的抗体制备[D].北京:中国农业科学院,2014.

