内镜黏膜下剥离术治疗早期胃癌及癌前病变的临床疗效
柴小兵,段旭红,李娅,吴慧丽
(1.郑州大学附属郑州中心医院 消化内科,河南 郑州 450000;2.解放军总医院 消化内科,北京 100853;3.郑州大学第一附属医院 消化内科,河南 郑州 450052)
早期胃癌(early gastric carcinoma,EGC)是指癌变组织局限于黏膜或黏膜下层而无论是否存在淋巴结转移者。目前,随着内镜检查技术的不断发展及人们健康意识的逐渐提高,EGC的检出率逐年提高。传统的早期胃癌治疗手段为外科根治性手术切除,术后5年生存率达90.0%以上[1-2]。但根治性手术切除会破坏胃的正常解剖结构,影响胃的正常生理功能,又存在创伤大、并发症多、恢复慢和费用高等劣势。随着内镜检查、治疗设备的更新及操作技术的提高,使得在内镜下实施EGC治疗成为可能,同时又有较多的研究表明早期胃癌较少合并淋巴结转移,使其在国内外逐渐成为治疗EGC的首选方法。内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)是EGC治疗的标准微创术式,具有完整切除率高、创伤小、恢复快和费用低等优势,并与外科根治性手术切除的疗效相似[3-4]。郑州大学附属郑州中心医院消化内科采用ESD技术治疗EGC及癌前病变,取得了不错的临床疗效。现报道如下:
1 资料与方法
1.1 一般资料
收集2012年6月-2015年6月郑州大学附属郑州中心医院消化内科106例EGC及癌前病变且实施ESD治疗的患者资料。其中,男62例,女44例,年龄42~76岁,平均(58.3±9.7)岁;并发糖尿病者31例,并发高血压者39例。病变位于胃底贲门部23例(21.7%),胃体部31例(29.2%),胃窦部52例(49.1%)。根据镜下分型标准[5]:Ⅰ型(隆起型)18例(17.0%),Ⅱa型(浅表隆起型)21例(19.8%),Ⅱb型(浅表平坦型)27例(25.5%),Ⅱc型(浅表凹陷型)40例(37.7%)。所有患者均经内镜下组织活检诊断为胃早癌或高级别上皮内瘤变。并在术前接受内镜窄带成像术(narrow band imaging,NBI)、放大内镜及超声内镜和(或)CT检查,以评估病变的形态、大小和浸润深度等情况,明确是否存在壁外淋巴结肿大。评估患者的全身状况,排除手术禁忌,详细向患者讲解ESD操作的益处及可能存在的风险,并签署知情同意书。
1.2 ESD治疗方法
采用Olympus GIF Q260J胃镜、Olympus PSD-2E高频电治疗仪,胃镜前端安装软式透明帽(Olympus)。常规丙泊酚静脉麻醉后,取侧卧位行ESD治疗。0.4%靛胭脂喷洒于病变表面进行染色确定病变范围,并于病灶周围约0.5 cm处使用APC进行电凝标记,间隔约0.2 cm,见图1A~C。使用生理盐水、甘油果糖、盐酸肾上腺素混合注射液于病灶周围标记点外侧进行多点注射,每次注射约2 ml,使整个病变抬起。使用IT刀或Hook刀沿标记点外侧环形切至黏膜下层,并从切开的边缘逐渐进行黏膜下剥离,剥离过程中间断向黏膜下注射混合液,确保病变黏膜始终处于隆起状态,尽可能完整切除病灶,见图1D。剥离过程中随时止血以确保视野清晰,对于较大的血管出血及时使用止血钳电凝止血。完整剥离后,仔细检查创面确保无活动性出血,对于裸露于创面的较大血管进行电凝处理,并于创面喷洒糖铝胶,以预防迟发型出血,见图1E。五爪钳取出切除的组织后,立即展平固定,测量大小并拍照后使用10%福尔马林固定送检,见图1F。
1.3 术后治疗
术后常规给予抗生素、抑酸、胃黏膜保护剂、止血和补液等治疗,第1天禁食,第2天开始酌情进流食,严密检测患者的生命体征变化。必要时行血常规、血生化和(或)立位腹平片检查。对存在迟发性出血者急诊行内镜下止血治疗;对存在穿孔者给予内镜下钛夹夹闭及胃肠减压治疗。根据病理报告了解病变的大小、组织学类型、分化程度、浸润程度、切缘情况和脉管浸润情况等。对于切缘或基底部存在癌细胞侵犯严重者建议外科手术治疗。
1.4 疗效评价
①整块切除:指病变被一次性地完整大块切除;②R0切除:即组织学治愈性切除,术后病理提示标本边缘、基底无癌变组织残留,无血管、淋巴管浸润,癌变侵及深度未超过黏膜肌以下500μm;③R1切除:即未达到组织学治愈性切除,术后病理提示标本边缘、基底面残留癌细胞,浸润深度超过黏膜肌以下500μm;④癌变复发:术后复查内镜提示ESD切除部位及周边1.0 cm范围内存在肿瘤生长,组织病理检查提示与原手术病理类型一致。
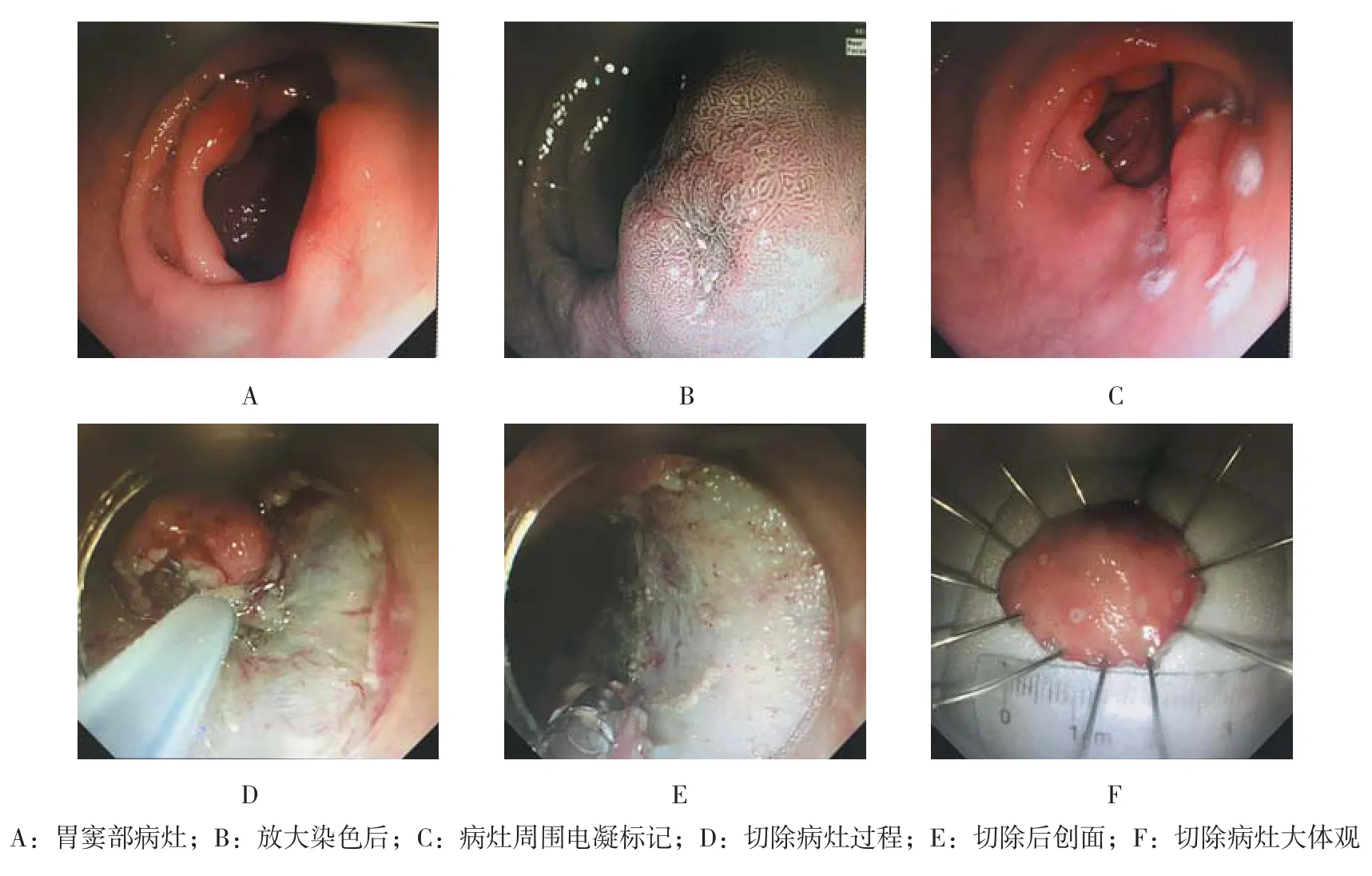
图1 ESD治疗过程Fig.1 ESD treatment process
1.5 随访
通过门诊复查的方式进行随访,患者于术后1、3、6和12个月复查内镜,之后每年复查一次,了解ESD术后创面愈合情况及是否存在复发。如果术后1年内,内镜及组织病理学检查未发现病灶残留及复发则认定为治愈[6]。
1.6 统计学方法
采用SPSS 17.0软件进行统计检验。计量资料以均数±标准差(±s)的形式表示,两组间计数资料比较采用双向无序χ2检验,率的多重比较采用Scheffe法,以乘积限估计法计算生存率,Kaplan-Meier法计算生存曲线,P<0.05时差异有统计学意义。
2 结果
2.1 ESD治疗情况
106例患者均成功在内镜下整块切除病变组织,整块切除率为100.0%,根据术后病理结果,治愈性切除率为91.5%。平均手术时间为(61.8±17.3)min(自开始在病灶周边标记至创面处理完毕);病灶最大径为1.4~5.2 cm,平均为(2.7±1.3)cm。根据术后病例结果描述,7例标本存在基底部肿瘤残余,无切缘阳性病例,故99例达到R0切除,R0切除率为93.4%,R1切除率为6.6%。7例R1切除患者经内镜下二次切除后达到R0切除。
2.2 术后并发症
所有病例在ESD操作过程中均未出现内镜下难以控制的大出血情况。18例(17.0%)于术后48 h内出现不同程度的腹痛及胸骨后疼痛,均未给予特殊处理而自行缓解。术后发生迟发性出血6例(5.7%),其中胃体部2例,胃窦部4例;4例发生于术后48 h内,2例发生于术后1周内。发生迟发性出血的病例均在内镜下止血成功,无外科手术情况。术中穿孔7例(6.6%),均为小穿孔(3~5 mm),胃壁浆膜层无实质性缺损,予以术中金属夹夹闭及术后禁食、胃肠减压、抑酸、抗炎和补液等治疗,均痊愈出院。
2.3 术后病理
术后病理结果提示胃早癌74例:高分化腺癌23例,中分化腺癌29例,低分化腺癌19例,印戒细胞癌3例;高级别上皮内瘤变32例。7例标本存在基底部肿瘤残留,无切缘阳性病例。见附表。
2.4 术后随访
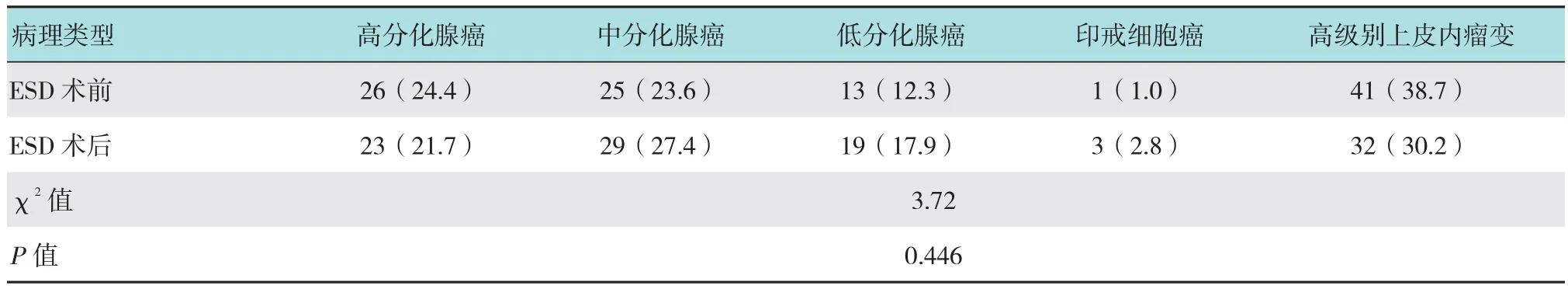
附表 ESD手术前后病检结果比较情况 例(%)Attached table Comparsion of pathological examination before and after ESD n(%)
全组106例患者均遵出院医嘱于术后1、3、6及12个月复查,2例于术后6个月、3例于术后12个月复查发现ESD创面瘢痕中央处组织形态异常并取活检证实为癌复发,复发率为4.7%,5例患者均接受根治性胃大部切除术。其余患者ESD创面均于术后3个月基本愈合,未见复发,见图2。随访截至2016年12月,3例患者死亡,中位随访期为34个月,3年生存率达97.9%,见图3。

图2 术后3个月创面愈合情况Fig.2 Healing situation of the wound 3 months after surgery
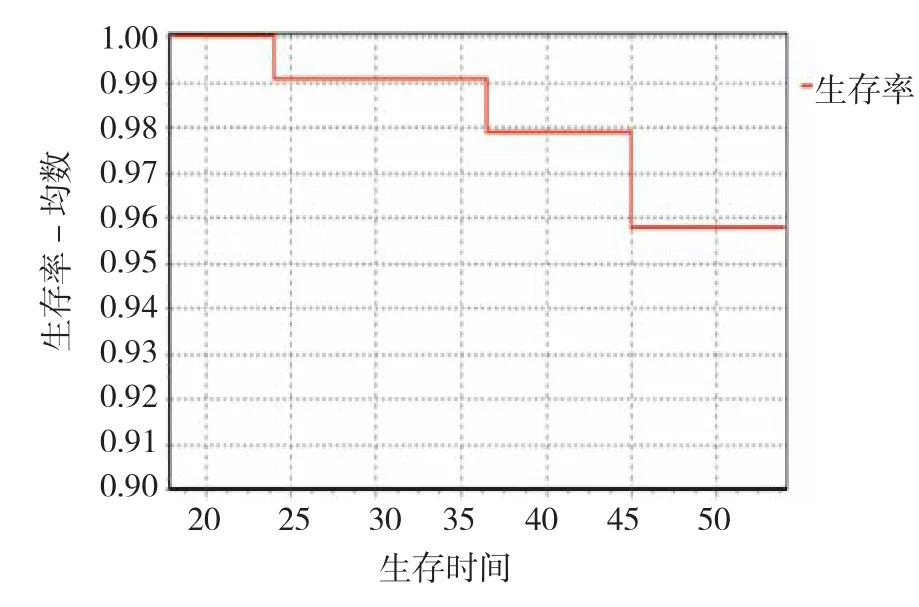
图3 患者生存曲线Fig.3 Patients' survival curve
3 讨论
ESD是近年来发展起来的治疗EGC及癌前病变的有效微创治疗方法,其在治疗早期胃肠道肿瘤方面的疗效及优势逐渐被国内外专家认可[7-9]。对于无转移的EGC来说,ESD既能切除病灶、治愈疾病,又能保留器官的正常结构及生理功能。提高胃黏膜病变检出率并严格掌握手术适应证是开展ESD技术的前提。我国于2012年制定的消化道黏膜病变ESD治疗的专家共识[10],其适应证包括:①不论病灶大小,无溃疡形成的分化型黏膜内癌;②肿瘤直径≤30 mm,合并溃疡形成的分化型黏膜内癌;③肿瘤直径≤30 mm,未合并溃疡形成的分化型sm1黏膜内癌;④肿瘤直径≤20 mm,无溃疡形成的未分化型黏膜内癌;⑤直径>20 mm的高级别上皮内瘤变等。术前通过NBI、放大内镜、超声内镜及CT等辅助检查精确评估病变的范围、浸润深度以及是否存在淋巴结转移等情况,可有效减低超适应证范围的ESD手术。日本经长期研究认为,ESD治疗早期消化道肿瘤的疗效与外科手术相似,且并发症少,具有可控的优势。对于术后病理提示存在病变残留的病例,可行二次ESD达到治愈性切除。评价ESD治疗的效果如何关键在于病灶的完整切除率、治愈性切除率、术后复发率以及患者远期生存率。相关文献报道称,ESD的完整切除率为96.7%~98.0%,治愈性切除率为75.0%~95.0%,术后局部复发率为1.1%~3.0%,术后5年生存率为83.1%~88.1%,治疗效果与外科手术相同[11-13]。本组研究中,所有病例均在内镜下一次性完整切除病灶,一次性完整切除率达100.0%;根据术后病理结果,治愈性切除率为91.5%;术后原位复发率为4.7%;此外,ESD术前组织活检结果与术后病理结果的差异无统计学意义。截至2016年12月,患者的平均生存时间为44.3个月,3年生存率达97.9%。
ESD治疗的常见并发症为出血和穿孔。有关文献报道称[14-17],ESD治疗术中出血的发生率为4.5%~7.0%,术后迟发型出血的发生率为1.8%~15.6%;术中穿孔的发生率为1.2%~8.2%,穿孔多发生在胃中、上2/3,与近段胃壁较为薄弱及操作难度相关;而术后迟发型穿孔较少见,但术中反复过度的电凝易损伤黏膜下层及固有肌层,易增加术后迟发型穿孔的发生率。本组研究中,无ESD治疗过程中急性大出血发生,6例于术后发生迟发型出血,发生率为5.7%;6例出血患者均在内镜下止血成功,无转外科手术情况。7例发生术中穿孔,发生率为6.6%;由于患者在ESD术前严格禁食,且穿孔一般较小,其所致的腹膜炎体征常较轻,符合保守治疗的指征,故均予以术中金属夹夹闭及术后禁食、胃肠减压、抑酸、抗炎、补液等治疗后痊愈出院。若穿孔较大,且术后患者腹痛、腹膜炎体征加重及体温持续升高的情况,应及时转外科手术处理,本组研究中无此类情况发生。
总结我中心的操作经验,在ESD操作过程中进行反复黏膜下注射有助于预防出血的发生;对渗血的创面及时止血以确保手术视野清晰,术后仔细检查创面,妥善处理裸露的血管:对于裸露的小血管可给予电凝处理,而对于裸露的大血管可行热活检钳烧灼或给予金属夹夹闭;处理完毕后在创面喷洒止血药物;术后常规胃肠减压、抑酸等治疗可有效降低迟发型出血的发生率。此外,术前全面了解患者的各重要脏器及凝血功能、糖尿病患者控制血糖降至正常范围、高血压患者稳定血压≤140 mmHg等措施可有效降低术后迟发性出血的发生率。
随着ESD操作技术的日臻完善及操作设备的不断创新,其逐渐代替传统开腹手术成为EGC及癌前病变的首选治疗方式,其作为一种微创内镜手术,具有创伤小、恢复快、并发症少和疗效可靠等优点,最大限度保留了完整的消化道解剖结构及生理功能,大大提高了患者的术后生活质量。由于本次研究对入组病例的样本量相对较少且总体随访时间未达到5年,存在一定的不足之处,ESD治疗EGC及癌前病变的远期疗效仍需多中心、大样本、更长随访时间的前瞻性研究来进一步明确。
[1]孙洋. 内镜粘膜下剥离术与外科手术治疗早期胃癌的对比研究[D]. 兰州大学, 2016.
[1]SUN Y. Comparative study of endoscopic submucosal dissection and surgical treatment for early gastric cancer[D]. Lanzhou University, 2016. Chinese
[2]杨铁健, 陆鹏. 外科治疗老年人早期胃癌[J]. 中国实用医药, 2012, 7(26):89-90.
[2]YANG T J, LU P. Surgical treatment of early gastric cancer in the elderly people[J]. China Practical Medicine, 2012, 7(26):89-90. Chinese
[3]张洪印, 刘汉博. 内镜黏膜下剥离术及外科手术治疗早期胃癌的预后效果[J]. 世界华人消化杂志, 2014, 22(34):5330-5333.
[3]ZHANG H Y, LIU H B. Prognosis of endoscopic submucosal dissection and surgical treatment for early gastric cancer[J]. World Chinese Journal of Digestology, 2014, 22(34):5330-5333. Chinese
[4]徐佳昕, 蔡明琰, 周平红, 等. 内镜下切除与传统外科手术治疗早期胃癌的疗效对比[J]. 中华胃肠外科杂志, 2015, 18(11):1174-1176.
[4]XU J X, CAI M Y, ZHOU P H, et al. Comparison of curative effect between endoscopic resection and traditional surgical treatment for early gastric cancer[J]. Chinese Journal of Gastrointestinal Surgery, 2015, 18(11):1174-1176. Chinese
[5]张正坤. 早期胃癌分型与浸润深度及淋巴转移的关系探讨[J].中华消化内镜杂志, 1998, 15(3):163-164.
[5]ZHANG Z K. Relationship between the classification of early gastric cancer and the depth of invasion and lymph node metastasis[J]. Chinese Journal of Digestive Endoscopy, 1998, 15(3):163-164. Chinese
[6]仲恒高, 缪林, 季国忠, 等. 内镜黏膜下剥离术治疗早期胃癌及癌前病变36例临床分析[J]. 中国内镜杂志, 2016, 22(1):90-92.
[6]ZHONG H G, MIU L, JI G Z, et al. Endoscopic submucosal dissection in the treatment of early gastric cancer and precancerous lesions:a clinical analysis of 36 cases[J]. China Journal of Endoscopy, 2016, 22(1):90-92. Chinese
[7]梁品, 胡祥. ESD:早期胃癌的新选择[J]. 医学与哲学, 2016, 37(8):11-13.
[7]LIANG P, HU X. ESD:new choice for early gastric cancer[J]. Medical and Philosophy, 2016, 37(8):11-13. Chinese
[8]刘靖正, 姚礼庆. 内镜黏膜下剥离术(ESD)在消化道肿瘤治疗中应用的新进展[J]. 复旦学报(医学版), 2012, 39(2):198-202.
[8]LIU J Z, YAO L Q. New progress of endoscopic submucosal dissection (ESD) in the treatment of gastrointestinal cancer[J]. Fudan University Journal of Medical Sciences, 2012, 39(2):198-202. Chinese
[9]YAMAGUCHI N, ISOMOTO H, FUKUDA E, et al. Clinical outcomes of cadoscopic submucosal dissection for early gastric cancer by indication criteria[J]. Digestion, 2009, 80(3):173-181.
[10]周平红, 蔡明琰, 姚礼庆. 消化道黏膜病变内镜黏膜下剥离术的专家共识意见[J]. 诊断学理论与实践, 2012, 11(5):531-535.
[10]ZHOU P H, CAI M Y, YAO L Q. Expert consensus on endoscopic submucosal dissection for gastrointestinal mucosal lesions[J]. Journal of Diagnostics Concepts and Practice, 2012, 11(5):531-535. Chinese
[11]CHOI M K, KIM G H, PARK D Y, et al. Long-term outcomes of endoscopic submucosal dissection for early gastric cancer:a single- center experience[J]. Surg Endosc, 2013, 27(11):4250-4258.
[12]KOSAKA T, ENDO M, TOYA Y, et al. Long-term outcomes of endoscopic submucosal dissection for early gastric cancer:a single- center retrospective study[J]. Dig Endosc, 2014, 26(2):183-191.
[13]TOYONAGA T, MAN-I M, EAST J E, et al. 1,635 Endoscopic submucosal dissection cases in the esophagus, stomach, and colorectum:complication rates and long-term outcomes[J]. Surgical Endoscopy, 2013, 27(3):1000-1008.
[14]ODA I, SUZUKI H, NONAKA S, et al. Complications of gastric endoscopic submucosal dissection[J]. Digestive Endoscopy, 2013, 25(Suppl 1):71-78.
[15]刘莉, 史维. ESD术后并发症及处置[J]. 现代消化及介入诊疗, 2014, 19(4):247-251.
[15]LIU L, SHI W. Management of complications after ESD[J]. Modern Digestion and Intervention, 2014, 19(4):247-251. Chinese
[16]范志宁. 内镜下黏膜下剥离术并发症处理的最新进展[J]. 中国医疗器械信息, 2014, 20(6):9-13.
[16]FAN Z N. The latest progress in the treatment of complications of endoscopic submucosal dissection[J]. China Medical Device Information, 2014, 20(6):9-13. Chinese
[17]MURAKI Y, ENOMOTO S, IGUCHI M, et al. Management of bleeding and artificialgastric ulcers associated with endoscopic submucosal dissection[J]. World J Gastrointest Endosc, 2012, 4(1):1-8.

