急性冠脉综合征患者血清血小板衍生生长因子表达的临床研究
庞斯斯 闵笑颜 周传伟 王向明
血小板衍生生长因子(platelet-derived growth factor,PDGF)主要来源于血小板,也存在于损伤的内皮细胞及移行于内皮下的成纤维细胞、平滑肌细胞、巨噬细胞、系膜细胞等中[1]。目前研究认为,PDGF与其受体结合后发挥生物学效应,参与多种病理生理过程。PDGF-BB通过趋化作用、促分裂效应及血管收缩效应参与动脉粥样硬化发生发展过程,且可促进新生血管形成,在多种组织损伤修复及疾病过程中发挥重要作用[2]。
现已证实,PDGF在动脉粥样硬化、血管内皮损伤等病理生理过程中起到重要的作用。但不同类型冠心病患者血浆PDGF浓度的变化情况,以及与冠状动脉疾病严重程度之间的关系仍存在争议。本研究通过探讨急性冠脉综合征患者外周血及冠状动脉局部血清PDGF浓度与冠状动脉疾病严重程度的关系,为冠心病相关细胞因子的研究及ACS疾病严重程度的判断提供理论依据。
1 对象与方法
1.1 研究对象 研究纳入2012年9月至2013年12月在南京医科大学第一附属医院心血管科住院并行冠状动脉造影的急性冠脉综合征患者,年龄≥18岁,依据冠状动脉造影结果及临床症状分组。排除标准:①既往行冠状动脉旁路移植术(CABG)患者;②存在严重心功能不全(LVEF≤30%)患者;③严重合并症,如肝衰竭、肾衰竭、结缔组织病、肿瘤及感染性疾病;④合并急性出血性疾病;⑤急性脑卒中。最终入选ACS患者81例,其中包括急性心梗组(AMI group)患者61例,男性50例,女性11例,年龄31~84(60.4±11.5)岁;不稳定心绞痛组(UAP group)患者20例,男性14例,女性6例,年龄49~80(62.2±8.5)岁。另外选取在此期间因胸痛行冠脉造影术,术中未见冠脉狭窄者为非冠心病组,即对照组(non-CHD group,control)29例,男性16例,女性13例,年龄45~84(59.6±9.6)岁。
1.2 临床资料收集 收集并获取所有患者基本资料,包括性别、年龄、身高、体质量指数(BMI),高血压、糖尿病等既往病史;测量收缩压、舒张压、心率;全自动生化分析仪检测空腹血糖、总胆固醇、低密度脂蛋白、高密度脂蛋白、甘油三酯、血肌酐、尿酸、肝功能、肾功能等。
1.3 冠状动脉造影术 每位研究对象均采用GE Innova3000型血管造影机行CAG检查,桡动脉或股动脉穿刺,选择JL、JR造影导管,分别送入左、右冠状动脉开口处,多体位投照,记录冠脉造影结果。非冠心病定义为造影血管的管腔直径正常或狭窄<50%;冠心病定义为主要血管(左前降支、回旋支和右冠状动脉及其主要分支)的狭窄程度≥50%。
1.4 SYNTAX积分计算 由两名专业的长期从事冠状动脉介入工作的医生对造影结果进行评价,综合评价左冠状动脉主干、前降支、回旋支及右冠状动脉的狭窄程度,利用在线SYNTAX评分系统(http://www.syntax.score.com),根据病变位置、狭窄程度、是否分叉、钙化程度、是否弥漫等解剖和病理特点逐一对每个病变进行评分,然后把分值相加得出患者的SYNTAX积分。1~22分为低危组,23~32分为中危组,≥33分为高危组。
1.5 样本采集及处理
1.5.1 外周血采集 患者行冠脉造影前,穿刺成功植入动脉鞘管后,在鞘管内抽取桡动脉或股动脉血(外周血)5 ml。
1.5.2 冠脉内血液采集 穿刺桡动脉或股动脉成功后,置入6F鞘管,选择指引导管,先以导丝通过病变部位,沿导丝将Diver血栓抽吸导管送至病变远端,抽取冠状动脉病变远端(冠脉内)血5 ml。所有血液在室温下以3000 r/min离心10 min,再取0.5 ml的血浆于-70℃冻存待检。
1.6 血清PDGF测定方法 利用PDGF-BB ELISA试剂盒(美国R&D生物科技有限公司)测定血清PDGF水平。根据说明书,按照步骤测定每个血清样本和标准品的OD值,绘制出标准曲线,依据各样品的OD值计算出PDGF浓度,即待测样品的实际浓度。
1.7 统计学方法 用SPSS 21.0软件进行数据分析。计量资料以x±s表示,组间比较采用t检验,三组间比较采用ANOVA方差分析;计数资料以频数表示,组间比较采用χ2检验;ACS患者冠脉内与外周血生长因子浓度比较采用配对t检验;ACS患者外周血与对照组外周血间比较采用单因素方差分析。单因素采用Pearson相关分析,采用Logistic回归分析进行多因素间的相关性分析,并对性别、年龄、高血压史、总胆固醇、低密度脂蛋白、空腹血糖等常见心血管病危险因素进行校正。P<0.05为差异有统计学意义。
2 结果
2.1 各组临床资料比较 与对照组比较,冠心病ACS组年龄、吸烟史及空腹血糖、LDL-C水平升高,差异有统计学意义(P<0.05)。ACS组间比较显示,与不稳定型心绞痛组比较,患高血压、吸烟的比例及LDL-C水平显著升高(P<0.05)。三组患者间其余指标两两比较,差异无统计学意义(P>0.05)。见表1。
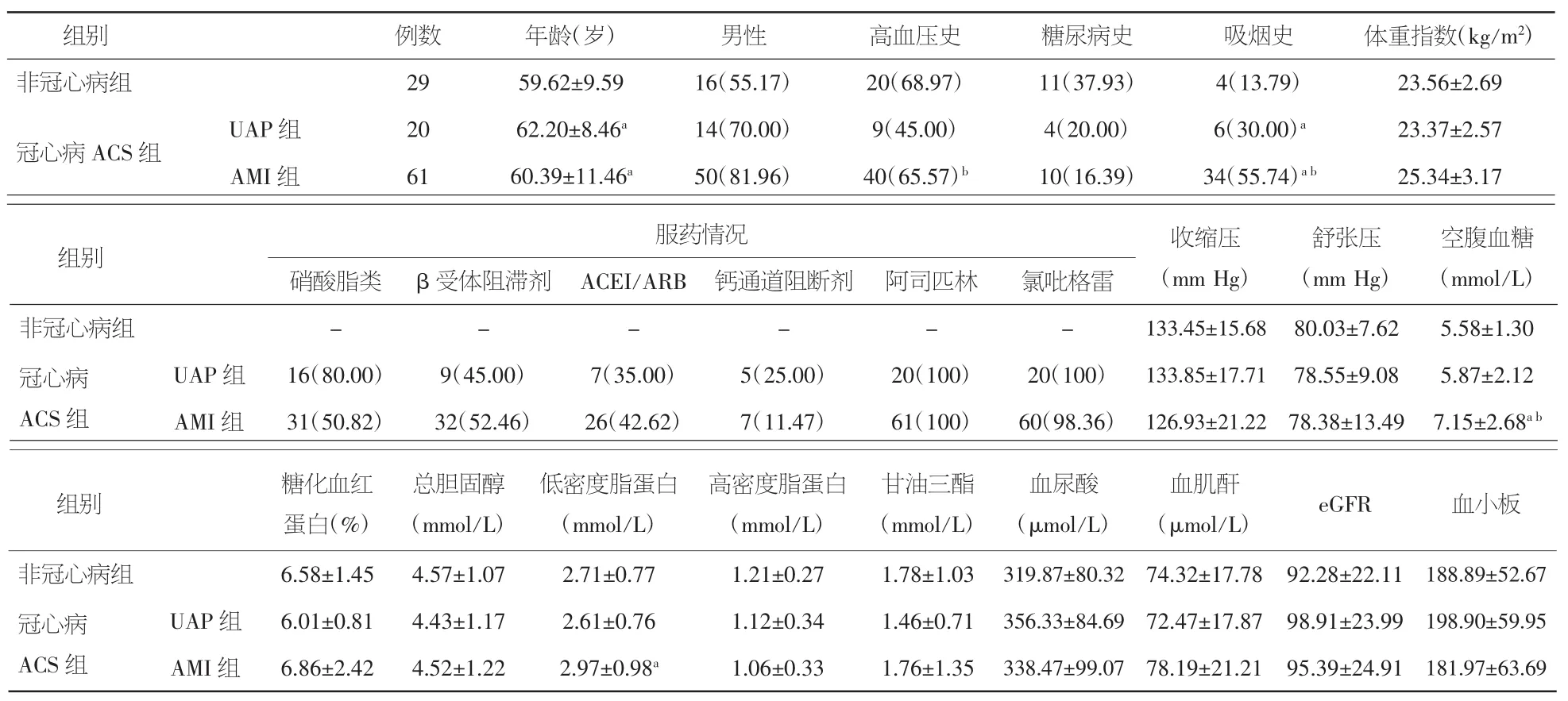
表1 患者基本临床资料[x±s,例数及百分率(%)]
2.2 各组患者PDGF浓度比较 与对照组比较,冠心病ACS组外周血PDGF浓度显著升高,且差异有统计学意义[(723.29±679.53)pg/ml比(369.12.0± 292.39)pg/ml,P<0.05];冠心病ACS组中AMI组外周血PDGF浓度较UAP组显著升高[(758.36± 714.56)pg/ml比(614.11±600.39)pg/ml,P<0.05]。ACS组患者冠状动脉内PDGF浓度较外周血PDG浓度升高[(911.89±735.41)pg/ml比(723.29 679.53)pg/ml,P<0.01];ACS组冠状动脉内PDG浓度比较显示,AMI组较UAP组升高[(1114.72 770.02)pg/ml比(788.93±611.99)pg/ml,P<0.01],差异具有统计学意义。见表2。

表2 各组患者PDGF浓度比较(x±s,pg/ml)
2.3 SYNTAX积分与外周血PDGF浓度的相关性分析 按照SYNTAX积分,将所有入组ACS患者分为低危组(1~22分)、中危组(23~32分)和高危组(≥33分)。冠心病ACS组中低危组、中危组及高危组患者外周血PDGF呈上升趋势,同样冠状动脉内PDGF浓度也呈上升趋势,但组间比较差异无统计学意义(P>0.05)。ACS组内两两比较,高危组患者外周血PDGF浓度较低危组显著升高(P<0.05),但高危组与中危组比较无显著差异(见图1A、B)。高危组患者冠状动脉内PDGF浓度也较低危组显著升高(P<0.05),而与中危组比较无显著差异。中危组和低危组外周血PDGF浓度与冠状动脉内PDG浓度均无显著差异。Pearson相关分析显示,外周血PDGF浓度与冠脉狭窄程度(SYNTAX评分)呈正相关(r=0.233,P<0.05)。冠状动脉内PDGF浓度与冠状动脉病变严重程度同样呈正相关(r=0.235,P<0.05)(见图2A、B)。
2.4 以PDGF水平四分位间距分组患者冠状动脉严重程度比较 以PDGF水平的四分位将所有患者分为4组,分别为Q1组(<191.35 pg/ml)、Q2组(191.35~461.45 ng/ml)、Q3组(461.45~750.33 pg/ml)、Q4组(≥750.33 pg/ml)。随着血清PDGF浓度的逐渐增高,患者低密度脂蛋白、血小板计数逐步增高,组间差异有统计学意义(P<0.05)。比较不同血清PDGF水平患者冠状动脉病变程度发现,Q4组的SYNTAX评分均显著高于Q1和Q2组(P<0.05)。见表3。
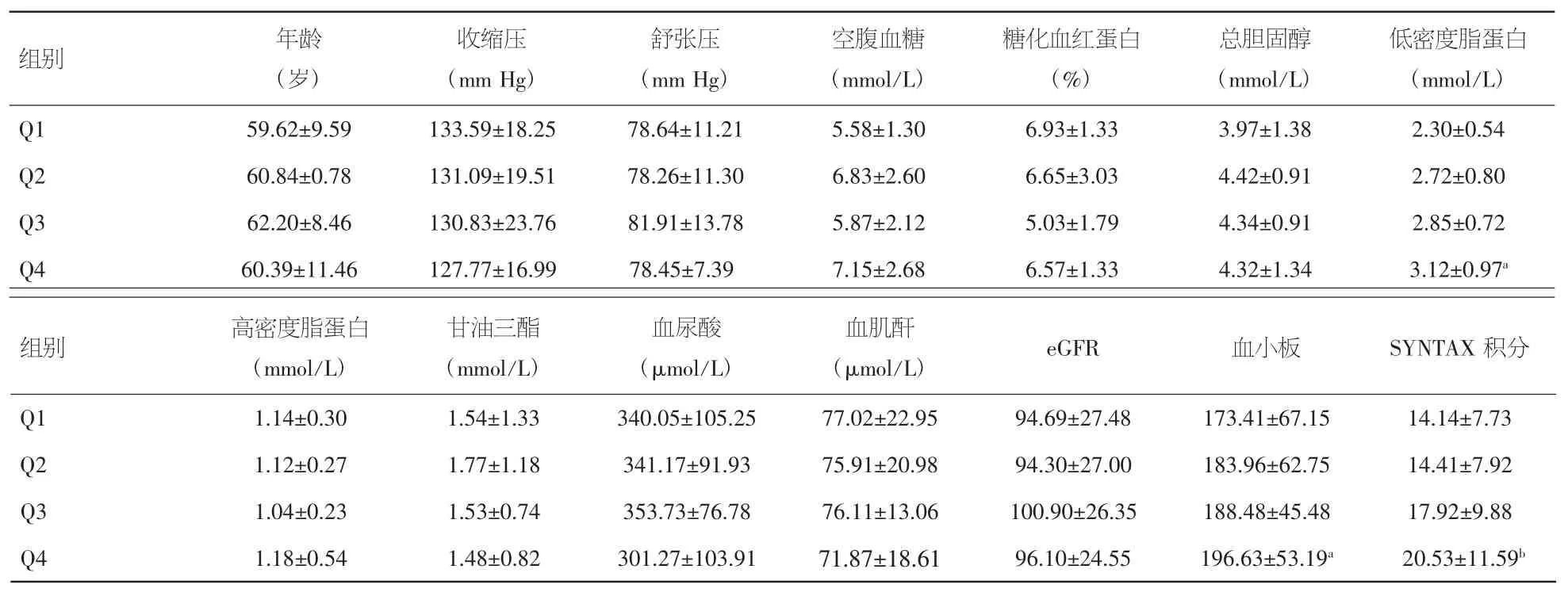
表3 PDGF水平四分位间距分组患者冠状动脉严重程度比较(x±s)
3 讨论
血小板衍生生长因子为24 Ku的阳离子糖蛋白,其主要来源是血小板,也存在于损伤的内皮细胞,以及移行于内皮下的成纤维细胞、平滑肌细胞、巨噬细胞、系膜细胞等中[1]。以上多种细胞以自分泌、旁分泌的形式合成及释放PDGF,并介导多种组织中内皮与间质的相互作用[3-5]。
PDGF具有5种亚型:PDGF-AA、PDGF-AB、PDGF-BB、PDGF-CC和PDGF-DD。目前研究认为,PDGF-BB与其受体结合后通过多种机制发挥生物学效应,参与多种病理生理发展过程[2]。研究表明,PDGF主要生物学效应包括:①促细胞分裂效应[6]。②化学趋化性。PDGF对平滑肌细胞、中性粒细胞以及成纤维细胞有趋化作用[7]。③血管收缩效应。研究显示,PDGF-BB诱导大鼠动脉收缩的反应呈浓度依赖性,并且通过抑制内皮衍生舒张因子的合成而促进血管收缩,其收缩血管作用强于血管紧张素[8]。PDGF的这三种作用在动脉粥样硬化过程中同时存在,并从多方面参与动脉粥样硬化过程。
现已证实,PDGF在动脉粥样硬化、血管内皮损伤等病理生理过程中起到重要的作用,但不同类型冠心病患者血浆PDGF浓度的变化情况,以及与冠状动脉疾病严重程度之间的关系仍存在争议。
本研究测定了急性冠脉综合征患者外周血及冠状动脉局部血清PDGF浓度,并通过非冠心病组做对照,结果发现,ACS患者外周血血清PDGF浓度较非冠心病组显著升高,且PDGF在ACS患者冠脉局部浓度显著高于外周血浓度。我们分析原因可能与ACS患者内膜损伤以后的以下机制有关:①内膜损伤后,血小板激活,其在损伤局部黏附聚集,释放PDGF-BB,以诱导中膜平滑肌细胞向内膜迁移并增生。②内皮损伤后,细胞功能激活,由此产生凝血酶;凝血酶可激活凝血瀑布的一系列反应,同时刺激血小板释放PDGF-BB[9]。③ACS患者存在血管狭窄甚至闭塞,导致病变血管局部的血流动力学发生改变,承受剪切力的血小板和内皮细胞生成PDGF-BB增多,由此通过PDGF-BB/PDGFR-β途径刺激内皮细胞增生。总而言之,血管损伤后在损伤局部会立即出现血小板聚集激活,激活的血小板及内皮细胞可释放出大量血小板衍生生长因子。
而另有研究[10,11]指出,动脉粥样硬化患者血浆PDGF-BB水平及白细胞介素IL-2、IL-4、IL-5、IL-6、IL-7水平均显著升高,提示可能与炎症因子共同作用,影响动脉粥样硬化进程。由于炎症在动脉粥样硬化性疾病的病程进展中起着显著的作用,缺血心肌组织中的炎症反应亦会激发炎症因子及PDGF等细胞因子在局部的释放,进一步使冠脉局部PDGF浓度升高。在ACS患者中,急性心肌梗死患者无论是外周血还是冠状动脉局部血清PDGF浓度均显著高于不稳定型心绞痛患者,考虑与AMI病理过程中血小板激活程度及炎症反应程度较UAP更为激烈有关。
研究进一步探讨了血清PDGF浓度与冠状动脉病变严重程度的相关性。选用SYNTAX积分系统作为评价冠状动脉病变严重程度的标准。SYNTAX评分系统是建立在冠状动脉解剖基础上的危险分层工具,全面评估了冠状动脉解剖特点,是一种精确量化的客观评价指标[12]。相关性分析显示,外周血及冠状动脉局部血清PDGF浓度与SYNTAX评分均呈正相关关系,且发现随着血清PDGF浓度的逐渐增高,患者SYNTAX积分逐步增高,高浓度组平均SYNTAX积分显著高于低浓度组。研究表明,血清PDGF浓度可以作为判断冠心病患者血管病变严重程度及炎症反应程度的重要指标,为ACS患者疾病风险识别提高了参考价值。
综上所述,急性冠脉综合征患者血清PDGF浓度显著升高,尤其在冠状动脉局部PDGF呈现浓聚,与冠状动脉局部血小板激活和炎症反应密切相关,血清PDGF浓度可反映冠状动脉病变的严重程度。
(本文图片见后插一)
[1]Ross R.Platelet-derived growth factor.Lancet,1989,1:1179-1182.
[2]Shim HR,He X.Structures of a platelet-derived growth factor/ propeptide complex and a platelet-derived growth factor/receptor complex.Proc Natl Acad Sci USA,2010,107:11307-11312.
[3]Korpisalo P,Karvinen H,Rissanen TT,et al.Vascular endothelial growth factor-A and platelet-derived growth factor-B combination gene therapy prolongs angiogenic effects via recruitment of interstitial mononuclear cells and paracrine effects rather than improved pericyte coverage of angiogenic vessels.Circ Res, 2008,103:1092-1099.
[4]Yamamoto S,Fukumoto E,Yoshizaki K,et al.Platelet-derive growth factor receptor regulates salivary gland morphogenesis vi fibroblast growth factor expression.JBiolChem,2008,283 23139-23149.
[5]Sabudawidemann D,Grabensee B,Schwandt C,et al.Mycophe nolic acid inhibits the autocrine PDGF-B synthesis and PDGF BB-induced mRNA expression of Egr-1 in rat mesangial cells Nephrol Dial Transpl,2009,24:52-61.
[6]Jiang H,Chen J,Wang L,et al.Down-regulation of CREB binding protein expression inhibits thrombin-induced proliferatio of endothelial cells:possible relevance to PDGF-B.Cell Bio Int,2010,34:1155-1161.
[7]Ho KJ,Owens CT,Sui XX,et al.C-reactive protein and vei graft disease:Evidence for a direct effect on smooth muscle cel phenotype via modulation of PDGF receptor-β.Am J Physio Heart Circ Physiol,2008,295:H1132-H1140.
[8]Zhang ZW,Yanamoto H,Nagata I,et al.Platelet-Derive Growth Factor-Induced Severe and Chronic Vasoconstriction o Cerebral Arteries:Proposed Growth Factor Explanation of Cerebral Vasospasm.Neurosurgery,2010,66:728-735.
[9]Ucuzian AA,Brewster LP,East AT,et al.Characterization o the chemotactic and mitogenic response of SMCs to PDGF-BB and FGF-2 in fibrin hydrogels.J Biomed Mater Res A,2010,94 988-996.
[10]He C,Medley SC,Hu T,et al.PDGFRβ signaling regulate local inflammation and synergizes with hypercholesterolemia t promote atherosclerosis.Nat Commun,2015,6:7770.
[11]Zhu H,Lin X,Zheng P,et al.Inflammatory cytokine levels i patients with periodontitis and/or coronary heart disease.Int Clin Exp Patho,2015,8:2214-2220.
[12]Sianos G,Morel MM,Kappetein AP,et al.The SYNTAX score:an angiographic tool grading the complexity of coronar artery disease.EuroIntervention,2005,1:219-227.

