急性心肌梗死患者内源性促红细胞生成素与梗死面积的关系
常学伟 张守彦 张明明 马惠芳 谷云飞 魏毅东 魏经汉
急性ST段抬高型心肌梗死(STEMI)是致死率极高的急危重症,尽管循证指南和再灌注治疗的广泛应用极大地提高了患者的生存率,但梗死后心室重构和心力衰竭仍无法得到有效解决。促红细胞生成素(EPO)有着造血以外的多种生物学作用,如心肌保护、抗炎、抗凋亡、促血管生成等作用,为心血管疾病的相关研究提供了新的思路和方向[1]。有研究显示,急性心肌梗死患者内源性EPO水平显著升高[2],内源性EPO可以减轻心肌缺血再灌注损伤,具有一定的心脏保护作用[3]。但对于直接经皮冠状动脉介入(PCI)治疗的STEMI患者,血清EPO水平与心肌梗死面积是否存在相关性,目前鲜有研究。本研究通过对163例STEMI患者血清EPO水平、肌酸激酶(CK)峰值、CK总累积量进行分析,明确STEMI患者直接PCI术后,血清内源性EPO对梗死面积的预测价值。
1 资料与方法
1.1 临床资料 入选2013年9月至2014年9月在郑州大学附属洛阳中心医院住院的STEMI患者163例,造影均显示冠状动脉急性完全闭塞,并在发病12 h内行直接PCI,其中男性97例、女性66例,年龄36~76(54.5±10.6)岁。所有患者均符合美国心脏病学会(ACC)/美国心脏学会(AHA)制定的《急性ST段抬高心肌梗死诊断和治疗指南》(2013年)STEMI诊断标准[4]。排除血液病、慢性肺病、严重肝肾功能异常、外源性EPO应用和既往冠状动脉血运重建治疗等患者。
1.2 生化指标及血清CK、EPO的测定 所有患者均于入院次日清晨空腹抽取静脉血,应用日立7600全自动生化仪测定肝肾功能、血脂、血糖、凝血功能等生化指标;应用放射免疫法测定血清EPO水平,试剂盒由R&D Systems公司提供;入院即刻,4、8、12、16、20、24、36、48 h测定CK值,计算CK峰值和CK总累积量(1000 U·h-1·L-1)。根据血清EPO中位数19.6 IU/L分为2组:低EPO组83例,男性50例,女性33例,平均年龄(54.1±10.3)岁;高EPO组80例,男性47例,女性33例,平均年龄(55.0±10.7)岁。两组发病时间、年龄、性别构成、体重指数、血压、病史、用药情况、常规生化指标等差异无统计学意义。
1.3 冠状动脉造影和心脏超声 所有患者均于住院期间在我院行冠脉造影,采用Judikin′s导管技术,造影结果由2名以上有经验的医师分析完成,造影后仅干预梗死相关动脉,包括前降支(LAD)、回旋支(LCX)、右冠状动脉(RCA),并记录发病至入院时间、门-球时间(D2B)。按Rentrop分级法对冠状动脉侧支循环进行分级,根据心外膜动脉灌注程度分为0级、1级、2级、3级。冠状动脉灌注情况评价采用TIMI血流分级标准分为0级、1级、2级、3级。术后7 d行超声心动图检查,测量左心室舒张末期内径(LVEDD)、左心室收缩末期内径、室间隔舒张末期厚度和左心室射血分数(LVEF)。
1.4 统计学方法 采用SPSS 23.0软件进行统计分析。根据曲线下面积计算CK总累积量。计量资料以x±s表示,组间分类资料比较采用χ2检验,计量资料比较采用t检验,各变量的相关性采用Pearson相关分析法,应用二元Logistic回归和多元逐步回归分析法分析危险因素。以P<0.05为差异有统计学意义。
2 结果
2.1 两组临床资料的对比分析 低EPO组CK峰值、CK总累积量显著高于高EPO组,梗死前心绞痛发作显著低于高EPO组(P均<0.01);两组肝肾功能、血脂、凝血功能等基线指标差异均无统计学意义(P>0.05)。见表1。
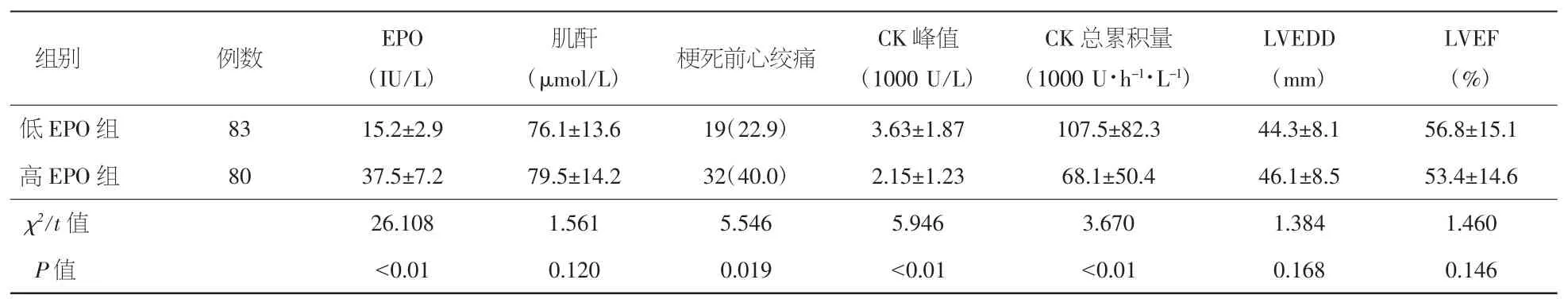
表1 两组临床资料的对比分析[x±s,例数及百分率(%)]
2.2 PCI相关指标的对比分析 两组发病时间、D2B时间、梗塞动脉构成、侧支循环情况、术后TIMI血流差异均无统计学意义(P>0.05),见表2。
2.3 EPO、CK峰值、CK总累积量与其他指标的相关性 EPO与CK总累积量、CK峰值、发病时间均呈负相关(r=-0.503、-0.441、-0.201,P<0.05);CK总累积量与CK峰值、发病时间呈正相关(r=0.702、 0.251,P<0.05);CK峰值与发病时间呈正相关(r= 0.217,P<0.01)。见表3。
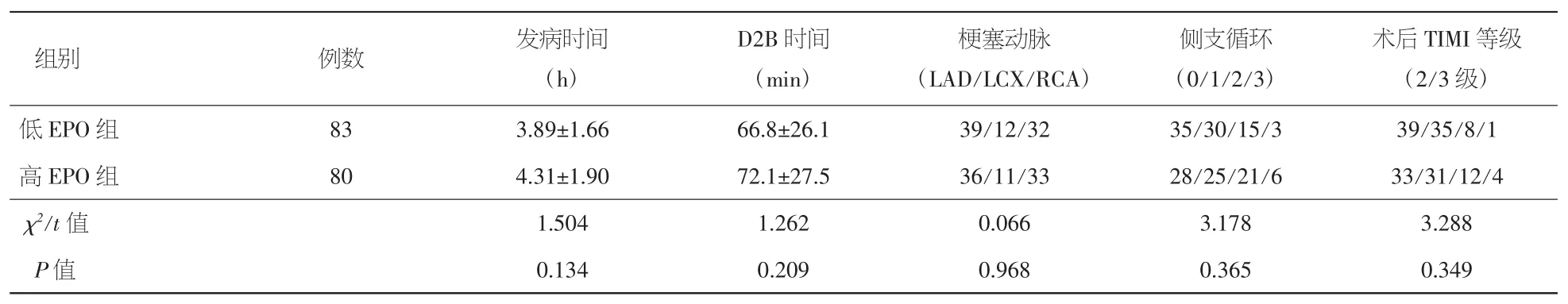
表2 PCI相关指标比较(x±s)
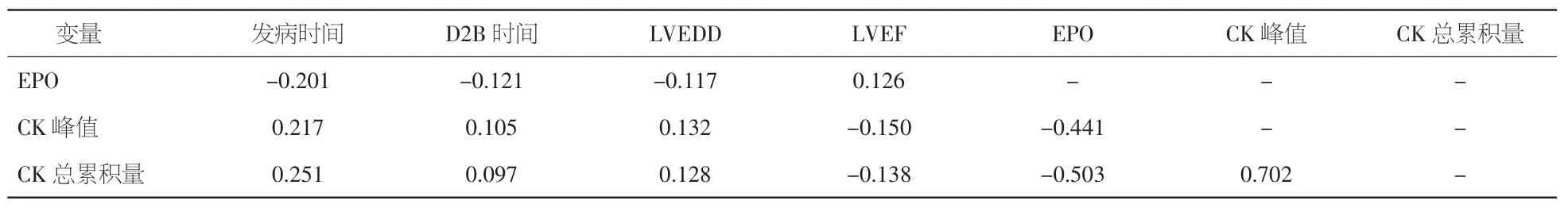
表3 EPO、CK峰值、CK总累积量与各变量的相关性分析
2.4 侧支循环危险因素的二元Logistic回归分析将Rentrop 0级和1级的患者定义为侧支循环不良者,Rentrop2级和3级定义为侧支循环良好者。以侧支循环良好者和不良者为因变量,进行二元Logistic回归分析,结果显示,血清 EPO(OR= 0.750,95%CI 0.606~0.928,P=0.008)、CK蓄积量(OR=3.228,95%CI 1.295~8.047,P=0.012)和梗死前心绞痛(OR=0.540,95%CI 0.303~0.962,P= 0.036)是冠状动脉侧支循环不良的独立预测因子。见表4。
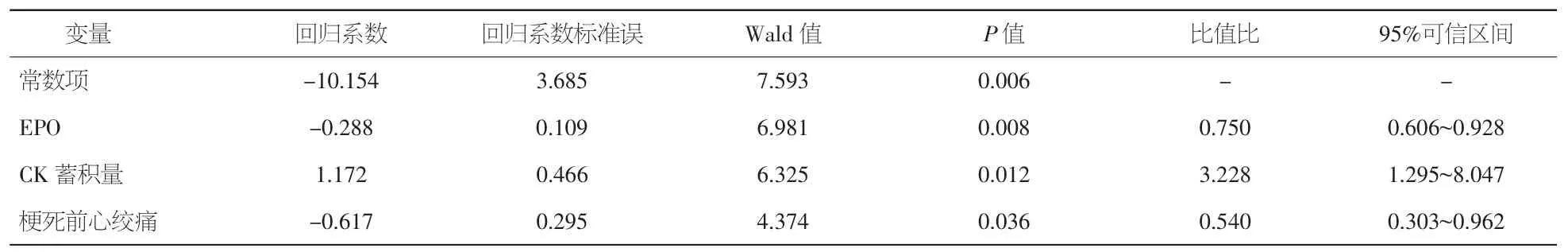
表4 侧支循环危险因素的二元Logistic回归分析结果
2.5 CK峰值、CK总累积量的多元逐步回归分析结果 分别以CK峰值、CK总累积量为因变量,以其他指标为自变量进行多元逐步回归分析,EPO(β=-0.504,P<0.05)和梗死前心绞痛(β=-0.225,P<0.05)是CK总累积量的独立预测因子;校正梗死前心绞痛,EPO仍是CK总累积量的独立预测因子。见表5。

表5 CK总累积量的多元逐步回归分析结果
3 讨论
EPO主要由肾脏和肝脏分泌,有促进红细胞生成的作用。内源性EPO的组织保护作用已在多项研究中得到证实,Mallet等[5]的研究发现,对缺血再灌注脑组织也有一定保护作用,血清EPO水平还与冠状动脉侧支循环等级密切相关[6]。近年来研究显示,急性心肌梗死患者血清EPO显著升高[2],内源性EPO可以抑制心肌细胞凋亡,改善机体炎症和氧化应激状态,减轻心肌缺血再灌注损伤,发挥心脏保护作用[3]。但STEMI患者直接PCI术后,内源性EPO能否缩小心肌梗死面积,发挥心脏保护作用,目前鲜有研究。为明确EPO对STEMI患者直接PCI术后的心脏保护作用,探讨血清内源性EPO水平对梗死面积的预测价值,本研究对163例STEMI患者血清EPO水平、CK峰值、CK总累积量进行了分析。
本研究结果显示,高EPO组患者CK峰值、CK总累积量显著低于低EPO组;同时本研究相关性分析显示,EPO与CK总累积量、CK峰值均呈较强的负相关。多元逐步回归分析显示,EPO和梗死前心绞痛是CK总累积量的独立预测因子,提示内源性EPO具有心脏保护作用,可降低心肌梗死面积,改善心脏功能。二元Logistic回归分析结果显示,血清EPO是冠状动脉侧支循环不良的独立预测因子,这与有关研究[6]结果一致。内源性EPO的心脏保护作用已在多项研究中得到证实。在小鼠心脏缺血再灌注模型,EPO受体基因敲除小鼠的Caspase-3活性、心肌细胞凋亡程度和心肌梗死面积均显著高于野生型小鼠,提示EPO可通过特定的细胞信号转导通路,抑制缺血再灌注损伤,发挥心脏保护作用[3]。在人体内的研究也显示,STEMI患者入院时血清内源性EPO水平显著升高,且呈现迅速降低趋势,入院时血清EPO水平与心肌梗死面积呈负相关[7]。Garimella等[8]对2488例高龄受试者进行长达10.7年随访研究,结果显示,基线血清EPO水平与长期随访心力衰竭、卒中、死亡等心血管事件发生风险密切相关。内源性EPO心脏保护作用的机制可能为:增强细胞抗凋亡能力,改善机体炎症和氧化应激状态,促进血管生成等[9]。本研究通过人体试验证实,血清内源性EPO与STEMI直接PCI术后梗死面积密切相关,EPO水平较高者梗死面积较小,这与既往研究结果相似。本研究结果发现,有梗死前心绞痛发作的患者CK总累积量较低,提示有梗死前心绞痛发作的STEMI患者梗死面积较小,这可能与缺血预处理的心脏保护作用有关[10]。
本研究结果显示,STEMI并接受直接PCI的患者,内源性EPO水平较高者心肌梗死面积较小,提示内源性EPO可以抑制心脏缺血再灌注损伤,发挥心脏保护作用。但该结果仍需多中心大样本量的研究来证实,且精确的机制仍需要进行更为深入的研究。
[1]Fabian SG,Garcia G,Helios PG,et al.Erythropoietin and the heart:physiological effects and the therapeutic perspective.Int J Cardiol,2014,171:116-125.
[2]Kukwa W,Glowczynska R,Filipiak KJ,et al.Serum EPO and acute myocardial infarction.Sleep Breath,2013,17:1063-1069.
[3]Tada H,Kagaya Y,Takeda M,et al.Endogenous erythropoietin system in non-hematopoietic lineage cells plays a protective role in myocardial ischemia/reperfusion.Cardiovasc Res,2006,71:466-477.
[4]O′Gara PT,Kushner FG,Ascheim DD,et al.2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction:executive summary:a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines:developed in collaboration with the American College of Emergency Physicians and Society for Cardiovascular Angiography and Interventions.Catheter Cardiovasc Interv,2013,82:E1-27.
[5]Mallet RT,Ryou MG.Erythropoietin:Endogenous Protection of Ischemic Brain.Vitam Horm,2017,105:197-232.
[6]Ozyuncu N,Gulec S,Ozdol C,et al.Impact of serum erythropoietin level on collateral vessel development in patients with coronary artery disease.Anatol J Cardiol,2017,17:386-391.
[7]Shigeto N,Yutaka K,Jun O,et al.High Serum Erythropoietin Level Is Associated With Smaller Infarct Size in Patients With Acute Myocardial Infarction Who Undergo Successful Primary Percutaneous Coronary Intervention. J Am Coll Cardiol,2005,45:1406-1412.
[8]Garimella PS,Katz R,Patel KV,et al.Association of Serum Erythropoietin With Cardiovascular Events,Kidney Function Decline,and Mortality:The Health Aging and Body Composition Study.Circ Heart Fail,2016,9:e002124.
[9]Korzeniewski SJ,Pappas A.Endogenous Erythropoietin.Vitam Horm,2017,105:39-56.
[10]马晓静,张兴华,罗曼,等.缺血预适应与缺血后适应现象对急性心肌梗死急症介入治疗后的影响.中华医学杂志,2007,87:114-117.

