食管癌术后早期肠内营养对患者影响的系统评价
布海力且木·努尔, 林素兰, 王 磊
(新疆医科大学1第一附属医院内镜中心, 乌鲁木齐 830054; 2新疆医科大学, 乌鲁木齐 830011; 3第一附属医院消化科, 乌鲁木齐 830054)
食管癌是消化系统较为常见的恶性肿瘤之一。食管癌患者在术前,因吞咽困难、肿瘤自身的消耗,导致患者不同程度的营养不良。同时肿瘤在进展过程中释放免疫抑制因子,导致机体免疫功能下降[1],加重营养不良。术后患者因遭受手术创伤、长时间禁食,进一步加重营养不良和免疫抑制的状态[2]。近年来,术后早期肠内营养(early enteral nutrition, EEN)备受临床广泛关注,其被认为可以降低围手术期并发症的发生率、改善机体免疫功能,防止营养不良造成的严重并发症[3]。本研究通过对食管癌术后早期营养支持治疗的患者术后并发症、临床指标、营养指标进行Meta分析,综合评价EEN与食管癌患者术后恢复情况的相关性,初步探讨EEN对食管癌术后患者机体的免疫功能和临床结局的影响。
1 资料与方法
1.1纳入与排除标准纳入标准:(1)研究类型关于检测食管癌术后EEN治疗的患者术后并发症、临床指标、营养指标的的随机对照试验(randomized controlled trial, RCT),无论是否采用分配隐藏或双盲;(2)术前病理检查确诊食管癌患者;(3)民族、年龄和性别不限。排除标准:(1)合并严重肝肾功能不全、内分泌或代谢性疾病的患者;(2)合并其他脏器重大疾病,如心力衰竭等;(3)意识障碍或不同意参与研究的患者。
1.2检索策略计算机检索PubMed(1996~2016)、CBM(1998~2016)、CNKI(1958~2016)、WanfangData(1999~2016)、VIP(1989~2016)等数据库,收集采用关于检测食管癌术后EEN治疗的患者,术后并发症、临床指标、营养指标2的随机对照试验(RCT),中文检索词为“食管癌”、“早期肠内营养”、“并发症”、 “随机对照试验”,英文检索词为“esophageal cancer”、“enteral nutrition”、“complications”等。
1.3检测指标纳入的文献分别对以下指标的数据进行分析:术后吻合口瘘发生率、术后切口感染发生率、术后肺部感染发生率、体质指数(body mass index, BMI),术后排气排便时间、术后患者住院天数、住院费用、血清清蛋白(albumin, ALB),转铁蛋白(transferrin, TRF),前清蛋白(prealbumin, PAB)。
1.4资料提取及文献评价对检索收集到的文献,由两位研究者独立筛选文献,并进行交叉核对,若遇分歧,咨询第三者或讨论解决。纳入RCT的质量评价采用Cochrane Handbook5.1.0推荐的偏倚风险的评价工具对纳入的研究进行方法学质量评价。
1.5统计学方法应用RevMan5.3软件进行统计分析,计量资料采用均数差(MD)或标准化均数差(SMD),95%可信区间(95%CI)表示。计数资料采用相对危险度(OR),95%可信区间(95%CI)表示;对OR值进行齐性检验。各纳入研究结果间的异质性采用χ2检验,当P>0.1、I2<50%时,表示异质性不明显,采用固定效应模型分析;当P<0.1、I2>50%时,应先分析异质性来源,对可能导致异质性的因素进行亚组分析,若存在统计学异质性而无临床异质性或差异无统计学意义时,采用随机效应模型进行分析,以P<0.05为差异有统计学意义。
2 结果
2.1文献检索结果初检获文献2 183篇,通过阅读题录、摘要和全文,最终纳入18个RCT,共2 551例患者,其中EEN组1 205例,对照组1 346例,纳入文献的基本情况见表1。
2.2纳入研究的质量评价根据Cochrane Handbook5.1.0推荐的偏倚风险评价工具进行评价,按照以下几个方面进行评估:(1)随机方案是否正确;(2)是否盲法;(3)分配方案是否正确;(4)是否失访、退出;(5)结果是否完整;(6)其他偏倚来源。若以上条目均评估为低分险,则文献评分为A;若一条或多个条目评估不清楚,则文献评分为B;若一个或多个条目评估为高风险,则文献评分为C,见表1。
2.3Meta分析结果
2.3.1 术后并发症 8个RCT[5-9, 13-15]做了术后吻合口瘘发生率的比较,存在异质性(P<0.1,I2=67%),故采用随机效应模型进行合并分析,结果显示EEN组术后吻合口瘘发生率较对照组下降;8个RCT[5-7, 9, 13-16]做了术后肺部感染发生率的比较,差异无统计学意义(P>0.1);6个RCT[6-7, 9, 13-14, 16]做了术后切口感染发生率的比较,差异无统计学意义(P>0.1),见图1-3。
2.3.2 临床指标 4个RCT[4, 9, 20-21]做了术后患者BMI指标的比较,存在异质性(P<0.1,I2=84%),故采用随机效应模型进行合并分析,结果显示EEN组术后患者BMI指标较对照组上升;12个RCT[5-7, 9-10, 13-17, 20-21]做了术后患者排气排便时间的比较,存在异质性(P<0.1,I2=99%),故采用随机效应模型进行合并分析,结果显示EEN组术后患者排气排便时间较对照组减少;9个RCT[5-7, 9-10, 13-14, 16, 21]做了术后患者住院天数的比较,存在异质性(P<0.1,I2=90%),故采用随机效应模型进行合并分析,结果显示EEN组术后患者住院天数较对照组减少;6个RCT[6, 9, 13-14, 16, 21]做了住院费用的比较,存在异质性(P<0.1,I2=98%),故采用随机效应模型进行合并分析,结果显示EEN组住院费用较对照组减少,见图4-7。

表1 纳入研究的基本特征
注:NA:数据不存在; 对照组均为术后静脉营养。
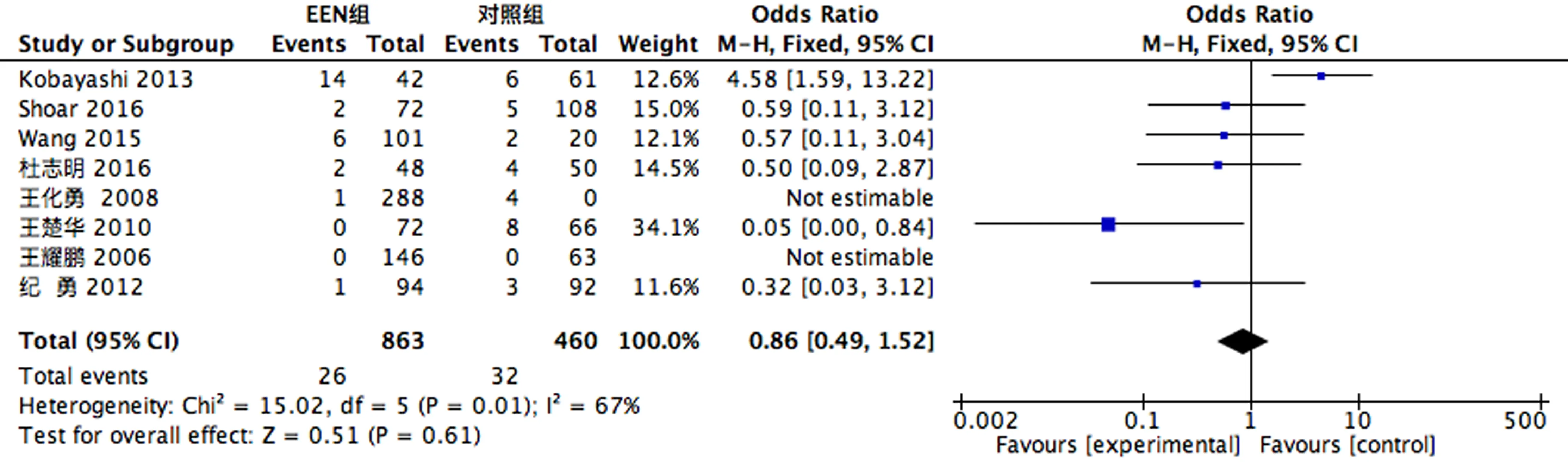
图1 吻合口发生率比较

图2 肺部感染发生率比较

图3 切口感染发生率比较

图4 术后BMI比较

图5 术后排气排便时间比较
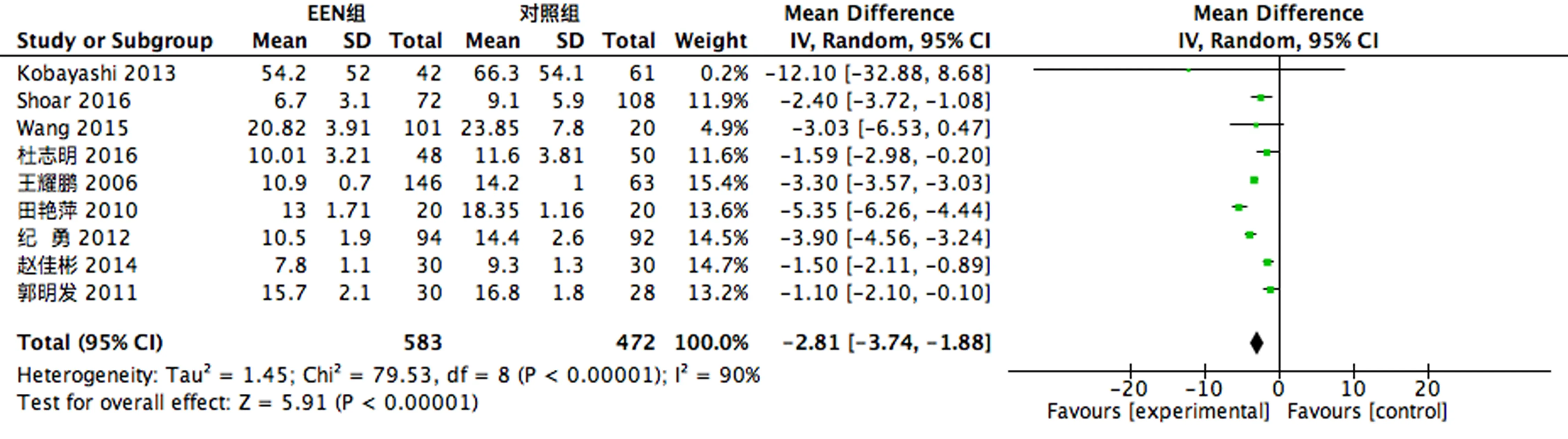
图6 术后住院天数比较

图7 住院费用比较
2.3.3 营养指标 12个RCT[6-7, 9-11, 14, 16-21]做了术后患者ALB指标的比较,存在异质性(P<0.1,I2=92%),故采用随机效应模型进行合并分析,结果显示EEN组术后患者ALB指标较对照组上升;6个RCT[9, 11, 16-19]做了术后患者TRF指标的比较,存在异质性(P<0.1,I2=93%),故采用随机效应模型进行合并分析,结果显示EEN组术后患者TRF指标较对照组上升;8个RCT[11, 14, 16-21]做了术后患者PAB指标的比较,存在异质性(P<0.1,I2=94%),故采用随机效应模型进行合并分析,结果显示EEN组术后患者PAB指标较对照组上升,见图8-10。
2.4偏倚分析漏斗图是识别发表偏倚的常用方法,分别对各项结局指标做漏斗图分析,均显示漏斗图分布均不对称,提示可能存在发表偏倚,见图11-18。
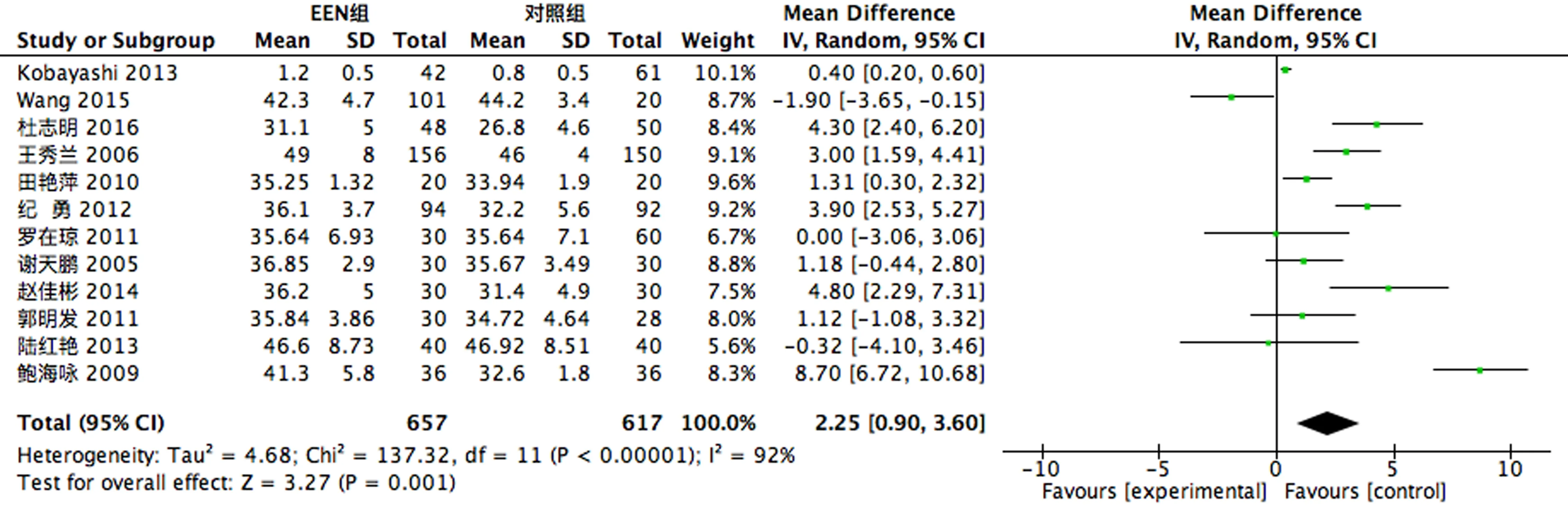
图8 术后ALB比较

图9 术后TRF比较

图10 术后PAB比较

图11 吻合口发生率比较的漏斗图

图12 术后BMI比较的漏斗图

图13 术后排气排便时间比较的漏斗图

图14 术后住院天数比较的漏斗图
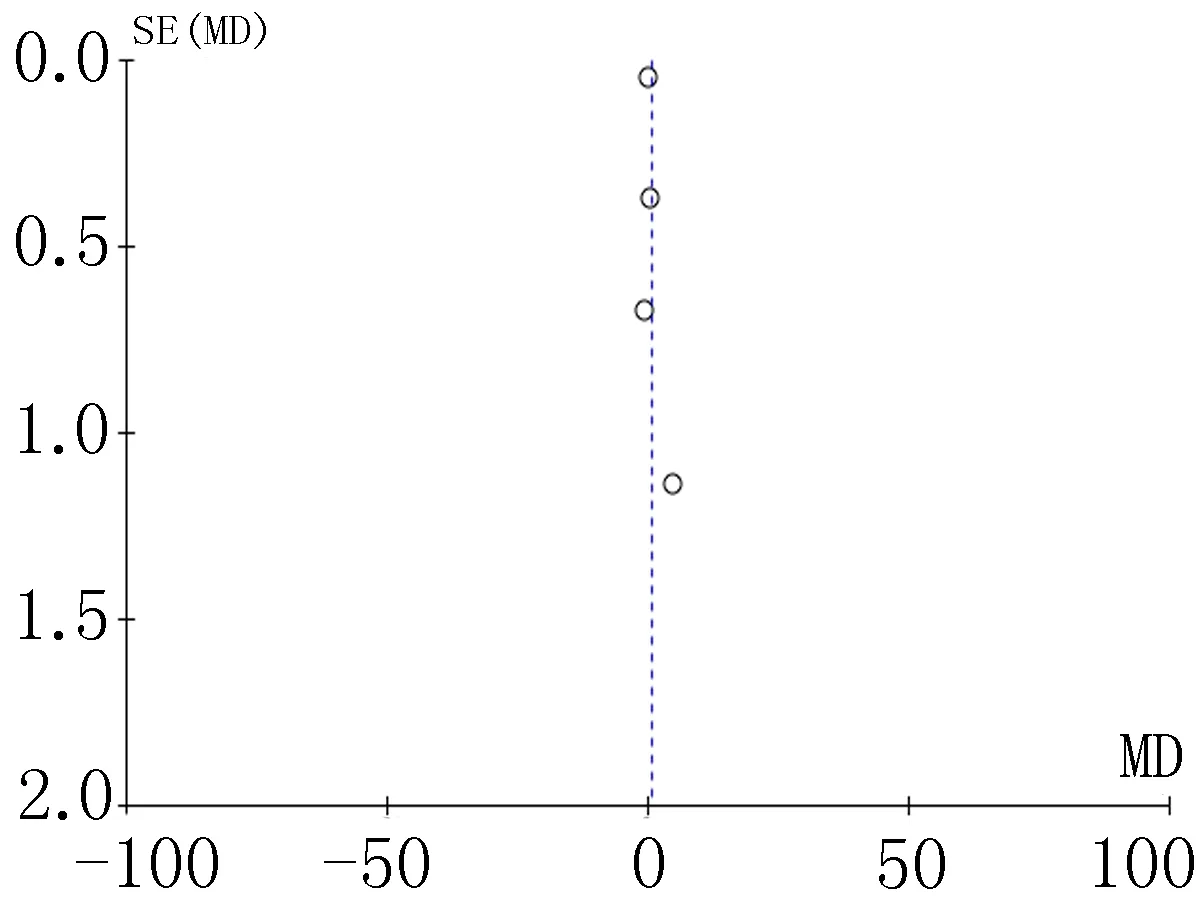
图15 住院费用比较的漏斗图
图16 术后ALB比较的漏斗图
图17 术后TRF比较的漏斗图

图18 术后PAB比较的漏斗图
3 讨论
食管癌在我国是一种患病率和死亡率高的肿瘤[22]。患者自身因肿瘤占位而进食困难,并且肿瘤长期消耗,导致患者术前就有着不同程度的营养不良。加之食管癌手术时间长、创伤大且术后长时间禁食,进一步加重营养不良的情况。以往临床上多采用静脉营养(parenteral nutrition, PN)支持治疗,但近年研究发现,长期的禁食或PN治疗时间过长,会导致患者肠黏膜萎缩、菌群失调、屏障功能损害、并发症增多及住院费用的增加等情况[23-24]。EEN可减少静脉插管的危险性,安全可行,并且可以增加肠道血供,促进肠道的蠕动,防止黏膜萎缩,避免菌群易位,降低并发症的发生率,改善预后。
食管癌术后吻合口瘘主要与吻合口的血供以及吻合方式、技术有关,EEN可促进肠道、肝脏等脏器的血供,增加血流量,降低吻合口瘘发生率。本研究结果显示EEN组的吻合口瘘发生率低于对照组,而肺部、切口感染发生率2组无明显差异,考虑EEN可降低食管癌术后吻合口瘘的发生。
本研究结果显示EEN组的术后排气排便时间、住院天数均少于对照组。其机制可能为进入肠道的液体和食物引起了胃肠道反应,激活了肠道神经—内分泌—免疫轴,促进胃肠道激素的释放[25],从而加快了胃肠道的蠕动,提供营养,缩短了患者的恢复周期,减少治疗费用。本研究结果考虑EEN可降低食管癌术后患者的肠道恢复时间,缩短住院天数,减少花费。
消化道肿瘤患者的营养不良常表现为蛋白质—能量缺乏型营养不良[16]。临床上常将ALB作为中长期营养治疗效果的参考指标,PAB、TRF作为短期营养治疗效果的参考指标。本研究结果显示EEN组术后BMI、ALB、PAB和TRF均高于对照组,考虑EEN可改善食管癌术后患者的机体营养状况,且在短期内并不因为有充足的外源性营养而逆转降低患者体质量[26]。
本研究对EEN对食管癌患者术后的影响进行了汇总分析,系统地表明EEN可减少术后并发症的发生,改善营养状况,缩短患者肠道回复时间、住院天数,减少花费。然而本研究存在以下局限性:(1)纳入的研究质量较低;(2)多数研究对随机化方法、分配隐藏、盲法和失访、退出等情况描述不全;(3)由于纳入文献数量较少,漏斗图分析存在偏倚。
综上所述,EEN可降低术后吻合口瘘的发生,改善患者营养状况,缩短患者术后排气排便时间以及住院天数,减少治疗费用。
[1] BURDEN S, TODD C, HILL J, et al. Pre-operative nutrition support to patients undergoing gastrointestinal surgery[J]. Cochrane Database Syst Rev,2012(14): CD008879.
[2] 张梅, 陈淑娜. 食管癌术后患者肠内营养并发症的预防性护理[J]. 山东医药, 2011,51(26):89.
[3] SHAILESH S, GURUPRASAD S, KAILASH S, et al. Is early feeding after major gastrointestinal surgery a fashion or an advance evidence-based review of literature[J].J Cancer Res Therapeutics, 2009,5(4):232-239.
[4] FIETKAU R, LEWITZKI V, KUHNT T, et al. A disease-specific enteral nutrition formula improves nutritional status and functional performance in patients with head and neck and esophageal cancer undergoing chemoradiotherapy: results of a randomized, controlled, multicenter trial[J]. Cancer, 2013,119(18):3343.
[5] SHOAR S, NADERAN M, MAHMOODZADEH H, et al. Early oral feeding after surgery for upper gastrointestinal malignancies: a prospective cohort study[J]. Oman Med J, 2016,31(3):182-187.
[6] WANG G, CHEN H, LIU J, et al. A comparison of postoperative early enteral nutrition with delayed enteral nutrition in patients with esophageal cancer.[J]. Nutrients, 2015,7(6):4308-4317.
[7] KOBAYASHI K, KOYAMA Y, KOSUGI S, et al. Is early enteral nutrition better for postoperative course in esophageal cancer patients?[J]. Nutrients, 2013,5(9):3461-3469.
[8] 王楚华, 沈有期, 黄世英. 不同营养支持疗法对术后早期食管癌和贲门癌患者的影响[J]. 广东医学, 2010,31(1):106-107.
[9] 杜志明, 余冬敏, 赖政洪, 等. 术后早期肠内营养对食管癌病人预后的影响[J]. 肠外与肠内营养, 2016,23(2):87-90.
[10] 田艳萍, 孔香兰, 马英. 早期肠内营养在食管癌术后病人中的应用及护理[J]. 护理研究, 2010,24(17):1549-1550.
[11] 王秀兰, 俞耀辉, 陈世法, 等. 食管癌及贲门癌切除术后早期肠内营养的临床观察[J]. 苏州大学学报(医学版), 2006,26(6):1019-1020, 1022.
[12] 夏晓明, 施仁忠, 张亚锋. 食管癌术后早期肠内营养对患者免疫功能的影响[J]. 山东医药, 2012,52(18):38-39.
[13] 王耀鹏, 徐林浩, 王清, 等. 食管癌患者术后早期肠内营养的临床研究[J]. 中国胸心血管外科临床杂志, 2006,13(2):94-96.
[14] 纪勇, 陈静瑜, 郑明峰, 等. 食管癌病人术后早期肠内营养的临床应用[J]. 肠外与肠内营养, 2012,19(1):21-23.
[15] 王化勇, 胡正群, 李勇, 等. 食管癌病人术后早期肠内营养的临床研究[J]. 肠外与肠内营养, 2008,15(5):295-297.
[16] 郭明发. 食管癌病人术后早期肠内营养的疗效观察[J]. 肠外与肠内营养, 2011,18(4):218-220, 224.
[17] 罗在琼, 郭志祥. 食管癌与贲门癌患者术后早期应用肠内营养的效果及护理[J]. 中华现代护理杂志, 2011,17(5):556-558.
[18] 鲍海咏, 李珉, 牛毅, 等. 术后早期肠内营养在食管癌患者中的应用[J]. 临床荟萃, 2009,24(18):1568-1570.
[19] 谢天鹏, 赵雍凡, 刘华英, 等. 早期肠内营养对食管癌术后全身炎性反应及细胞免疫功能的影响[J]. 四川医学, 2005,26(1):18-20.
[20] 陆红艳, 虞桂平. 早期营养支持治疗和护理干预对食管癌术后胃肠功能的影响[J]. 南昌大学学报(医学版), 2013,53(11):56-59.
[21] 赵桂彬, 曹守强, 张凯, 等. 早期肠内营养对食管癌患者术后免疫功能和临床结局的影响[J]. 中华胃肠外科杂志, 2014(4):356-360.
[22] 赫捷, 邵康. 中国食管癌流行病学现状、诊疗现状及担任中华未来对策[J]. 中国癌症杂志, 2011(7):501-504.
[23] 李德生,张铸,张昌明,等. 37例食管癌和贲门癌切除术后吻合口瘘临床分析[J]. 新疆医科大学学报,2005,28(11):1059-1060.
[24] 谢天鹏, 赵雍凡, 李强, 等. 食管癌术后早期全肠内营养支持的实施及并发症防治[J]. 中国临床营养杂志, 2006,14(2):134-135.
[25] BERKSON J, BOOTHBY W M. Studies of the energy of metabolism of normal individuals. A comparison of the estimation of basal metabolism from (1) a linear formula and (2) “surface area”[J]. Am J Physiol, 1936,116(2):485.
[26] KAMOHARA H, TAKAHASHI M, ISHIKO T, et al. Induction of interleukin-8 (CXCL-8) by tumor necrosis factor-alpha and leukemia inhibitory factor in pancreatic carcinoma cells: Impact of CXCL-8 as an autocrine growth factor [J]. Int J Oncol, 2007,31(3):627-632.

