海分枝杆菌和溃疡分枝杆菌二重PCR检测方法的建立及应用*
武迪,陈世玖,王成,龙航,杨军,刘珑玲
[遵义医学院第五附属(珠海)医院 整形手外科,广东 珠海 519100]
海分枝杆菌和溃疡分枝杆菌是常见的引起手部及皮肤软组织感染的非结核分枝杆菌(nontuberculous mycobacteria,NTM)[1-3]。根据伯杰系统细菌学手册及Runyon分类法,海分枝杆菌属Ⅰ组缓慢生长型光产色菌,溃疡分枝杆菌属Ⅲ组缓慢生长型不产色菌[4]。海分枝杆菌和溃疡分枝杆菌普遍存在水环境中及动物体上,主要通过伤口侵入人体引起病变[5-7],所致疾病其治疗有所不同[7-8],故准确诊断鉴定海分枝杆菌和溃疡分枝杆菌感染很有意义。然而海分枝杆菌和溃疡分枝杆菌感染临床表现基本相似,通过临床表现不能诊断及鉴别海分枝杆菌和溃疡分枝杆菌感染,传统的检测方法耗时且难于鉴别。因此,本研究建立二重PCR方法同步检测鉴定海分枝杆菌和溃疡分枝杆菌,为早期诊断、早期治疗手部及皮肤软组织感染海分枝杆菌和溃疡分枝杆菌提供一定依据,并初步应用该方法检测鉴定2014年1月-2015年12月遵义医学院第五附属(珠海)医院收集的19份临床上考虑上肢感染NTM的标本。
1 资料与方法
1.1 资料
1.1.1 标准菌 海分枝杆菌(ATCC927)购自美国ATCC公司,鸟分枝杆菌(ATCC25291)、胞内分枝杆菌(ATCC13950)、堪萨斯分枝杆菌(ATCC12478)、偶然分枝杆菌(ATCC6841)、龟分枝杆菌(ATCC35752)、溃疡分枝杆菌(ATCC19423)均购自美国MicroBioLogics公司。
1.1.2 纳入标准 临床考虑上肢感染NTM的患者:①患者均来自沿海地区,与海洋生物有密切接触史;②临床表现:上肢出现丘疹、皮下肉芽肿伴或不伴有溃疡、滑膜炎、腱鞘炎、关节炎、骨破坏;③病理检查示慢性肉芽肿性炎症,可有干酪样坏死或抗酸染色找到抗酸杆菌;④患者无低热、盗汗、乏力等结核临床表现,相关辅助检查提示无肺结核;⑤常规抗感染治疗无效。
1.1.3 一般资料 本研究共纳入患者19例,其中,男性8例,女性11例;年龄29~62岁。渔民11例,海产品养殖者3例,海产品销售员4例,其他1例。均有海洋生物刺伤史,病程4周~2年。手术切取病灶组织分为2份,一份送病理检查,另一份保存于-20℃作为本研究的待测标本,病检结果示病灶组织病理改变均符合NTM感染。所有患者经抗NTM治疗有效。
1.1.4 仪 器 和 试 剂T100TMThermal Cycler( BioRad PCR仪)购自深圳市宇德立生物科技有限公司,Gel Doc XR+凝胶成像分析系统购自北京赛百奥科技有限公司,THERMO Multiskan GO全波长酶标仪购自北京平利洋公司,Ezup柱式细菌基因组DNA抽提试剂盒购自生工生物工程(上海)有限公司,EmeraldAmp PCR Master Mix 购自大连宝生物工程有限公司,DL600 DNA Marker购自上海生工生物工程有限公司。
1.2 方法
1.2.1 引物的设计 通过参考文献[9-10]及GeneBank查找海分枝杆菌和溃疡分枝杆菌的特有基因序列,采用NCBI/Primer-BLAST软件[11]及MFEprimer-2.0软件[12]设计2对特异性引物。引物由上海生工生物工程有限公司合成,引物序列见表1。
1.2.2 临床标本及标准菌株DNA提取 采用Ezup柱式细菌基因组DNA抽提试剂盒提取临床标本及标准菌DNA。取菌液或组织匀浆液1 ml于1.5 ml EP管中,室温离心,8 000 r/min,离心1 min,弃上清,收集菌体,加入180 ml溶菌酶(20 mg/ml)混匀,37℃电热恒温水浴箱水浴40 min,加入20 ml Proteinase K溶液混匀,56℃电热恒温水浴箱水浴30 min,加入200 ml Buffer BD,充分颠倒混匀,加入200 ml无水乙醇,充分颠倒混匀,将吸附柱放入收集管中,将溶液和半透明纤维悬浮物全部加入吸附柱中,静置2 min,室温离心后,倒掉收集管中的废液,将吸附柱放入收集管中,加入500 ml PW Solution,室温离心,倒掉收集管中的废液,将吸附柱放入收集管中,加入500 ml Wash Solution,室温离心后,倒掉收集管中的废液,将吸附柱放入收集管中,室温离心后,打开吸附柱盖子,室温彻底晾干Wash Solution,取出吸附柱放入1个新的1.5 ml EP管中,加入CE Buffer 50~100 ml,室温离心后收集DNA溶液,-20℃保存备用。

表1 二重PCR引物序列
1.2.3 PCR扩增目的片段PCR反应体系的组成:引物1.0 ml(终浓度为0.4 mmol/L),模板DNA 1.0 ml,Emerald Amp PCR Master Mix 10.0 ml, 加 入ddH2O至总体积为25 ml。PCR反应条件:95℃预变性480 s,95℃变性30 s,67.0~60.0退火20 s,72℃延伸60 s,共30个循环,72℃继续延伸60 s。反应结束后于4℃保存。本研究设计的2对引物其Tm值在59.0~60.0℃,平均Tm值为60.0℃。故预设退火温度在67.0~60.0℃,观察退火温度对PCR结果的影响,确定最佳退火温度,并以最佳退火温度进行下一步实验。PCR扩增产物经3%琼脂糖凝胶电泳后于Gel Doc XR+凝胶成像分析系统进行分析,判读结果。
1.2.4 标准菌单一PCR扩增测序 用通用引物(正向引物:5'-ATAAGCCTGGGAAACTGGGT-3',反向引物:5'-CACGCTCACAGTTAAGCCGT-3')分别对本实验所用到的海、鸟、胞内、堪萨斯、偶然、龟、溃疡分枝杆菌的标准菌DNA进行PCR扩增,电泳观察是否出现相应的目标条带,并对标准菌PCR扩增后的产物进行DNA测序,测序结果与GeneBank数据库相应标准菌基因序列进行比对分析,评估本研究所用的标准菌是否符合标准菌的要求。
1.2.5 验证引物特异性 用海分枝杆菌引物分别与海、鸟、胞内、堪萨斯、偶然、龟、溃疡分枝杆菌(标准菌)DNA模板进行PCR扩增,电泳观察是否只有海分枝杆菌DNA模板反应管出现429 bp的目标条带,验证海分枝杆菌引物的特异性,用同样的方法可验证溃疡分枝杆菌引物的特异性。
1.2.6 二重PCR的建立 海分枝杆菌引物与海分枝杆菌模板DNA进行PCR扩增,溃疡分枝杆菌引物与溃疡分枝杆菌模板DNA进行PCR扩增,建立单一PCR;海分枝杆菌、溃疡分枝杆菌引物与海分枝杆菌、溃疡分枝杆菌模板DNA于同一反应管内进行PCR扩增,建立二重PCR。
1.2.7 二重PCR的检测 ①特异性:二重PCR分别检测海、鸟、胞内、堪萨斯、偶然、龟、溃疡分枝杆菌及海分枝杆菌和溃疡分枝杆菌的混合样品,电泳观察是否出现目的条带。②准确性:二重PCR分别检测海及溃疡分枝杆菌,电泳观察是否出现相应的特异性条带。③敏感性:二重PCR敏感性是指二重PCR能检测到的最低细菌DNA浓度。先用THERMO Multiskan GO全波长酶标仪检测已提取的海分枝杆菌和溃疡分枝杆菌标准细菌DNA原液中DNA的浓度,将海分枝杆菌和溃疡分枝杆菌标准细菌DNA原液用超净水以10倍系列(1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7、1×10-8和1×10-9)稀释后,分别取1ml进行PCR电泳后观察各目标条带的清晰程度,初步确定该多重PCR的敏感性。
1.2.8 二重PCR检测临床标本 二重PCR检测19份临床标本,以DL600 DNA Marker作对照,根据临床标本产生的目标条带与DL600 DNA Marker对应关系,鉴定临床标本病原菌,并对结果进行分析。
2 结果
2.1 标准菌单一PCR扩增测序结果
用通用引物扩增7种分枝杆菌DNA,分别获得的目标条带。单一PCR扩增标准菌DNA测序结果与GeneBank中相应菌种DNA进行比对。单一PCR扩增标准菌DNA序列与GenBank数据库中相应菌种DNA序列同源性>99%,说明本研究所用的标准菌符合标准菌的要求。海分枝杆菌标准菌通用引物PCR扩增双向测序图及拼接后序列用BLAST与GenBanK数据库中的AF057476.1比对,其一致性为100%。鸟分枝杆菌标准菌通用引物PCR扩增双向测序图及拼接后序列用BLAST与GenBanK数据库中的AF057457.1进行比对,其一致性为99%。堪萨斯分枝杆菌标准菌通用引物PCR扩增双向测序图及拼接后序列用BLAST与GenBanK数据库中的AF057473.2进行比对,其一致性为100%。偶发分枝杆菌标准菌通用引物PCR扩增双向测序图及拼接后序列用BLAST与GenBanK数据库中的AF057464.1进行比对,其一致性为100%。龟分枝杆菌标准菌通用引物PCR扩增双向测序图及拼接后序列用BLAST与GenBanK数据库中的AF057460.1进行比对,其一致性为99%。胞内分枝杆菌标准菌通用引物PCR扩增双向测序图及拼接后序列见图7。溃疡分枝杆菌标准菌通用引物PCR扩增双向测序图及拼接后序列用BLAST与GenBanK数据库中的AF057491.1进行比对,其一致性为100%。经扩增后测序并对比,该研究所用海、鸟、堪萨斯、偶发、龟、胞内、溃疡分枝杆菌的标准菌均符合研究要求。
2.2 引物特异性检测结果
海分枝杆菌的引物与海分枝杆菌模板DNA结合出现429 bp的目标条带,与其他分枝杆菌模板DNA无条带出现(见图1和表2)。溃疡分枝杆菌的引物与溃疡分枝杆菌模板DNA结合出现240 bp的目标条带,与其他分枝杆菌模板DNA无条带(见图2和表2)。表明海、溃疡分枝杆菌引物是特异的。
2.3 二重PCR的成功建立
海分枝杆菌引物与海分枝杆菌模板DNA进行PCR扩增出现429 bp的目标条带,溃疡分枝杆菌引物与溃疡分枝杆菌模板DNA进行PCR扩增出现240 bp的目标条带,单一PCR成功建立(见图3)。海分枝杆菌、溃疡分枝杆菌引物与海分枝杆菌、溃疡分枝杆菌模板DNA于同一反应管内进行PCR扩增出现429和240 bp的目标条带(见图3)。表明二重PCR成功建立。
2.4 探索二重PCR的最佳退火温度
二重PCR其他反应条件不变,退火温度从67.0~60.0℃,各目标条带在62.7℃都出现且较清晰(见图4)。所以二重PCR的最佳退火温度为62.7℃。
2.5 二重PCR敏感性
海分枝杆菌和溃疡分枝杆菌标准细菌DNA原液中所含DNA的量:海分枝杆菌1.27 ng/μl、溃疡分枝杆菌11.2 ng/μl,将各标准细菌DNA原液用无菌超净水以 10 倍系列(1×10-1、1×10-2、1×10-3、1×10-4、1×10-5、1×10-6、1×10-7、1×10-8和 1×10-9) 稀 释后,分别取1μl进行PCR电泳确定其敏感性(见图5)。该多重PCR最低可检测出0.508 pg/μl海分枝杆菌DNA,44.8 fg/μl溃疡分枝杆菌DNA。
2.6 二重PCR检测临床标本
二重PCR检测19份临床标本,11份出现目标条带,检出率为58%,海分枝杆菌占42.1%(8例),溃疡分枝杆菌占15.8%(3例),其中以海分枝杆菌感染最多见(见图6、7)。二重PCR从获取临床标本到检测鉴定海分枝杆菌和溃疡分枝杆菌经测算需6~7 h。

图1 海分枝杆菌引物特异性

图2 溃疡分枝杆菌引物特异性
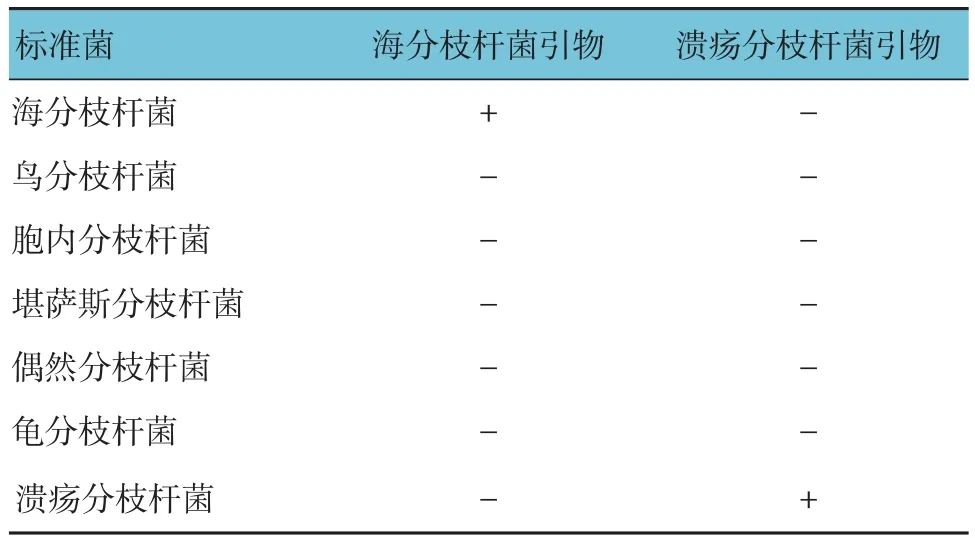
表2 标准菌DNA模板与引物进行PCR产生目标条带的情况

图3 二重PCR的建立
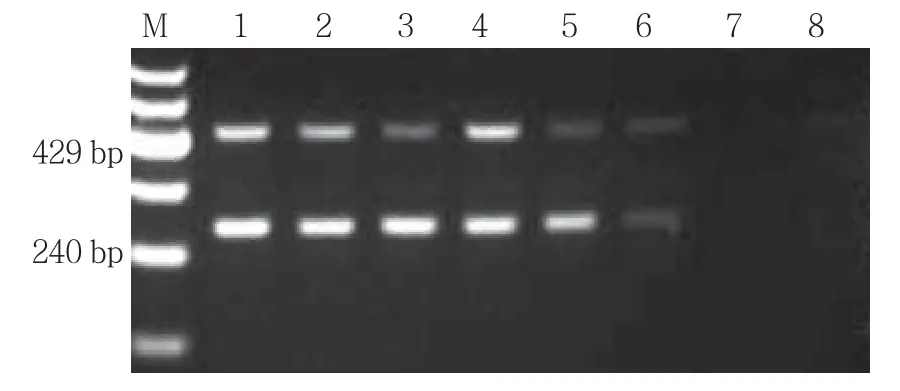
图4 二重PCR的退火温度
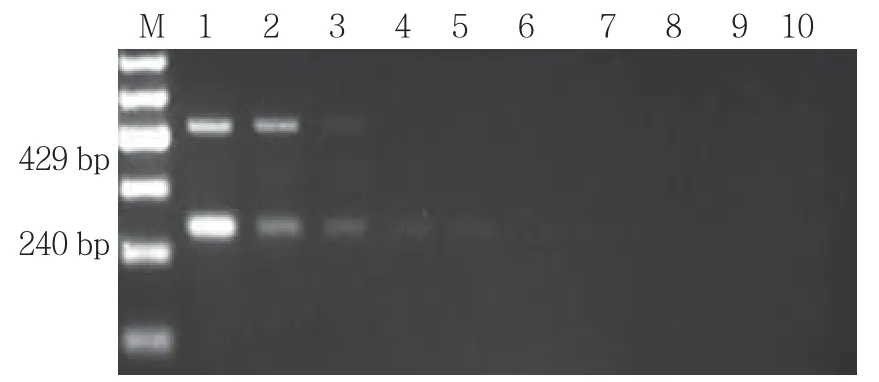
图5 二重PCR的敏感性

图6 二重PCR检测临床标本

图7 二重PCR检测临床标本
3 讨论
NTM属分枝杆菌属,为一群细菌的总称,广泛存在于水、土壤和灰尘等自然环境中,大部分为腐物寄生菌,仅少部分对人体致病,既往被认为是条件致病菌。不同的NTM可引起不同的组织器官病变,海分枝杆菌主要引起皮肤软组织及手部感染[13-14],溃疡分枝杆菌主要引起皮肤软组织[14],这2种分枝杆菌引起的皮肤软组织感染其临床表现、病理检查相似,且作为检测鉴定分枝杆菌金标准的16SrRNA区域的基因也相同[15]。因此,鉴别海分枝杆菌和溃疡分枝杆菌存在困难。本研究以海分枝杆菌mel2基因序列及溃疡分枝杆菌IS2404基因序列作为靶序列建立二重PCR同步检测鉴定海分枝杆菌和溃疡分杆菌,为临床早期诊断、早期治疗海分枝杆菌和溃疡分杆菌感染提供一定依据显得很有价值。
二重PCR是指在同一反应管里加入两对引物同时扩增一个模板DNA的两个区域或两个模板DNA的聚合酶链反应。PCR引物设计影响着PCR扩增的特异性及有效性,本研究采用NCBI/Primer-BLAST软件设计能扩增海分枝杆菌和溃疡分枝杆菌靶序列的引物,并用MFEprimer-2.0软件评估引物自身及引物间的互补性,避免引物形成发夹结构或引物二聚体影响引物扩增的效率致二重PCR建立失败。
二重PCR的敏感性揭示二重PCR能检测的最低目标模板DNA的量,当检测的样品中所含的目标DNA量低于二重PCR能检测的最低目标DNA量时,二重PCR不会出现目标条带,得到假阴性结果。二重PCR的敏感性越高,能检测的目标DNA量越低,其假阴性结果越少。本研究建立的二重PCR最低可检测出最低可检测出0.508 pg/μl的海分枝杆菌,44.8 fg/μl的溃疡分枝杆菌,敏感性较高。
二重PCR检测19份考虑上肢感染NTM的临床标本,11份临床标本出现阳性条带,检出率为57.9%,8份临床标本未检出病原菌,其原因:①收集标本时未取到病原菌所在区域;②标本中病原菌较少,所提取的DNA含量低于该二重PCR所能检测的最低DNA量,出现了假阴性结果;③收集的标本为其他NTM病原菌感染,本研究建立的二重PCR仅能检测鉴定海分枝杆菌和溃疡分枝杆菌感染,故该二重PCR方法检测阴性的标本不排除其他NTM感染的可能。42.1%(8份)临床标本被鉴定为海分枝杆菌感染,其可能的原因为本研究选取的临床标本均来自与海洋微生物有密切接触史的患者,且为临床上考虑上肢感染NTM的标本。
[1]ALCAIDE F, ESTEBAN J. Cutaneous and soft skin infections due to non-tuberculous mycobacteria[J]. Enfermedades Infecciosas Y Microbiologia Clinica, 2010, 28(Suppl 1): 46-50.
[2]BABAMAHMOODI F, BABAMAHMOODI A, NIKKHAHAN B.Review of mycobacterium marinum infection reported from iran and report of three new cases with sporotrichoid presentation[J].Iranian Red Crescent Medical Journal, 2014, 16(2): e10120.
[3]王成. 陈世玖. 手部非结核分枝杆菌感染的临床治疗[J]. 中华手外科杂志, 2013, 29(1):54-55.
[4]中华医学会结核病学分会. 非结核分枝杆菌病诊断与治疗专家共识[J]. 中华结核和呼吸杂志, 2012, 35(8): 527-580.
[5]TEBRUEGGE M, CURTIS N. Mycobacterium marinum infection[J]. Advances in Experimental Medicine and Biology,2011, 719: 201-210.
[6]BOURICHA M, CASTAN B, DUCHENE-PARISI E, et al.Mycobacterium marinum infection following contact with reptiles:vivarium granuloma[J]. International Journal of Infectious Diseases, 2014, 21: 17-18.
[7]GARCHITORENA A, ROCHE B, KAMGANG R, et al.Mycobacterium ulcerans ecological dynamics and its association with freshwater ecosystems and aquatic communities: results from a 12-month environmental survey in cameroon[J]. PLoS Neglected Tropical Diseases, 2014, 8(5): DOI: org/10.1371/journal.pntd.0002879.
[8]WU T S, CHIU C H, YANG C H, et al. Fish tank granuloma caused by mycobacterium marinum[J]. PLoS One, 2012, 7(7): e41296.
[9]EL-ETR S H, SUBBIAN S, CIRILLO S L, et al. Identifi cation of two mycobacterium marinum loci that affect interactions with macrophages[J]. Infection and Immunity, 2004, 72(12): 6902-6913.
[10]NAKANAGA K, HOSHINO Y, YOTSU R R, et al. Nineteen cases of Buruli ulcer diagnosed in Japan from 1980 to 2010[J]. Journal of Clinical Microbiology, 2011, 49(11): 3829-3836.
[11]YE J, COULOURIS G, ZARETSKAYA I, et al. Primer-BLAST:a tool to design target-specific primers for polymerase chain reaction[J]. BMC Bioinformatics, 2012, 13: 134.
[12]QU W, ZHOU Y, ZHANG Y, et al. MFEprimer-2.0: a fast thermodynamics-based program for checking PCR primer specificity[J]. Nucleic Acids Research, 2012, 40(Web Server issue): W205-208.
[13]YOON H J, KWON J W, YOON Y C, et al. Nontuberculous mycobacterial tenosynovitis in the hand: two case reports with the MR imaging fi ndings[J]. Korean Journal of Radiology, 2011,12(6): 745-749.
[14]ATKINS B L, GOTTLIEB T. Skin and soft tissue infections caused by nontuberculous mycobacteria[J]. Current Opinion in Infectious Diseases, 2014, 27(2): 137-145.
[15]孙王伟, 周燕菊, 谢怡萍, 等. PCR直接测序法在脓肿分枝杆菌鉴定中的应用[J]. 海南医学, 2014, 25(22): 3342-3345.

