TAK-242对Aβ25-35诱导大鼠海马神经元损伤的作用及其机制研究
葛宇松,马成永,徐晏雯,林永忠
(大连医科大学附属第二医院 神经内科,辽宁 大连 116023)
社会老龄化日益严重,老年期痴呆的患者逐渐增多,其中阿尔茨海默病(Alzheimer’s disease,AD)是其中最常见的痴呆类型。流行病学调查结果显示,我国年龄≥65岁老年人中AD的患病率为3%~8%,并且随着年龄的增长,患病率将逐渐上升[1]。AD主要表现为隐匿起病,不可逆进行性加重的认知功能损伤包括记忆、视空间能力、语言表达能力等领域障碍,以及常伴随的非认知性神经精神症状,其特征性病理学改变是神经元纤维缠结(neurofibrillary tangle,NFT)、大量老年斑(senile plaque,SP)形成及神经元缺失[2-3],其中SP核心及主要成分为β-淀粉样蛋白(β-amyloid peptide,Aβ)。
近几年中枢神经系统的炎症反应与AD发病机制的紧密联系及相互作用日益受到关注。研究显示,在AD的炎症反应过程中,Aβ可诱导神经细胞表达和释放多种与炎症相关的活性物质,包括白细胞介素1(interleukin-1,IL-1)、IL-6、肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、活性氧自由基(reactive oxygen species,ROS)等,加剧神经细胞的退行性变,而抑制炎症反应可以有效缓解Aβ诱导的神经损伤[2,4-5]。Toll样受体 4(toll-like receptor 4,TLR4)信号通路是目前已知的 重要的炎性通路之一,近 来研究也证实TLRs信号通路参与AD的演变过程,且TLR4在Aβ介导的神经毒性作用中具有重要作用[6-7],而抑制TLR4信号通路可以缓解Aβ介导的炎症反应[8-9]。TAK-242是TLR4的特异性抑制剂,在脑缺血、脑出血及创伤性脑损伤中都起到神经保护作用[10-12],然而其是否可以抵抗Aβ诱导的神经细胞损伤仍然未知。
本实验通过双侧海马注射聚集态的Aβ25-35复制AD模型,腹腔注射TAK-242进行干预,观察TAK-242的治疗是否可以促进海马神经细胞的存活,以及对大鼠海马组织中TLR4信号通路蛋白及炎症因子表达的影响,从而了解TAK-242的作用机制。
1 材料与方法
1.1 材料
健康Wister大鼠共30只,雌雄不限,体重200~250 g,由中国医科大学动物部提供。所有动物按照自然昼夜,自由进食进水,20~25℃、标准大鼠饲料常规饲养。Aβ25-35(用无菌生理盐水将Aβ25-35稀释成5μg/μl,37℃下孵育2 d,使其变为聚集态的Aβ25-35)、二甲基亚砜(dimethyl sulphoxide,DMSO)购自美国Sigma公司,TAK-242(TAK-242溶于1% DMSO生理盐水溶液,终浓度为0.4 mg/ml)购自美国MCE公司,TLR4多克隆抗体购自武汉三鹰公司,髓样分化因子88(myeloid differentiation factor 88,MyD88)多克隆抗体购自武汉博士德公司,β-肌动蛋白和辣根过氧化物酶标记的IgG抗体购自美国Santa Cruz公司,IL-1β和TNF-α酶联免疫吸附法(enzyme linked immunosorbent assay,ELISA)试剂盒购自美国R&D公司,其余试剂均为国产分析纯。
1.2 方法
1.2.1 实验动物分组及模型的复制Wister大鼠随机分为对照组(双侧海马分别注入生理盐水+腹腔注射1% DMSO生理盐水)、模型组(双侧海马分别注入Aβ+腹腔注射1% DMSO生理盐水)和药物组(双侧海马分别注入Aβ+腹腔注射TAK-242/1% DMSO生理盐水),每组10只。将Wister大鼠用10%水合氯醛(300 mg/kg)腹腔麻醉后,颅顶正中切开皮肤,暴露头骨,俯卧位固定于脑立体定向仪上,双侧颅骨分别钻孔,深达硬脑膜。定位:前囟后3.5 mm,中逢左右2.0 mm, 颅骨平面向下2.7 mm,即为海马注射点。模型组和药物组每侧海马注射2μl(10μg)Aβ25-35,并留针5 min,对照组注射相应剂量生理盐水。TAK-242按5 mg/(kg·d)一次性给予大鼠腹腔注射,从海马注射前1天开始至海马注射后7 d结束,对照组和模型组按同样时间注射相应剂量的1% DMSO生理盐水。各组大鼠均于海马注射后7 d处死。
1.2.2 标本采集 ①各组5只大鼠麻醉后迅速开胸,生理盐水灌注心脏后以4%多聚甲醛液灌注至动物四肢变硬,断头取脑,样本置于4%多聚甲醛中固定24 h,以注射针道为中心做冠状切脑,酒精脱水,二甲苯透明,浸蜡,包埋。连续冠状切片,片厚6μm。相邻切片分别作Nissl染色。②各组5只大鼠麻醉后,断头取脑,冰上分离双侧海马组织,-70℃冰箱保存。左侧进行Western blot检测;右侧进行ELISA检测。
1.2.3 NISSL染色 取各组大鼠切面相同的切片,石蜡切片常规脱蜡至水,染色于硫堇-石碳酸30 min,37℃温箱加热。梯度酒精粉色脱水后,二甲苯透明,中性树胶封片。对Nissl染色的结果进行海马锥体神经元计数,即在低倍镜下(×40)确定海马CA3区位置,然后在高倍镜下(×400)连续数2个视野的海马锥体神经元数目,取其均值,每只动物数3张切片,取其均值,为该只大鼠海马CA3区锥体神经元数。
1.2.4 Western blot检测 取保存的冷冻组织,低温提取蛋白,Lowry法测定蛋白浓度。取50μg蛋白上样到10% SDS-聚丙烯酰胺凝胶,电泳(120 V,1.5 h)。待溴酚蓝进入凝胶底部后,把蛋白质再印迹到硝酸纤维素膜上,封闭,将膜与溶于封闭液中的一抗(兔抗TLR4抗体1∶500、兔抗MyD88抗体1∶300和小鼠抗β-actin抗体1∶300)4℃孵育过夜,洗涤,最后加入辣根过氧化物酶标记的二抗(1∶10 000)室温孵育1 h,洗涤后用ECL发光液曝光显影,将蛋白印迹显影图扫描,利用图像分析软件Scion Image对蛋白带进行光密度分析。以β-actin作为内对照,以对照组目的条带与β-actin灰度值比值为1,计算各组目的蛋白相对表达量。作为TLR4和MyD88蛋白的半定量指标。
1.2.5 ELIS A取保存的冷冻组织,用0.01 mmol/L PBS(pH=7.2~7.4),匀浆后4℃离心,取上清,用ELISA检测IL-1β和TNF-α水平,操作按试剂盒说明进行。所有实验均重复3次,取平均值进行比较。
1.3 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,组间比较用单因素方差分析,两两比较用Tukey's检验,P<0.05表示差异有统计学意义。
2 结果
2.1 TAK-242对Aβ25-35诱导大鼠海马CA3区神经元损伤的影响
3组大鼠海马CA3区神经元比较,经方差分析,差异有统计学意义(F=21.618,P=0.000)。对照组大鼠海马CA3区细胞带无明显受损,神经细胞密集,排列完整。模型组大鼠海马CA3区较对照组神经细胞排列紊乱,细胞带结构丧失,细胞减少明显,与对照组比较差异有统计学意义(P<0.05);药物组大鼠较模型组上述表现明显改善,与模型组比较差异有统计学意义(P<0.05)。见图 1、2。
2.2 TAK-242对Aβ25-35诱导大鼠海马TLR4和MyD88表达的影响
3组大鼠TLR4和MyD88蛋白表达量比较,经方差分析,差异有统计学意义(F=53.006和26.129,均P=0.000)。对照组TLR4和MyD88蛋白表达量较低。与对照组相比,模型组TLR4和MyD88蛋白表达升高(P<0.05),药物组上述指标表达亦高于对照组(P<0.05)。与模型组相比,药物组TLR4和MyD88表达降低(P<0.05)。见图 3。
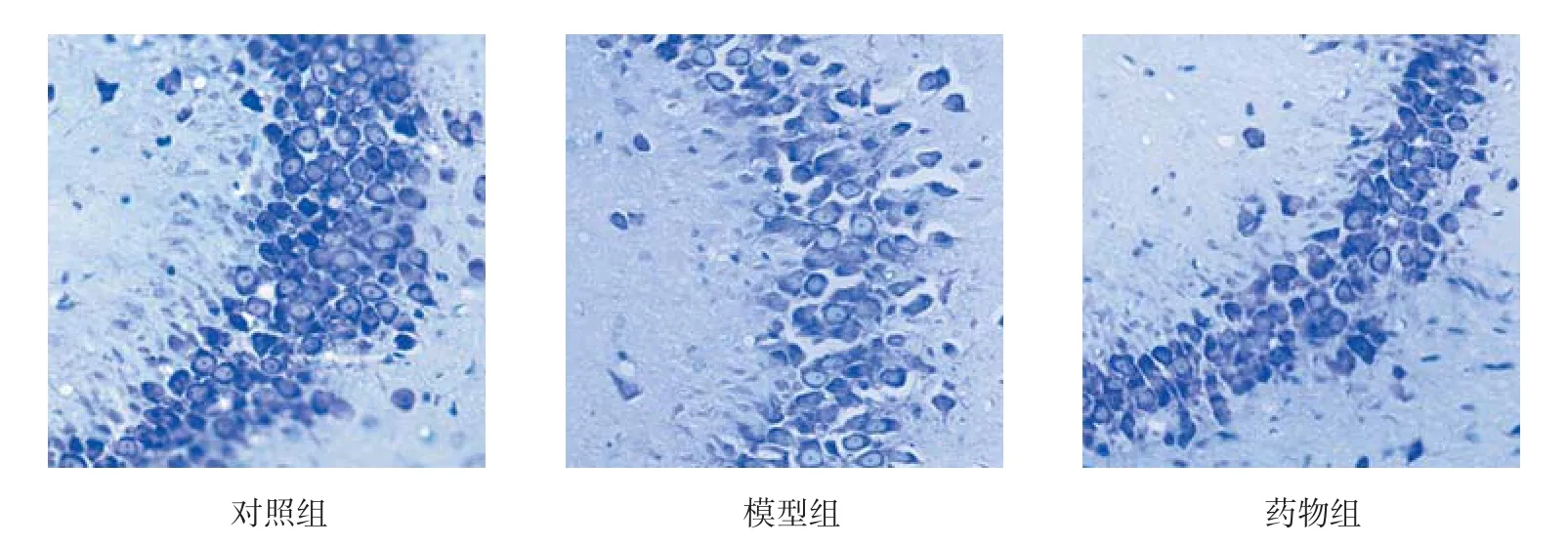
图1 各组大鼠海马CA3区的神经元 (Nissel染色×400)
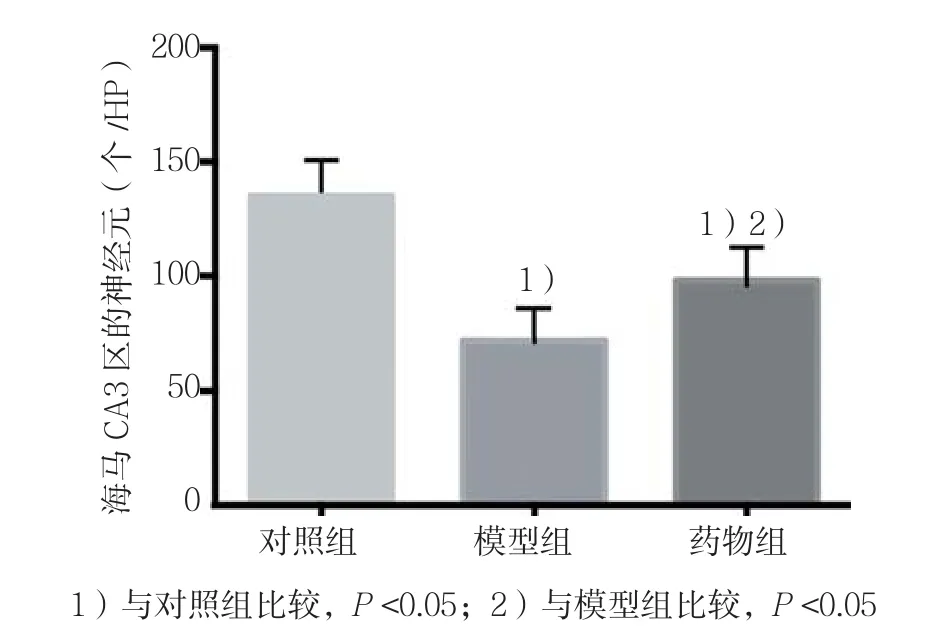
图2 各组大鼠海马CA3区的神经元比较
2.3 TAK-242对Aβ25-35诱导大鼠海马IL-1β和TNF-α表达的影响
3组大鼠IL-1β和TNF-α的表达水平比较,经方差分析,差异有统计学意义(F=51.539和69.299,均P=0.000)。对照组IL-1β和TNF-α的含量较低,与对照组相比,模型组IL-1β和TNF-α表达量升高(P<0.05);与模型组相比,药物组IL-1β和TNF-α表达量降低(P<0.05)。见图 4。
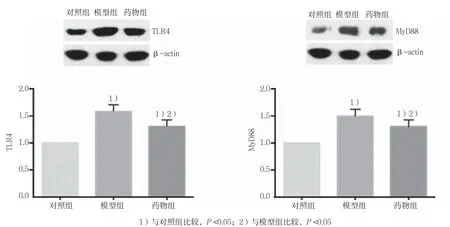
图3 各组海马TLR4和MyD88蛋白的表达
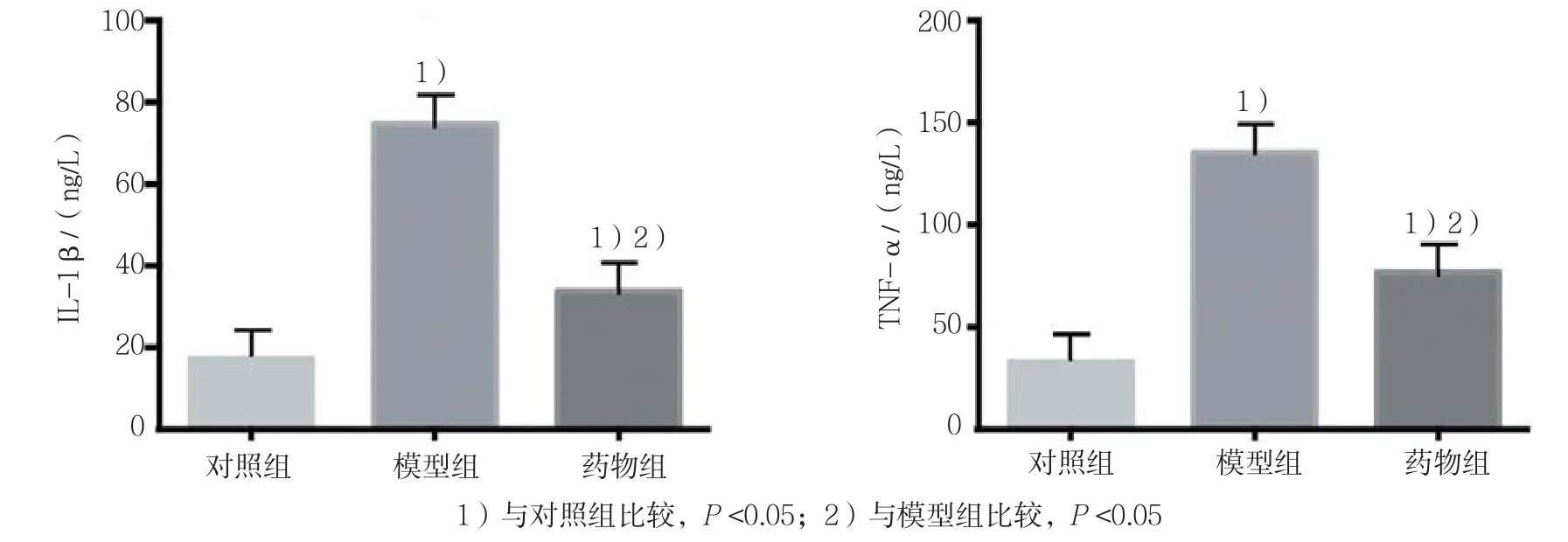
图4 各组海马IL-1β和TNF-α的表达
3 讨论
AD是中枢神经系统原发性退行性疾病,其主要病理特征之一是在大脑皮层和海马出现大量的老年斑,其主要成分是Aβ。在体和离体实验均发现Aβ可以诱导神经元凋亡,氧化应激以及炎症反应等,而炎症反应越来越受到关注。在AD脑内,Aβ1-40/Aβ1-42形成了β折叠的核心片段,发挥毒性作用。而研究证实,Aβ25-35可以产生同样的毒性作用[13],因此可以应用Aβ25-35作为AD的研究工具。
本实验采用双侧海马注射聚集态的Aβ25-35复制AD模型,采用Nissl染色可见模型组海马CA1区神经细胞带受损,细胞排列紊乱,细胞数减少,由此可见模拟AD脑内Aβ对神经细胞的损伤成功,与既往研究一致[14]。而应用TAK-242治疗的药物组明显改善海马神经细胞的损伤,保护海马神经元抵抗Aβ25-35诱导的神经毒性。
TLR4是膜蛋白家族一员,是非特异性免疫反应中一类重要的模式识别受体,能过激活下游多种信号分子的表达,促进致炎因子如IL-1、TNF-α的释放,其在神经系统炎症反应中具有重要作用。在体及离体实验研究均显示TLR4参与AD的炎症反应,在其发病机制和病理生理过程中发挥重要角色[4],且抑制Aβ诱导的炎症反应可以起到神经保护作用[5]。
TLR4信号传导通路包括MyD88依赖途径和非MyD88依赖途径,其中MyD88依赖性途径主要介导促炎细胞因子的表达,在传递上游信息和疾病发生发展中具有重要作用[15]。TLR4活化后与MyD88结合,依次激活下游信号分子IL-1受体相关激酶、肿瘤坏死因子受体相关因子6,最终激活NF-κB信号传导途径,启动细胞因子(如IL-1、TNF-α等)的转录、翻译,致使炎症因子大量释放[16]。 IL-1β具有多种细胞活性,如细胞增殖,分化和凋亡,并且在脑内高表达。其可以引起APP表达增多,加重Aβ的沉积和Tau磷酸化水平[17]。TNF-α是诱导炎症反应和诱导免疫调节过程中的一个重要因子,通过调节细胞因子的级联反应,导致神经元死亡并促进淀粉样前体蛋白(amyloid pre cursor protein,APP)和Aβ的产生[5]。此外,炎症因子可通过上调APP蛋白水解酶β-分泌酶和γ-分泌酶的表达活性来增加脑内Aβ产生和沉积[18]。由此推断,Aβ和炎症因子间形成一个恶性循环,加重AD脑内的病理变化。
本实验结果显示,Aβ可以引起大鼠海马组织TLR4、MyD88蛋白,以及IL-1β和TNF-α表达增高,而TAK-242降低Aβ诱导的上述蛋白表达变化。结合Nissl染色结果可以得出,TAK-242作为TLR4特异性抑制剂可以通过下调TLR4/MyD88信号通路,减少IL-1β和TNF-α炎症因子的释放,从而起到神经保护作用。此外,TAK-242目前已经应用于脓毒症的临床2期实验研究中,在人体中具有良好的安全性[19],这为AD的治疗提供新的思路,并可能带来治疗方法的新进展。
[1]PRINCE M, BRYCE R, ALBANESE E, et al. The global prevalence of dementia: a systemati c review and metaanalysis[J].Alzheimers Dement, 2013, 9(1): 63-75.
[2]KUMAR A, SINGH A, EKAVALI. A review on Alzheimer’s disease pathophysiology and its management: an update[J]. Pharmacol Rep, 2015, 67(2): 195-203.
[3]de PAULA V J, RADANOVIC M, DINIZ B S, et al. Alzheimer’s disease[J]. Subcell Biochem, 2012, 65: 329-352.
[4]ZHANG F, JIANG L. Neuroinfl ammation in Alzheimer’s disease[J].Neuropsychiatr Dis Treat, 2015, 11: 243-256.
[5]RUBIO-PEREZ J M, MORILLAS-RUIZ J M. A review:infl ammatory process in Alzheimer’s disease, role of cytokines[J].Scientifi c World Journal, 2012, DOI: org/10.1100/2012/756357.
[6]LAROCHELLE A, BELLAVANCE M A, RIVEST S. Role of adaptor protein MyD88 in TLR-mediated preconditioning and neuroprotection after acute excitotoxicity[J]. Brain Behavior &Immunity, 2015, 46: 221-231.
[7]MIN S, JIN J J, LIM J E, et al. TLR4 mutation reduces microglial activation, increases Aβ deposits and exacerbates cognitive defi cits in a mouse model of Alzheimer’s disease[J]. J Neuroinfl ammation,2011, 8(1): 92.
[8]CHEN L, BAI Y, ZHAO M, et al. TLR4 inhibitor attenuates amyloid-β-induced angiogenic and infl ammatory factors in ARPE-19 cells: Implications for age-related macular degeneration[J]. Mol Med Rep, 2016, 13(4): 3249-3256.
[9]TANG S C, LATHIA J D, SELVARAJ P K, et al. Toll-like receptor-4 mediates neuronal apoptosis induced by amyloid beta-peptide and the membrane lipid peroxidation product 4-hydroxynonenal[J]. Exp Neurol, 2008, 213(1): 114-121.
[10]HUA F, TANG H, WANG J, et al. TAK-242, an antagonist for toll-like receptor 4, protects against acute cerebral ischemia/reperfusion injury in mice[J]. J Cereb Blood Flow Metab, 2015,35(4): 536-542.
[11]WANG Y C, WANG P F, FANG H, et al. Toll-like receptor 4 antagonist attenuates intracerebral hemorrhage-induced brain injury[J]. Stroke, 2013, 44(9): 2545-2552.
[12]FENG Y, GAO J L, CUI Y, et al. Neuroprotective effects of resatorvid against traumatic brain injury in rat: involvement of neuronal autophagy and TLR4 signaling pathway[J]. Cell Mol Neurobiol, 2017, 37(1): 155-168.
[13]FROZZA R L, HORN A P, HOPPE J B, et al. A comparative study of beta-amyloid peptides Abeta1-42 and Abeta25-35 toxicity in organotypic hippocampal slice cultures[J]. Neurochem Res, 2009,34(2): 295-303.
[14]曹梦园, 赵月鸣, 张晶, 等. 人参皂苷Rb1对Aβ25~35诱导痴呆大鼠海马神经元凋亡的影响[J]. 中国现代医学杂志,2015, 25(35): 33-36.
[15]PERI F, PIAZZA M. Therapeutic targeting of innate immunity with Toll-like receptor 4 (TLR4) antagonists[J]. Biotechnol Adv,2012, 30(1): 251-260.
[16]HE X B, JING Z Z, CHENG G F. MicroRNAs: new regulators of toll-like receptor signalling pathways[J]. Biomed Res Int, 2014,DOI: org/10.1155/2014/945169.
[17]LIU L, CHAN C. The role of inflammasome in Alzheimer’s disease[J]. Ageing Res Rev, 2014, 15: 6-15.
[18]GONG C Y, ZHOU A L, MAO J H, et al. The role of Tolllike receptor 4 on inflammation and Aβ formation in cortex astrocytes[J]. Acta Physiologica Sinica, 2014, 66(6): 631-638.
[19]RICE T W, WHEELER A P, BERNARD G R, et al. A randomized,double-blind, placebo-controlled trial of TAK-242 for the treatment of severe sepsis[J]. Crit Care Med, 2010, 38(8): 1685-1694.

