苦碟子注射液对大鼠肾脏缺血再灌注损伤的影响
杨洁,董建,李运,史国辉
(1.华北理工大学附属医院 肾内科,河北 唐山 063000;2.华北理工大学护理与康复学院,河北 唐山 063000)
肾脏缺血再灌注损伤(ischemia reperfusion injury,IRI)多发生于休克、肾移植、肾动脉重建、心肺复苏等,常常引起急性肾损伤,甚至导致急性肾功能衰竭[1]。抗氧化应激、减轻炎症损伤的机制在缺血再灌注损伤实验模型及临床急性肾损伤过程中发挥重要作用,因此,增强机体内在抗氧化应激的能力和抑制炎症因子表达、降低肾组织缺血和破坏的程度是缺血性肾损伤的预防性措施之一。
苦碟子为菊科苦卖菜属植物,具有清热解毒、活血化瘀、排脓止痛之功效。苦碟子注射液是通过提取苦碟子中腺嘌呤核苷、黄酮类、生物碱等有效成分精制而成。已有文献[2-3]报道,苦碟子对心和脑的缺血再灌注损伤具有保护作用。但是,苦碟子注射液对IRI的效应及可能机制尚不清楚,本文通过复制肾脏缺血再灌注模型,观察苦碟子注射液对IRI的影响并探讨其可能机制。
1 材料与方法
1.1 实验动物
8周龄健康雄性SD大鼠18只(华北理工大学动物中心提供),清洁级,体重230~270 g,饲料为华北理工大学动物中心提供的钴60灭菌饲料。
1.2 试剂与仪器
苦碟子注射液(悦安欣)20 ml/支(沈阳双鼎制药有限公司,批号:Z20025449),IL-6兔抗大鼠多克隆抗体(购自中杉金桥生物科技有限公司),超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒(均购自南京建成生物工程研究所),大鼠细胞间黏附分子-1(intercellular adhesion molecule,ICAM-1)酶联免疫检测试剂盒(购自上海酶联生物科技有限公司)。Benckman全自动生化仪(美国贝克曼库尔特公司),Olympus显微镜(日本奥林巴斯公司)。
1.3 分组与给药
将健康雄性SD大鼠18只随机分为假手术组(Sham组)、模型组(IRI组)、苦碟子干预组(KDZ组),每组6只。KDZ组于术前72、48、24和1 h给予苦碟子注射液(按8 ml/kg)腹腔注射共4次,其余两组同时间腹腔注射等容量生理盐水。
1.4 手术方法
术前12 h禁食水,常规备皮、消毒,10%水合氯醛(3 ml/kg)腹腔注射麻醉,仰卧固定,Sham组仅沿腹正中线开腹切除右肾,游离左侧肾脏,分离肾蒂但不夹闭,暴露45 min后关腹。IRI组、KDZ组手术操作同Sham组,仅在切除右肾和游离左肾之后,夹闭左肾动脉45 min后恢复血流灌注,以撤除血管夹后5 min内肾脏颜色由暗紫色转为红色为复制模型成功。
1.5 标本采集与检测
以上3组均在持续再灌注24 h后留取血标本及肾组织标本。取左肾后纵行切开,冷PBS液冲洗,一半置于10%多聚甲醛液中固定,另一半冰上称重后制备10%组织匀浆,离心(4 000 r/min)15 min取上清,-80℃冰箱保存;下腔静脉采血2 ml于真空采血管内,静置30 min后离心(3 000 r/min,15 min),留取血清于-80℃冰箱保存。
采用Benckman全自动生化仪测定各组大鼠肾功能指标血肌酐(serum creatinine,Scr)、血尿素氮(blood urea nitrogen,BUN);肾组织石蜡包埋后切片(4μm),进行HE染色,Olympus显微镜下观察肾组织病理学改变;采用免疫组织化学法(PV法)观察白细胞介素6(interleukin-6,IL-6)在大鼠肾组织内的表达情况;采用SOD、MDA试剂盒分别检测血浆总SOD、MDA的活性水平;ELISA酶联免疫试剂盒检测肾组织中ICAM-1含量。
1.6 统计学方法
应用SPSS17.0统计软件进行数据分析,经过正态性检验,满足正态分布,结果以均数±标准差(±s)表示,多个样本均数比较采用单因素方差分析,在组间差异有统计学意义的情况下,再采用LSD-t检验进行多重比较;非正态分布以中位数和4分位数间距[M(P25-P75)]表示,多组间比较采用Kruskal-WallisH检验,所有检验均为双侧检验,P<0.05为差异有统计学意义。
2 结果
2.1 苦碟子注射液对肾功能的影响
经H检验,Scr、BUN水平3组间比较差异有统计学意义(均χ2=15.158,P=0.001)(见表1)。根据平均秩次进一步推断,IRI组Scr和BUN水平最高,KDZ组次之,Sham组最低,表明肾脏IRI模型复制成功。
2.2 苦碟子注射液对肾组织病理形态变化的影响
经过常规脱蜡至水、苏木素染色、酒精分化、自来水蓝化、伊红染色、梯度酒精脱水,二甲苯透明、中性树胶封片等过程,光镜下观察各组大鼠肾组织HE染色显示,Sham组大鼠肾小管形态结构基本正常,管腔内仅有少量上皮细胞脱落,间质内可见少量炎症细胞浸润;与Sham组相比,IRI组肾小管上皮细胞出现空泡变性,管腔缩小甚或堵塞,其内可见脱落细胞和管型,间质水肿明显,可见大量炎症细胞浸润;KDZ组肾小管上皮细胞变性不明显,管腔内可见少量上皮细胞和管型,间质轻度水肿,可见少量炎症细胞浸润,病理损伤程度轻于IRI组。见图1。
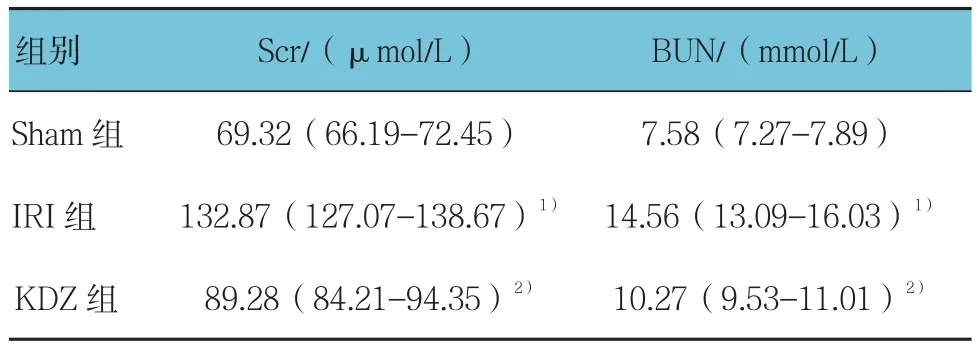
表1 苦碟子注射液对缺血再灌注大鼠Scr和BUN含量的影响 [n =6,M(P25-P75)]

图1 各组大鼠肾组织HE染色比较 (×40)
2.3 苦碟子注射液对肾组织IL-6表达的影响
经过高压修复抗原、3% H2O2孵育、滴加一抗(1∶200)过夜、二抗37℃温育、DAB显色、苏木素染色等过程,并以PBS溶液替代一抗做阴性对照,观察免疫组织化学结果,阳性结果为棕黄色颗粒,结果发现IL-6主要表达于皮髓质交界区肾小管上皮细胞胞浆,肾小球着色为阴性。Sham组少量IL-6表达,IRI组IL-6表达量较Sham组增多,KDZ组表达量较IRI组减少。见图2。
2.4 苦碟子注射液对肾组织中SOD活力、MDA含量变化的影响
分别用羟胺法与硫代巴比妥酸法检测肾组织中SOD活力、MDA含量。经单因素方差分析,SOD活力、MDA含量组间差异有统计学意义(F=84.877和15.415,均P=0.000),其中IRI组肾组织中SOD活力低于Sham组(t=-13.259,P=0.000),MDA含量高于Sham组(t=5.413,P=0.000);而KDZ组SOD活力较IRI组升高(t=5.872,P=0.000),MDA含量较IRI组降低(t=-3.005,P=0.013)。见表 2。

图2 各组大鼠肾组织IL-6表达比较 (×40)
表2 苦碟子注射液对肾组织匀浆中SOD和MDA含量影响 (n =6,±s)
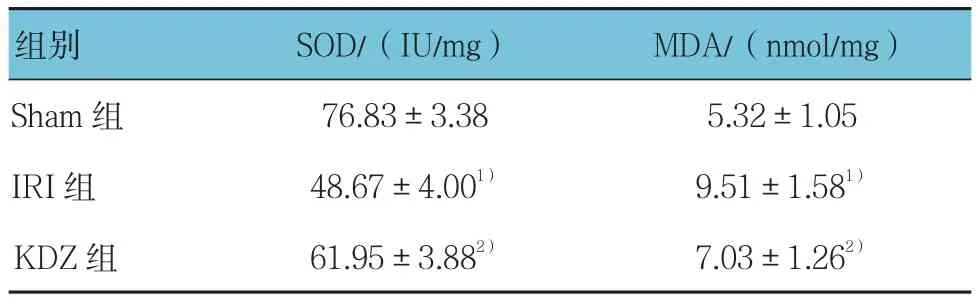
表2 苦碟子注射液对肾组织匀浆中SOD和MDA含量影响 (n =6,±s)
注:1)与Sham组比较,P <0.05;2)与IRI组比较,P <0.05
Sham 组 76.83±3.38 5.32±1.05 IRI组 48.67±4.001) 9.51±1.581)
2.5 苦碟子注射液对缺血再灌注大鼠肾组织匀浆中ICAM-1的影响
Sham组ICAM-1为(116.44±19.71)ng/L,IRI组(304.31±38.02)ng/L,KDZ 组(195.00±31.91)ng/L。经单因素方差分析,差异有统计学意义(F=56.192,P=0.000),与Sham组比较,IRI组的含量升高(t=10.747,P=0.000),和IRI组比较,KDZ组的含量降低(t=-5.395,P=0.000)。见图 3。
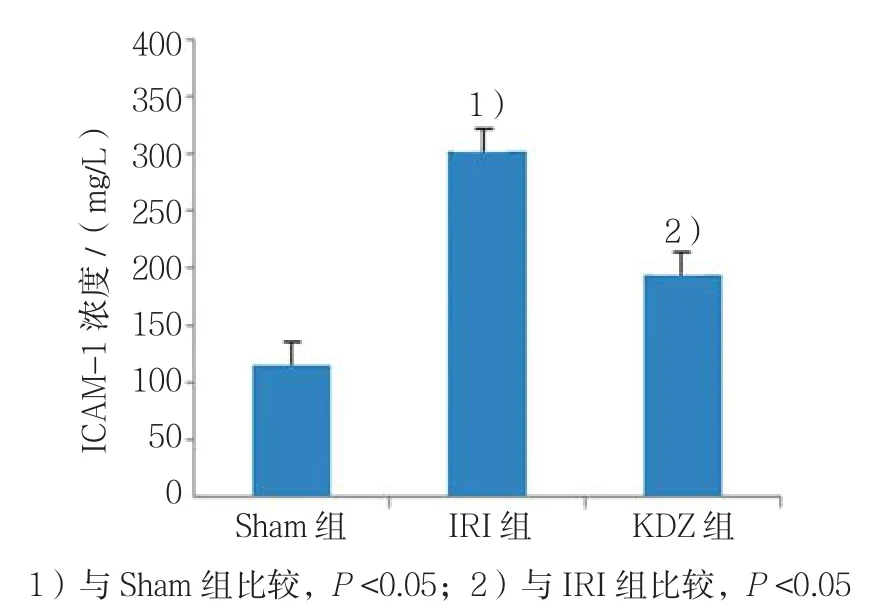
图3 苦碟子注射液对大鼠肾组织匀浆ICAM-1含量的影响
3 讨论
肾脏是血液供应较丰富的器官,当遭受手术、外伤、休克等刺激时,常常发生缺血再灌注损伤,严重者可导致急性肾功能衰竭,主要病理过程为肾细胞遭受缺血及复灌过程激活并释放过量炎症介质,产生大量氧自由基,对肾脏造成二次打击,从而加重肾脏损伤[4]。随着IRI愈发频繁,其发病机制及防治愈加引发人们关注,因此,针对缺血再灌注的早期治疗具有重要价值。
苦碟子注射液是提取苦碟子有效成分,利用现代科学技术精制而成,主要含有腺苷、黄酮类,具有扩张血管、减少炎症介质、改善微循环、平衡氧与能量代谢等作用。苦碟子注射液临床应用广泛,除了用于心脑血管外,还用于糖尿病肾病、糖尿病周围神经病变[5-6],以及治疗血管性头痛和抑制肿瘤[7-8]。动物实验研究方面,苦碟子注射液被证实能通过抗氧化应激、抑制黏附分子表达等机制对脓毒血症和横纹肌溶解所致急性肾损伤起到保护作用[9-10]。因此,笔者推测,苦碟子注射液能够通过抗氧化应激、抑制炎症因子表达从而减轻IRI。
血清Scr、BUN含量是临床上评价肾功能的常用指标之一,本研究发现IRI组与Sham组比较,血中Scr、BUN含量大幅升高,由此说明缺血再灌注模型成功复制,而KDZ组血清Scr、BUN含量均低于IRI组,提示苦碟子注射液本身不仅不会造成肾损害,还可以改善缺血再灌注损伤肾脏的肾功能情况。
氧化应激在IRI过程中发挥重要作用,氧自由基与脂性自由基性质活泼,能攻击生物膜引发脂质过氧化损伤的作用,导致细胞肿胀变形,信号转导机制失灵。有研究证实[11],氧自由基是肾脏缺血再灌注损伤的重要介质。SOD是组织产生的清除氧自由基的重要酶之一,反映机体清除氧自由基的能力,属于抗氧化指标,可以通过消除超氧阴离子从而减轻组织细胞损伤。MDA是脂质过氧化的代谢产物,凭借组织中MDA含量可以评价脂质过氧化反应的强弱。肾脏发生缺血再灌注时会消耗了肾组织中SOD,升高MDA含量。本研究表明,KDZ组与IRI组相比,肾组织匀浆中MDA含量下降,SOD含量升高,提示苦碟子注射液可以使组织抗氧化能力提高,氧化损伤程度减轻,对肾脏起到预防和保护作用。
研究表明[12],炎症反应是缺血再灌注损伤最重要机制之一,肾组织缺血后,大量炎症细胞在缺血部位聚集、浸润,促使炎症因子大量释放,从而加重肾损伤。有研究表明[13-15]IL-6、ICAM-1等炎症因子介导了损伤组织炎症细胞浸润,促进炎症反应,对缺血再灌注损伤起促进作用。ICAM-1属于免疫球蛋白超家族黏附分子,是肾脏缺血再灌注损伤所致急性肾衰竭的一个关键介质。正常情况下,在肾脏少量表达或不表达,在某些病理情况下其表达水平会出现上调。吴毅泰等[16]发现,ICAM-1在肾脏缺血再灌注后24 h表达明显,介导并参与了IRI损伤机制。本研究结果显示,ICAM-1在IRI组的含量高于Sham组,进一步证实ICAM-1参与肾脏缺血再灌注损伤。IL-6由单核/巨噬细胞、淋巴细胞产生,是具有多种功能的细胞因子。临床研究发现[17],细胞因子IL-6对IRI有加重作用。黄仁发等[18]发现IRI能够诱导IL-6产生。因此在机体发生炎症反应的过程中其可以作为炎症介质较早出现,其表达量可以评价病情严重程度和预后。本研究显示,IRI组IL-6的表达最多,KDZ组较之减少,ELISA检测ICAM-1含量结果显示,ICAM-1在IRI组的含量最多,KDZ组其含量较前者减少,Sham组含量最低,由此提示,苦碟子注射液能降低大鼠肾脏缺血再灌注损伤过程中IL-6、ICAM-1的表达,从而减轻肾脏炎症损伤。
综上所述,笔者考虑苦碟子注射液能够减轻大鼠肾脏缺血再灌注损伤,其机制可能与其抗氧化应激及减轻炎症损伤有关,希望能够为临床早期预防肾脏缺血再灌注损伤及其他脏器损伤提供新的治疗思路。
[1]BERGLER T, HOFFMANN U, BERGLER E, et al. Toll-like receptor-4 in experimental kidney transplantation:early mediator of endogenous danger signals[J]. Nephron Experimental Nephrology,2012, 121(3-4): 59-70.
[2]翟玉荣, 于小凤, 曲绍春, 等. 注射用苦碟子对心肌缺血再灌注损伤大鼠心肌酶和血粘度的影响[J]. 中药药理与临床, 2008,24(2): 53-55.
[3]陈春光, 贾洪丽, 吕首旭, 等. 苦碟子注射液对大鼠急性脑缺血-再灌注损伤的保护作用[J]. 中国临床药理学杂志, 2012, 28(3):196-199.
[4]GUZELOGLU M, YALCINKAYA F, ATMACA S, et al. The benefi cial eff ects of tadalafi l on renal ischemia-reperfusion injury in rats[J]. Urol Int, 2011, 86(2): 197-203.
[5]张数钦, 何芳, 陈赫军. 苦碟子注射液辅助治疗早期糖尿病肾病临床疗效的系统评价[J]. 中国现代应用药学, 2015, 32(6): 750-754.
[6]陈国盛, 王华, 陈平, 等. 苦碟子注射液联合弥可保治疗糖尿病周围神经病变疗效级对氧化应激的影响[J]. 亚太传统医药,2014, 10(13): 96-98.
[7]刘绍峰. 苦碟子注射液治疗血管性头痛80例[J]. 辽宁中医杂志,2011, 32(1): 59-60.
[8]柳晓琳, 金艳书. 苦碟子抗肿瘤作用的实验性研究[J]. 锦州医学院学报, 2010, 23(1): 12-15.
[9]佟苏东, 史国辉, 卢海源. 苦碟子对脓毒性急性肾损伤大鼠氧化应激反应的影响作用[J]. 陕西中医, 2013, 34(5): 618-620.
[10]崔红蕊. 甘油诱导大鼠急性肾损伤时粘附分子的表达及苦碟子干预作用的研究[D]. 石家庄: 河北医科大学, 2008.
[11]ARAUJO M, WELCH W J. Oxidative stress and nitric oxide in kidney function[J]. Curr Opin Nephrol Hypertens, 2006, 15(1):72-77.
[12]THURMAN J M. Triggers of infl ammation after renal ischemia /reperfusion[J]. Clin Immunol, 2007, 123(1): 7-13.
[13]EI-MAHDY N A, EI-SISI A E, DEWIDAR B I, et al. Histamine protects against the acute phase of experimently-induced hepatic ischemia / re-perfusion[J]. J Immunotoxicol, 2013, 10(1): 9-16.
[14]刘百成, 刘荣耀. 大鼠肾缺血再灌注损伤中ICAM-1表达的变化[J]. 中国中西医结合肾病杂志, 2006, 7(8): 419-421.
[15]王焰斌, 王小雷, 李刚, 等. 乌司他丁对深低温停循环主动脉手术患者肾缺血再灌注损伤的影响[J]. 中华麻醉学杂志,2014, 34(3): 266-269.
[16]吴毅泰, 蒋晓峰, 汤如勇, 等. 细胞粘附分子-1在大鼠肾缺血再灌注中的表达[J]. 基础医学与临床, 2003, 23(4): 423-425.
[17]BROCHNER A C, DAGNAES-HANSEN F, HOJBERG-HOLM J, et al. The inflammatory response in blood and in remote organs following acute kidney injury[J]. Acta Pathologica Microbiologica Et Immunologica Scandinavica, 2014, 122(5):399-404.
[18]黄仁发, 周巧玲, 彭卫生, 等. 肾缺血再灌注损伤后TNF-α、IL-6和MCP-1表达变化的意义[J]. 中国现代医学杂志, 2012,21(22): 13-17.

