后膜骨架蛋白1a在小鼠脑缺血再灌注损伤中的作用
杨小利,殷亚楠,胡文淼,张理斐,童丽,孙志平,程坤,王亚君
(1.河南省郑州市第三人民医院 儿科,河南 郑州 450000;2.河南省郑州市第二人民医 院 神经内科,河南 郑州 450000)
脑缺血(ischemic cerebrovascular disease,ICVD)是由于脑组织中供血不足引起的。在世界范围内,每年有超过560万人因为脑缺血而导致残疾或者死亡,严重威胁着人类健康[1]。在临床上,脑缺血是第三大危害人类健康的疾病。有研究表明,脑缺血后的4.5 h后,若对脑缺血区域进行再灌注会加重神经细胞的损害程度,这被称为脑缺血再灌注损伤[2]。由于脑缺血多是由于外界作用引起的,治疗时往往超过了4.5 h[3]。脑缺血再灌注损伤是目前研究的热点。
后膜骨架蛋白1(Homer 1)存在于中枢神经系统中,参与中枢神经系统疾病的发生和发展[4]。Homer 1具有调控胚胎脑组织发育、调控大脑学习能力等生理作用。Homer 1可以分为Homer 1a、Homer 1b、Homer 1c。Homer 1a参与调控抑郁症、癫痫等多种疾病的发生,是目前研究最多的Homer蛋白。有研究表明,Homer 1a在颅脑创伤中高表达[5]。目前尚未见Homer 1a与脑缺血再灌注损伤的相关研究。本研究复制Homer1a基因敲除小鼠脑缺血再灌注损伤模型,探讨Homer 1a在脑缺血再灌注损伤中的作用,以期为治疗脑缺血再灌注提供新思路。
1 材料与方法
1.1.1 实验动物40日龄Homer1a基因敲除小鼠10只和40日龄野生型小鼠20只购自于郑州大学动物实验中心,体重18~22g。
1.1.2 主要仪器及试剂 水浴锅(上海雷韵试验仪器制造有限公司),超净工作台(苏州施威克环保科技有限公司),PCR仪[赛飞(中国)有限公司],显微镜(上海上光新光学科技有限公司),石蜡切片机(德国LEICA公司),离心机(湖南迈达仪器有限公司),PVDF膜(美国Sigma公司),PBS( 北京鼎国生物试剂有限公司),蛋白酶K( 美国Sigma公司),IL-6单克隆抗体、IL-1β单克隆抗体、TNF-α单克隆抗体、GAPDH单克隆抗体、辣根过氧化物标记的二抗
1.1 材料
(美国CTS公司)。
1.2 方法
1.2.1 小鼠模型复制 实验分为3组,Homer1a基因敲除小鼠10只为实验组,野生型小鼠20只随机分为两组,分别为脑缺血组和对照组。所有的实验动物在构建前均禁食1 d,饮水不限制。分别用浓度为3%的异氟烷麻醉实验组和脑缺血组的小鼠,连接麻醉 器,用浓度为1%的异氟烷与一氧化二氮N2O和氧气O2混合维持麻醉。将小鼠四肢固定在手术操作板上,使小鼠仰卧,用碘消毒后,沿中线剪开皮肤,使颈部血管暴露。将血管周围组织剥离后,顺着颈总动脉找到分叉处。小心分离颈外动脉和颈内动脉。用血管夹结扎靠近心段的颈总动脉处和靠近颈总动脉分叉处的颈外动脉。颈内动脉打活结,分别牵拉颈内动脉和颈外动脉,使颈内动脉暂时性闭塞。用眼科剪在远离心端的颈总动脉处剪一个小口,插入拴线后,将拴线固定在颈内动脉活结处的备线上。缝合后,将小鼠放在37℃的环境下2 h。观察小鼠苏醒后麻醉,把拴线抽出来,用Willis环对小鼠实现动脉缺血后再灌注。对照组的小鼠不插入拴线,操作步骤同实验组和脑缺血组。
1.2.2 行为学评分 脑缺血再灌注后的各组小鼠进行行为学评分。评分标准为0~5分制。小鼠可以直线行走记为0分;小鼠对侧的前爪不能自由活动记为1分;身体无意识的向对侧转圈记为2分;小鼠的身体不自主的向一边倾斜记为3分;小鼠昏迷记为4分;小鼠死亡记为5分。行为学评分在1~3分认为脑缺血再灌注模型复制成功。
1.2.3 TTC染色计算小鼠脑梗死体积 各组小鼠脑缺血再灌注损伤后24 h,脱臼处死。放置于冰上,断头取出脑组织,洗涤后放在脑槽中,脑组织切片,每片厚度控制在1 mm左右,放在浓度为2%的TTC生理盐水中,放置于室温下摇床缓慢震荡,避光反应30 min。取出脑切片,观察脑梗死区域,分析计算脑梗死体积。
1.2.4 Tunel法检测细胞凋亡 各组小鼠脑缺血再灌注损伤后24 h,常规方法制作脑组织石蜡切片。分别将石蜡切片放置于二甲苯中浸泡15 min。在95%、90%和80%浓度 的酒精中浸泡3 min。用PBS洗涤3次,5 min/次,放置于浓度为30%的过氧化氢H2O2溶液中浸润20 min。用PBS洗涤3次,5 min/次,加入蛋白酶K放置于37℃孵育40 min,加入PBS洗涤3次,5 min/次。取适量Tunel染液于切片上,放置于37℃孵育60 min。用PBS洗涤3次,5 min/次。滴加丙三醇C3H8O3封片,放置在显微镜下观察细胞凋亡情况。随机选取5个视野,计算细胞凋亡情况。
1.2.5 GFAP法检测星形胶质细胞 小鼠脑组织切片脱蜡止水后,放置于柠檬酸高压锅内,沸水煮沸60 s,放置于修复液40 s,小心滴加抗体后,用PBS洗涤3次×5 min,加入过氧化物后放在避光处室温孵育20 min,PBS洗涤后,滴加驴血清放置于室温下封闭50 min。加入以1︰100稀释的一抗在4℃孵育过夜,加入荧光素酶标记的二抗,在室温条件下孵育60 min,加入PBS洗涤后,加入HOECHST溶液,孵育10 min,丙三醇封片。显微镜下观察星形胶质细胞,随机选取5个视野计数星形胶质细胞数量。
1.2.6 Western blot检测IL-1β、TNF-α、IL-6表达水平 各组中小鼠脑缺血再灌注后24 h,取出小鼠脑组织,用剪刀剪碎后放在匀浆器中,取适量的裂解液加入到匀浆器后,在冰上研磨。将研磨的组织液转移到EP管中,4℃,10 000 r/min离心10 min。转移蛋白上清液至新的EP管中,根据BCA蛋白浓度检测试剂盒操作步骤检测提取的蛋白浓度。将蛋白与loading buffer充分混合后,放在100℃中煮沸5 min使蛋白充分变性。取50μl变性蛋白加入到上样孔中,80 V电压电泳30 min后,调整电压为120 V至电泳结束。取出蛋白凝胶在自来水下小心冲洗后,按照常规方法4℃转膜。PVDF膜用5%脱脂奶粉封闭后,分别依次与一抗二抗孵育,PBST洗涤后,加入显色液,在暗室中曝光,拍照,分析蛋白表达含量。
1.3 统计学方法
采用SPSS 22.0软件进行数据分析,计量资料均采用均数±标准差(±s)表示,计量资料3组数据的比较采用方差分析,在方差分析有意义的基础上,再采用LSD-t检验两两比较,P<0.05为差异有统计学意义。
2 结果
2.1 行为学评分结果
实验组、脑缺血组、对照组中小鼠脑缺血再灌注损伤后24 h,根据行为学评分标准进行评分,评分越高说明小鼠脑缺血再灌注损伤越严重。结果显示,正常组评分<1,脑缺血组和实验组小鼠行为学评分在介于1~3之间,说明成功复制了脑缺血再灌注小鼠模型。实验组小鼠行为学评分高于脑缺血组,说明Homer1a基因敲除小鼠脑缺血再灌注损伤较脑缺血组更为严重。见图1。
2.2 各组脑梗死情况
各组小鼠脑缺血再灌注损伤后24 h,取出脑组织,切片后,TTC染色观察小鼠脑梗死情况。结果显示:实验组与脑缺血组比较,差异有统计学意义(P<0.05),实验组小鼠脑梗死体积较脑缺血组增多;实验组和脑缺血组与正常组比较,差异有统计学意义(P<0.05),实验组与脑缺血组小鼠脑梗死体积较正常组增多。见图2。
2.3 各组细胞凋亡情况
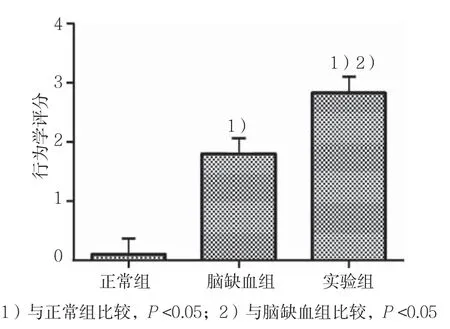
图1 脑缺血再灌注小鼠行为学评分结果

图2 脑缺血再灌注小鼠中脑梗死体积百分比
各组小鼠脑缺血再灌注损伤后24 h,取出脑组织,切片后,Tunel法检测细胞凋亡结果。结果显示:实验组与脑缺血组比较,差异有统计学意义(P<0.05),实验组小鼠脑组织细胞凋亡情况高于脑缺血组;实验组和脑缺血组与正常组比较,差异有统计学意义(P<0.05),实验组与脑缺血组小鼠脑组织中细胞凋亡情况多于正常组。见图3。

图3 脑缺血再灌注小鼠脑组织中细胞凋亡情况
2.4 星形胶质细胞检测结果
脑缺血再灌注损伤会引发星型胶质细胞的增生和活化,进而产生GFAP蛋白,本研究中脑组织切片与GFAP蛋白一抗和二抗孵育后,在显微镜下观察GFAP阳性细胞数即为星形胶质细胞数量。结果显示:实验组和脑缺血组分别与正常组比较,差异有统计学意义(P<0.05),实验组和脑缺血组小鼠脑组织中星形胶质细胞数都高于正常组,而实验组小鼠脑组织中星型胶质细胞数量低于脑缺血组,这可能与Homer 1a蛋白和星形胶质细胞膜受体相互作用有关。见图4。
2.5 各组IL-1β、TNF-α、IL-6表达
各组中小鼠脑缺血再灌注后24 h,取出小鼠脑组织,经蛋白提取,Western blot检测细胞中IL-1β、TNF-α、IL-6表达。结果显示,实验组小鼠脑组织中IL-1β、TNF-α、IL-6表达水平与脑缺血组相比,差异有统计学意义(P<0.05),实验组高于脑缺血组;实验组和脑缺血组小鼠脑组织中IL-1β、TNF-α、IL-6表达水平与正常组比较,差异有统计学意义(P<0.05),实验组与脑缺血组均高于正常组。见图5。
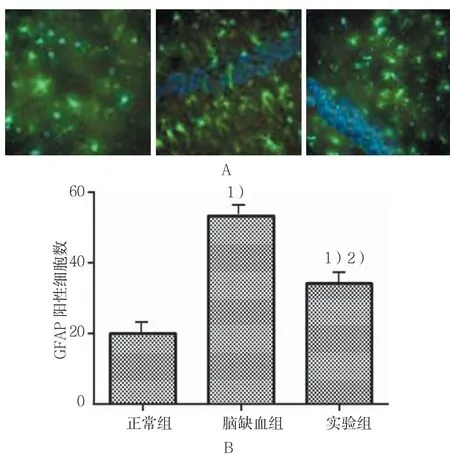
图4 各组星型胶质细胞数结果
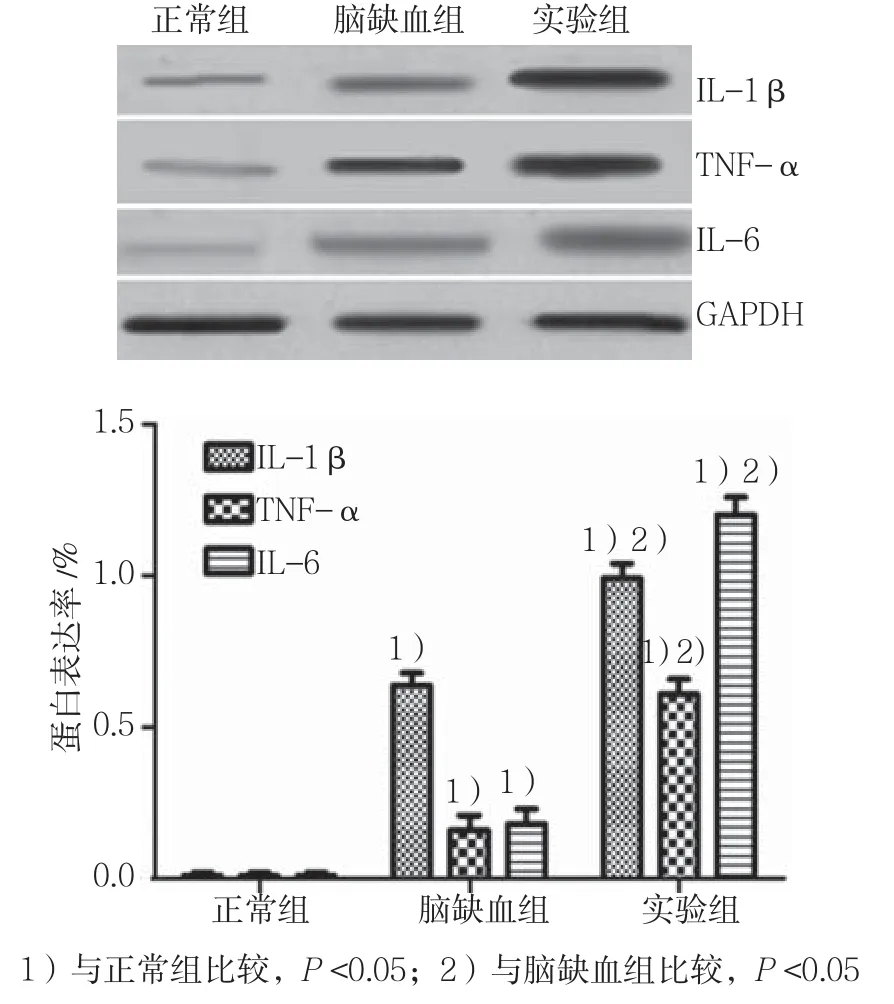
图5 脑缺血再灌注小鼠中IL-1β、TNF-α、IL-6的表达
3 讨论
脑缺血是一种临床上常见的疾病。高血压、高血脂、动脉粥样硬化、应激、外力刺激等都可以引起脑缺血的发生[6]。脑缺血死亡率极高,是一种严重危害人类生命健康的疾病。Homer是一种广泛存在于哺乳动物脑组织中的支架蛋白。Homer蛋白参与调控多种信号通路,在突触的发育过程中具有重要作用[7-8]。Homer蛋白在精神分裂、智力发育、创伤性脑损伤、阿尔茨海默病、脑胶质瘤、癫痫等多种中枢神经系统疾病中发挥重要作用[9]。Homer 1a属于Homer蛋白家族中的一员。已经有研究表明,神经元细胞受到机械损伤时,Homer 1a表达上调,与代谢性谷氨酸受体作用后,对神经元细胞具有一定的保护作用[10-11]。
当发生脑缺血再灌注损伤后,细胞凋亡和细胞坏死是细胞死亡的2种方式。细胞凋亡主要发生在损伤程度较轻的区域,这些区域细胞缺血的时间较短[12-13]。而细胞坏死则发生在损伤程度较为严重的区域,这些区域细胞缺血时间较长,属于缺血的核心区域[14]。本研究中,用TTC和Tunel法分别检测了脑缺血再灌注小鼠脑组织中脑梗死情况和细胞凋亡情况。结果显示,实验组小鼠脑梗死体积和细胞凋亡数目较脑缺血组明显增多,这提示,Homer1a基因敲除小鼠细胞脑缺血再灌注损伤程度较为严重。Western blot检测脑缺血再灌注小鼠脑组织中炎症因子IL-1β、TNF-α、IL-6表达均高于正常组,而基因敲除小鼠中炎症因子的表达量高于单纯脑缺血再灌注组,进一步说明了缺失Homer1a基因,会加重脑缺血再灌注损伤。
神经胶质细胞和神经元细胞是脑组织中数量最多的细胞,而神经胶质细胞具有给神经元细胞提供营养的作用[15]。星形胶质细胞的数量占神经胶质细胞的50%,是脑缺血再灌注损伤中最早受到影响的细胞。研究表明,星形胶质细胞产生的具有抗氧化作用的谷胱甘肽可以调控谷氨酸的摄取和释放[16],从而促进红细胞生成素的合成。另外星形胶质细胞还可以作用于水通道蛋白,对钙离子兴奋性、神经信号的整合、神经元的桥接等发挥抑制作用[17-18]。兴奋性氨基酸谷氨酸的异常增多,会对神经元产生兴奋性毒性,损害神经元细胞。另一方面,星形胶质细胞可以通过调节钠离子通道调控谷氨酸转运体,作用于谷氨酸的重新摄取,减轻了谷氨酸引起的兴奋性毒性[19-20]。本研究中,脑缺血再灌注小鼠中星形胶质细胞的数量多于正常组,而基因敲除后的脑缺血再灌注小鼠脑组织中星形胶质细胞增生和活化数目较单纯脑缺血再灌注小鼠明显降低,这提示,Homer1a基因敲除后对星形胶质细胞的活化和增生具有一定的抑制作用。这可能与Homer 1a蛋白调控谷氨酸受体有关。谷氨酸受体在脑缺血再灌注的星形胶质细胞中高表达,而谷氨酸受体又与星形胶质细胞的凋亡有关。Homer 1a在这一系列过程中具有连接作用,导致Homer 1a蛋白和谷氨酸受体之间的平衡失调,抑制了星形胶质细胞的凋亡。
综上所述,本研究成功复制了脑缺血再灌注小鼠模型,Homer1a基因敲除加重脑缺血再灌注损伤。Homer 1a对脑缺血再灌注损伤具有保护作用。这为进一步研究脑缺血再灌注损伤奠定了基础。
[1]CELIKBILEK A, ISMAILOGULLARI S, ZARARSIZ G.Neutrophil to lymphocyte ratio predicts poor prognosis in ischemic cerebrovascular disease[J]. Jou rnal of Clinical Laboratory Analysis,2014, 28(1): 27-31.
[2]ZHANG H, YANG L, FENG Q, et al. Association Between VKORC1, Gene polymorphisms and ischemic cerebrovascular disease in chinese han population[J]. Journal of Molecular Neuroscience, 2014, 53(2): 166-170.
[3]CHI O Z, BARSOUM S, KANG H R, et al. Local O2, Balance in cerebral ischemia–reperfusion improved during pentobarbital compared with isoflurane anesthesia[J]. Journal of Stroke &Cerebrovascular Diseases the Offi cial Journal of National Stroke Association, 2015, 24(6): 1196-1203.
[4]WANG Q, CHIKINA M D, PINCAS H, et al. Homerla lternative splicing is regulated by gonadotropin-releasing hormone and modulates gonadotropin gene expression[J]. Molecular & Cellular Biology, 2014, 34(10): 1747-1756.
[5]TANG A H, ALGER B E. Homer protein-metabotropic glutamate receptor binding regulates endocannabinoid signaling and aff ects hyperexcitability in a mouse model of fragile X syndrome[J].Journal of Neuroscience, the Official Journal of the Society for Neuroscience, 2015, 35(9): 3938-3945.
[6]王振富, 杨付明. 黄芪多糖对大鼠全脑缺血再灌注损伤的保护作用[J]. 中国老年学杂志, 2016, 36(05): 1059-1060.
[7]BANERJEE A, LUONG J A, HO A, et al. Overexpression of Homer1a in the basal and lateral amygdala impairs fear conditioning and induces an autism-like social impairment[J].Molecular Autism, 2016, 7(1): 1-15.
[8]苏敬敬, 陶晓晓, 舒良, 等. Homer1b/c在缺氧复氧损伤神经元中的保护作用研究[J]. 现代生物医学进展, 2015, 15(19): 3605-3608.
[9]RUEGSEGGER C, STUCKI D M, STEINER S, et al. Impaired mTORC 1-dependent expression of homer-3 influences SCA1 pathophysiology[J]. Neuron, 2016, 89(1): 129-146.
[10]GUO W, MOLINARO G, COLLINS K A, et al. Selective disruption of metabotropic glutamate receptor 5-homer interactions mimics phenotypes of fragile X syndrome in mice[J].Journal of Neuroscience the Official Journal of the Society for Neuroscience, 2016, 36(7): 2131-2147.
[11]BEEN L E, MOORE K M, KENNEDY B C, et al. Metabotropic glutamate receptor and fragile X signaling in a female model of escalated aggression[J]. Biological Psychiatry, 2015, 79(8): 685-692.
[12]褚立梅, 杨光辉, 董丽娟, 等. 右美托咪定对大鼠移植肝缺血/再灌注所致急性肺损伤中细胞凋亡及CCAAT增强子结合蛋白同源蛋白的影响[J]. 中国中西医结合急救杂志, 2015,22(3): 262-266.
[13]戴勇, 陶立德, 薛同敏,等. 缺血预处理对大鼠肝脏缺血再灌注损伤后细胞凋亡的影响[J]. 中国现代普通外科进展, 2015,18(03): 169-172.
[14]ZHAO S D, CHEN Y, DONG Y F, et al. Effects of soybean isofl avones on apoptosis of rat hippocampal neurons after global cerebral ischemia/reperfusion[J]. Journal of Shanghai Jiaotong University, 2015, 35(4): 521-529.
[15]KABOURIDIS P, LASRADO R, MCCALLUM S, et al.Microbiota controls the homeostasis of glial cells in the gut lamina propria[J]. Neuron, 2015, 85(2): 289-295.
[16]APOSTOLOVA N, FUNES H A, BLASGARCIA A, et al.Involvement of nitric oxide in the mitochondrial action of efavirenz: a differential effect on neurons and glial cells[J].Journal of Infectious Diseases, 2015, 211(12): 1953-1958.
[17]LUO X, HE J J. Cell–cell contact viral transfer contributes to HIV infection and persistence in astrocytes[J]. Journal of Neurovirology, 2015, 21(1): 66-80.
[18]GABEL S, KONCINA E, DORBAN G, et al. Inflammation promotes a conversion of astrocytes into neural progenitor cells via NF-κB activation[J]. Molecular Neurobiology, 2015, 17(7):1-15.
[19]VIADER A, BLANKMAN J, ZHONG P, et al. Metabolic interplay between astrocytes and neurons regulates endocannabinoid action[J]. Cell Reports, 2015, 12(5): 798-808.
[20]IRAM T, RAMIREZ-ORTIZ Z, BYRNE M H, et al. Megf10 is a receptor for C1Q that mediates clearance of apoptotic cells by astrocytes[J]. Journal of Neuroscience the Offi cial Journal of the Society for Neuroscience, 2016, 36(19): 5185-5192.

