三氯生的体外遗传毒性评价
曹易懿,奚 晶,唐伟锋,尤馨悦,刘维映,栾洋,*
(1.上海交通大学医学院虹桥国际医学研究院/公共卫生学院,上海 200025;2.上海大学环境与化学工程学院,环境污染与健康研究所,上海200444)
三氯生(triclosan,TCS)因其具有广谱高效的抗菌作用,自1968年以来被广泛用于医疗消毒和肥皂、除臭剂、牙膏等个人护理品和家居用品中[1-3]。个人护理品中添加的TCS能够随生活污水的排放进入自然环境,并可在环境中蓄积[4],TCS被认为是一类新型的环境污染物。有报道显示在生活污水中可检测到的TCS达100~1 000 ng/L,而且在地表水、饮用水和室内尘土中亦检测到一定浓度的TCS,在我国河流的水体和沉积物中TCS具有较高的检出率,水体中最大浓度达到每升数百纳克,沉积物中最大浓度达到每克数微克[5-6]。
环境中的TCS可通过直接和间接的方式进入生物体内,已有研究报道在人体的血清/血浆、尿液、大脑、肝脏及脂肪组织内可检测到TCS[7]。前期的一些研究表明长期使用含TCS的产品不会对人类健康造成影响,但近年来研究表明TCS具有内分泌干扰作用、生殖发育毒性和潜在的致癌风险[8-13]。因此,TCS对人类健康的影响已经引起了全球范围的广泛关注。
欧美各国已经逐步限制TCS在各类产品中的使用[14],其中德国在2009年禁止TCS在食品相关材料中的使用。但我国目前对TCS尚未禁用,仍是TCS的生产和消耗大国。近年来仅在一些特定应用领域给予了限量要求,例如,在2009年实施的牙膏用原料规范的国家标准(GB 22115-2008)中,首次规定了TCS含量不得超过0.3%[15]。 目前,TCS的致癌实验数据不充分[16],毒性机制尚未完全阐明,因此我们选择采用可检测DNA损伤的体外彗星试验,考察染色体异常的体外微核试验以及可检测基因突变的Ames试验进行有效地组合,评价TCS的体外遗传毒性,探讨毒性作用机制,为TCS毒性的防治提供理论依据。
1 材料与方法
1.1 菌株来源及遗传特性鉴定
TK6细胞和鼠伤寒沙门氏菌TA98、TA100和YG7108(Ogt-/ Ada-)菌株均由日本国立卫生研究所赠送。鼠伤寒沙门氏菌遗传特性鉴定要求包括:组氨酸营养缺陷型;脂多糖屏障缺陷;紫外线修复缺损;菌株具有R因子,带有pKM101质粒,具有抗氨苄青霉素作用;菌株不带有pAQ1质粒,不具有抗四环素作用。对鉴定合格并且自发突变数符合要求的菌株进行增菌,作为实验菌株。
1.2 受试物
三氯生,CAS号3380-34-5,购自美国Sigma-Aldrich公司。
1.3 阳性对照品
喜树碱(camptothecin,CPT),CAS号7689-03-4,购自梯希爱(TCI,上海)化成工业发展有限公司,终浓度20 μmol/L。丝裂霉素C(mitomycin C,MMC),CAS号50-07-7,购自Roche公司,终浓度0.5 μg/mL。TA98菌株阳性对照采用2-硝基芴(2-nitrofluorene,2-NF),CAS号607-57-8,终浓度20 μg/皿;TA100和YG7108菌株阳性对照采用甲磺酸甲酯(methyl methanesulfonate,MMS),CAS号66-27-3,终浓度分别为13 000和200 μg/皿。2-NF和MMS均购自Sigma-Aldrich公司。
1.4 细胞培养和给药处理
TK6细胞用含10%马血清(Gibco公司,货号16050-122)的 RPMI-1640(Corning公司,货号10-040-CVR)培养基于37 ℃、CO2体积分数为5%的培养箱中培养,培养至对数增殖期后使用。使用二甲亚砜(DMSO,CAS号67-68-5,购自Sigma-Aldrich公司)配制不同浓度的TCS,DMSO在细胞培养液中的终浓度为0.5%(V/V)。通过预试验选择产生合适的细胞毒性剂量进行实验,选择的毒性剂量尽量覆盖到较高细胞毒性剂量(产生55%±5%的细胞毒性)到无细胞毒性或者低细胞毒性剂量。调整细胞浓度为约2.0×105/mL,加入不同浓度的TCS,使每组终浓度分别为3.5、8.8、17.5、26.3和35 μmol/L,同时设阴性对照组(加入0.5%的DMSO)和阳性对照组CPT 20 μmol/L(彗星试验)或MMC 0.5 μg/mL(微核试验),每个剂量2个复孔。
每个复孔加药处理细胞5 mL,每个浓度分别取2.5 mL加在6孔细胞培养板内,共2块,一块用于彗星试验,另一块用于微核试验。在用于微核试验的6孔细胞培养板内加入细胞松弛素B(cytochalasin B),终浓度为3 μg/mL,与TCS共同处理TK6细胞24 h。
1.5 体外碱性彗星试验
给药处理24 h后,离心除去培养液。然后用HBSS/EDTA缓冲液清洗1次。在载玻片上制备胶体,先用1%的常熔点琼脂糖凝胶铺第一层胶,待凝固后,将混合均匀的细胞悬液与0.7%的低熔点琼脂糖凝胶铺在第一层胶上,凝固后在4 ℃下裂解1.5 h。裂解完毕后转移至碱性电泳缓冲液中,静置40 min后在300 mA下电泳20 min。电泳完毕后,用0.4 mol/L Tris-HCl中和,无水乙醇脱水,干燥后用1 μg/mL的DAPI染色10 min,在荧光显微镜下观察细胞形成的DNA彗星拖尾情况,用专业软件COMET IV(Perceptive Instruments,Version 4 .3)实时图像测定系统进行分析,每个剂量组分析100个细胞图像(每个复孔分析50个,2个复孔合计分析100个),测定彗星的尾长、尾部DNA强度和尾矩。
1.6 体外胞质分裂阻滞微核细胞组学试验
给药处理24 h后,离心除去培养液。加入0.075 mol/L KCl低渗5 min,然后加预冷的固定液(甲醇∶冰醋酸=3∶1)混匀,离心弃上清。加入固定液固定15 min后离心(重复1次),弃上清(留适量液体),重悬混匀后滴片。待自然干燥后,用PBS配制10% Giemsa染色15 min,冲洗,晾干。显微镜观察标本:①每个剂量组计数500个细胞(每个复孔的标本计数250个,2个复孔合计500个),分别计数单核、双核、三核和四核的细胞数,用于计算各剂量产生的细胞毒性。根据经济合作与发展组织(Organisation for Economic Co-operation and Development,OECD)指导原则[17]中的公式计算胞质分裂阻滞增殖指数(cytokinesis-block proliferation index,CBPI)如下。②每个剂量组计数2 000个双核细胞中(每个复孔计数1 000个,2个复孔合计2 000个)出现Ⅰ型微核、Ⅱ型微核、核质桥及核芽的细胞数,分别计算其发生频率。核质桥及核芽的界定标准参照文献[18]的方法。微核直径小于主核的1/4为I型微核;直径为主核的1/4~1/2为II型微核[19]。
CBPI指数=(单核细胞数+2×双核细胞数+3×多核细胞数)/总细胞数

1.7 Ames试验
使用DMSO配制不同浓度的TCS。实验设定0.000 5、0.001 67、0.005、0.016 7、0.05、0.167、0.5和1.67 μg/皿共8个剂量组,同时设定阴性对照组(每块平皿加入100 μL DMSO)和阳性对照组,每个剂量3块培养皿。将TA98、TA100和YG7108菌株接种在营养肉汤培养基中,在37 ℃恒温水浴摇床过夜进行扩增。取100 μL的TCS受试物药液、100 μL菌液、0.5 mL PBS和2.0 m L的顶层培养基于试管中,振荡混匀后铺于底层培养基。37 ℃恒温培养箱培养2~3 d取出培养皿,用肉眼观察回复突变菌落进行计数;观察背景菌斑,考察各剂量TCS对菌株的细菌毒性。毒性表现:①背景菌斑与阴性对照相比若减少或消失;②测试组的回复突变菌落数与阴性对照相比明显下降或有剂量依赖性减少。
1.8 统计学方法
彗星试验测定的尾长、尾部DNA强度和尾矩的数据采用Graph Pad Prism 5.0进行非参数Kruskal-Wallis检验,并用Dunn’s Multiple Comparison Test进行组间检验,若P<0.05则用Spearman进行相关性分析,计算r值与P值。微核试验采用泊松分布进行检验。Ames试验结果,用Excel 2017计算回复突变菌落数的和s。并按以下标准进行判定:①所有测试组的回复突变菌落数小于阴性对照组2倍,判为阴性。②任何测试组的回复突变菌落数大于阴性对照组4倍,且结果基本具有再现性,则判为阳性。③若测试组最大效应组为阴性对照2~4倍之间,则作进一步分析。供试品所诱发的回复突变菌落数出现浓度依赖性的增加或在多个浓度组上出现可重复性的增加,可判断阳性。进行Dunnett’ t-t检验后,仍无显著意义,则可判为阴性。
2 结果
2.1 体外碱性彗星试验结果
见表1。结果表明:TCS的各个剂量组与阴性对照组相比,均能引起TK6细胞彗星的尾长、尾部DNA强度和尾矩的增加,差异具有统计学意义(P<0.01),且尾部DNA强度呈现剂量效应关系(r=0.943,P=0.017),表明TCS能显著引起TK6细胞DNA损伤,且随着暴露剂量的增加而增强。

表1 不同剂量三氯生处理后的体外碱性彗星试验结果(-x±s)
2.2 体外胞质阻滞微核细胞组学试验结果
见表2。结果表明:TCS在35.0 μmol/L剂量下对TK6细胞产生较高的细胞毒性(80.5%),抑制TK6细胞生长;TCS在各剂量下均未引起TK6细胞的微核率、核质桥率和核芽率升高(P均>0.05)。
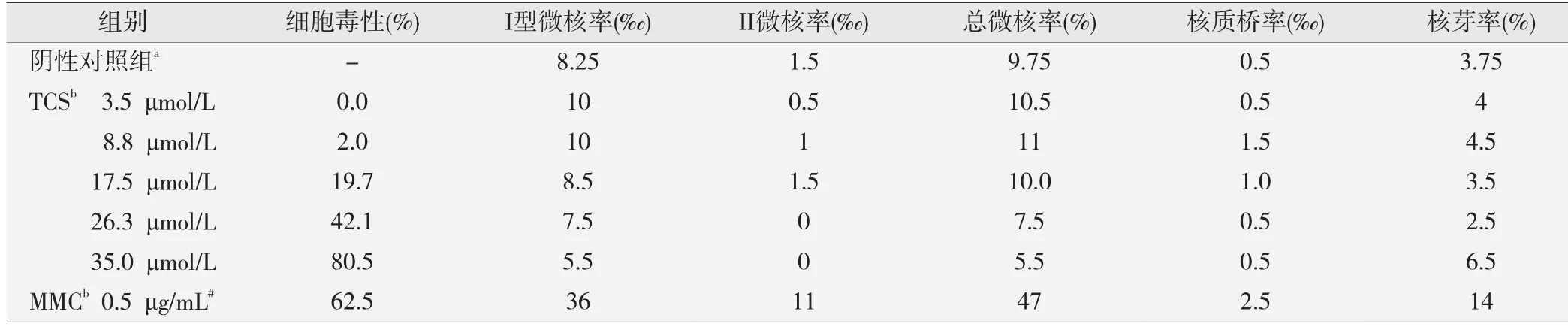
表2 不同剂量三氯生处理后的体外胞质阻滞微核细胞组学试验结果
2.3 Ames试验结果
见表3。结果表明:TCS在≥0.167 μg/皿剂量下产生对TA98和YG7108菌株严重的细菌毒性,背景菌斑消失,且抑制菌株的生长,同时对TA100菌株产生一定的细菌毒性,背景菌斑明显减少且回复突变菌落数减少约60%。TCS在各剂量下均未引起TA98、TA100和YG7108菌株的回复突变菌落数增加(P>0.05),且未呈现剂量依赖性升高趋势。实验结果表明TCS对3株菌株不具有致突变作用。13 000和200 μg/皿.
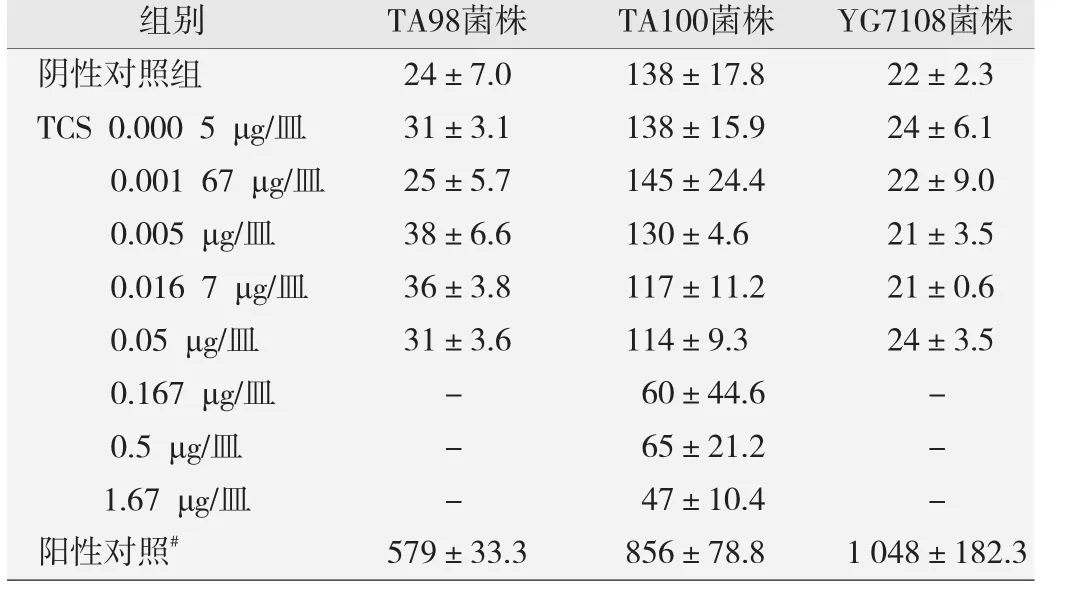
表3 不同剂量三氯生作用后的Ames试验结果
3 讨论
本实验体外碱性彗星试验结果显示TCS能显著引起TK6细胞DNA损伤,且随着暴露剂量增加而增强。近年来TCS对DNA的损伤效应逐渐引起关注,现有研究显示TCS能引起人肝L02细胞的DNA损伤,与本实验结果基本一致[20]。由于TCS能在土壤和水环境中蓄积,已有不少关于TCS在环境毒理方面的研究,如水生生物的彗星试验结果表明TCS能引起斑马贻贝和虹鳟鱼的血细胞DNA损伤[21-22];此外TCS还能引起蚯蚓DNA的损伤[23],导致金鱼的DNA损伤和外周血细胞微核率的升高[24];以及可抑制水生植物藻类的生长并且可致DNA损伤[25]。TCS作用哺乳动物细胞(BHK-21、Vero和KB细胞)的彗星试验显示TCS在IC20-30的剂量下作用5 d后能观察到显著的DNA损伤效应。
由于DNA损伤效应与细胞毒性相关,较高的细胞毒性会引起假阳性结果。因此,本实验采用组合试验体系,用同一批细胞给药后同时进行体外碱性彗星试验和体外胞质分裂阻滞微核细胞组学试验,通过体外微核试验中的CBPI指数测定各剂量组的细胞毒性,用以判断是否是过高的细胞毒性导致实验出现假阳性结果。本实验结果显示,TCS仅在35.0 μmol/L剂量下对TK6细胞产生较高的细胞毒性(80.5%),其余剂量均小于50%的细胞毒性,表明TCS在3.5、8.8、17.5和26.3 μmol/L剂量下引起的DNA损伤不是由于过高的细胞毒性导致的细胞死亡/凋亡所致。
本实验选择体外胞质分裂阻滞微核细胞组学试验是近年逐渐发展完善起来的可考察多个遗传毒性终点的检测方法,通过观察特征性的细胞染色体损伤的类型进行判别[26]:①微核,为染色体损伤的标志,并且可根据微核的大小分为I型微核(为染色体断裂的标志)和II型微核(为非整倍体畸变的标志);②核质桥,为DNA错误修复、染色体重组或端粒末端融合的标志;③核芽,为基因扩增和/或基因量改变的标志。本实验结果显示TCS在各剂量下均未引起TK6细胞的微核率、核质桥率和核芽率升高,表明TCS未对TK6细胞染色体造成损伤,其毒性作用可能主要是引起细胞DNA损伤。
此外,我们除了使用经典Ames试验中的鼠伤寒沙门氏菌TA98和TA100菌株外,还采用了DNA修复酶缺陷型YG7108(Ogt-/ Ada-)菌株对TCS进行致突变作用的评价。鼠伤寒沙门氏菌有两种烷基转移机制,一种为组成型,表达O6-烷基鸟嘌呤-DNA烷基转移酶(Ogt);另一种是可诱导达O6-烷基鸟嘌呤转移酶I(Ada),因此DNA修复酶缺陷型的YG7108(Ogt-/ Ada-)对检测烷化剂非常敏感,能在受试物较低的浓度下检测出是否具有致突变作用[27]。TCS为广谱抗菌剂,所以通常采用Ames试验评价受试物的上限参考浓度(5 000 μg/皿)不适用于本实验。我们根据TCS对鼠伤寒沙门氏菌的细菌毒性设定合理的剂量,发现TCS在较低的纳克级浓度下对本实验3株菌株仍不具有致突变作用。
目前TCS的毒性研究机制尚未完全阐明,缺乏有效的安全性评价的科学依据。由于三氯生能长期在环境中蓄积,并且它是致癌物二噁英、氯仿等形成的来源之一,2017年的佛罗伦萨申明呼吁国际社会限制生产和使用TCS,并建议政府职能部门、制造商和消费者采取相应行动[14]。我们通过体外实验组合体系考察了TCS的遗传毒性,希望能为进一步研究TCS的毒性机制提供依据,从而进一步探讨TCS致癌机制。目前有报道认为TCS的致癌性是由其内分泌干扰作用所致,认为其是一类雌激素内分泌干扰物质,可能影响前列腺癌的发展[28-29]。综合本研究中的3个实验结果,我们认为TCS主要是引起细胞DNA损伤,但对Ames试验菌株不具致突变作用。由于TCS具有广谱抗菌的作用,因此需要进一步在细胞水平和整体动物水平考察TCS的毒性作用,进而综合判别TCS属于遗传毒性致癌物,还是属于表观遗传毒性致癌物。
[1] BEDOUX G,ROIG B,THOMAS O,et al. Occurrence and toxicity of antimicrobial triclosan and by-products in the environment[J]. Environ Sci Pollut Res Int, 2012, 19(4):1044-1065.
[2] JONES R D, JAMPANI H B, NEWMAN J L, et al.Triclosan:a review of effectiveness and safety in health care settings[J]. Am J Infect Control,2000,28(2):184-196.
[3] PICCOLI A,FIORI J,ANDRISANO V,et al. Determination of triclosan in personal health care products by liquid chromatography (HPLC)[J]. Farmaco,2002,57(5):369-372.
[4] HALDEN R U. On the need and speed of regulating triclosan and triclocarban in the United States[J]. Environ Sci Technol,2014,48(7):3603-3611.
[5] PADHYE L P,YAO H,KUNG'U F T,et al. Year-long evaluation on the occurrence and fate of pharmaceuticals,personal care products,and endocrine disrupting chemicals in an urban drinking water treatment plant[J]. Water Res,2014,51:266-276.
[6] LI X,YING G G,SU H C,et al. Simultaneous determination and assessment of 4-nonylphenol,bisphenol A and triclosan in tap water, bottled water and baby bottles[J]. Environ Int,2010,36(6):557-562.
[7] GEENS T,NEELS H,COVACI A. Distribution of bisphenol-A,triclosan and n-nonylphenol in human adipose tissue,liver and brain[J]. Chemosphere,2012,87(7):796-802.
[8] ORVOS D R,VERSTEEG D J,INAUEN J,et al. Aquatic toxicity of triclosan[J]. Environ Toxicol Chem,2002,21(7):1338-1349.
[9] ISHIBASHI H,MATSUMURA N,HIRANO M,et al. Effects of triclosan on the early life stages and reproduction of medaka Oryzias latipes and induction of hepatic vitellogenin[J]. Aquat Toxicol,2004,67(2):167-179.
[10] OLIVEIRA R,DOMINGUES I,KOPPE GRISOLIA C,et al.Effects of triclosan on zebrafish early-life stages and adults[J].Environ Sci Pollut Res Int,2009,16(6):679-688.
[11] RODRICKS J V,SWENBERG J A,BORZELLECA J F,et al.Triclosan:a critical review of the experimental data and development of margins of safety for consumer products[J]. Crit Rev Toxicol,2010,40(5):422-484.
[12] KUMAR V,CHAKRABORTY A,KURAL M R,et al.Alteration of testicular steroidogenesis and histopathology of reproductive system in male rats treated with triclosan[J]. Reprod Toxicol,2009,27(2):177-185.
[13] DESALVA S J,KONG B M,LIN Y J. Triclosan:a safety profile[J]. Am J Dent,1989,2:185-196.
[14] HALDEN R U,LINDEMAN A E,AIELLO A E,et al. The Florence statement on triclosan and triclocarban[J]. Environ Health Perspect,2017,125(6):064501.
[15] 中华人民共和国国家质量监督检验检疫总局.GB 22115-2008. 牙膏用原料规范[S]. 北京:中国标准出版社,2009.
[16] Nomination Profile Triclosan [CAS 3380-34-5]. Supporting Information for Toxicological Evaluation by the National Toxicology Program [EB/OL]. [2008-08]. https://ntp.niehs.nih.gov/.
[17] OECD guideline for the testing of chemicals. TG487:In Vitro Mammalian Cell Micronucleus Test[EB/OL]. [2016-07-29].http://www.oecd-ilibrary.org.
[18] FENECH M. Cytokinesis-block micronucleus cytome assay[J].Nat Protoc,2007,2(5):1084-1104.
[19] HASHIMOTO K,NAKAJIMA Y,MATSUMURA S,et al. An in vitro micronucleus assay with size-classified micronucleus counting to discriminate aneugens from clastogens[J]. Toxicol In Vitro,2010,24(1):208-216.
[20] 李林朋,马慧敏,胡俊杰,等. 三氯生和三氯卡班对人体肝细胞DNA损伤的研究[J]. 生态环境学报,2010,19(12):2897-2901.
[21] CAPKIN E,OZCELEP T,KAYIS S,et al. Antimicrobial agents, triclosan, chloroxylenol, methylisothiazolinone and borax,used in cleaning had genotoxic and histopathologic effects on rainbow trout[J]. Chemosphere,2017,182:720-729.
[22] BINELLI A,COGNI D,PAROLINI M,et al. Cytotoxic and genotoxic effects of in vitro exposure to triclosan and trimethoprim on zebra mussel (Dreissena polymorpha) hemocytes[J]. Comp Biochem Physiol C Toxicol Pharmacol, 2009,150(1):50-56.
[23] LIN D,LI Y,ZHOU Q,et al. Effect of triclosan on reproduction,DNA damage and heat shock protein gene expression of the earthworm Eisenia fetida[J]. Ecotoxicology,2014,23(10):1826-1832.
[24] WANG F,XU R,ZHENG F,et al. Effects of triclosan on acute toxicity,genetic toxicity and oxidative stress in goldfish(Carassius auratus)[J]. Exp Anim,2017,Epub.
[25] CINIGLIA C,CASCONE C,GIUDICE R L,et al. Application of methods for assessing the geno- and cytotoxicity of Triclosan to C. ehrenbergii[J]. J Hazard Mater,2005,122(3):227-232.
[26] FENECH M. Cytokinesis-block micronucleus assay evolves into a "cytome" assay of chromosomal instability,mitotic dysfunction and c ell d eath[J]. M utat R es,2006,600(1/2):58-66.
[27] TANG L,GUERARD M,ZELLER A. Quantitative assessment of the dose-response of alkylating agents in DNA repair proficient and deficient ames tester strains[J]. Environ Mol Mutagen,2014,55(1):15-23.
[28] HESS-WILSON J K,KNUDSEN K E. Endocrine disrupting compounds and prostate cancer[J]. Cancer Lett, 2006,241(1):1-12.
[29] PRINS G S. Endocrine disruptors and prostate cancer risk[J].Endocr Relat Cancer,2008,15(3):649-656.

