HIF-1α高表达对苯代谢物诱导K562细胞毒性的影响
孙凤霞,孟 醒,孙蓉丽,张 娟,尹立红,浦跃朴*
(东南大学公共卫生学院环境医学工程教育部重点实验室,江苏 南 京 210009)
苯是常见的环境污染物,是化学工业中常见的原料和试剂,用于制造橡胶、染料、杀虫剂等。在日常生活中,苯主要来源于家庭装修材料、汽车尾气、汽油蒸汽等。苯具有较高毒性,通过呼吸道进入人体,是确认致癌物[1]。长期接触低浓度苯可导致慢性苯中毒,影响人体骨髓的造血功能,临床表现为血小板数量和白细胞计数显著减少,严重者可导致再生障碍性贫血、骨髓增生不良综合征甚至白血病[2]。苯主要通过代谢物来发挥毒性作用[3],在细胞色素氧化酶P4502E1 作用下生成氢醌、苯酚、1,4-苯醌、儿茶酚胺等,苯酚及其他酚类化合物与葡萄糖醛酸或硫酸盐形成共轭化合物,可以随尿液排出体外[4]。
骨髓是苯代谢物导致造血抑制的主要靶器官[5]。苯进入人体,在肝内代谢产生的氢醌被运输进入骨髓后,在髓过氧化物酶的作用下生成苯醌,此氧化过程中产生ROS,致氧化与抗氧化系统失衡,导致氧化应激,影响骨髓细胞的迁移、发育和自我更新以及细胞周期状态,最终导致骨髓衰竭[4,6-7]。苯及其代谢物导致骨髓造血毒性的机制目前尚未阐明,可能与诱导凋亡、DNA损伤、骨髓池的损耗有关[2,7]。课题组前期研究发现,相对于对照组,苯染毒的小鼠骨髓细胞内活性氧上升,而缺氧诱导因子HIF-1α表达降低,推测HIF-1α可能参与苯毒性的调节过程[8]。骨髓微环境氧浓度低,HIF-1α在缺氧环境中高表达,在常氧状态下很快被降解[9-10]。骨髓细胞可能通过HIF-1α通路表达与血管生成、移动性和葡萄糖代谢相关的基因来应对缺氧[11-12]。K562细胞是慢性髓性白血病细胞,本研究通过构建HIF-1α高表达的K562细胞模型,研究苯代谢物1,4-苯醌、氢醌、苯酚对对照组K562细胞和高表达HIF-1α的K562细胞毒性的影响,进而探讨HIF-1α 在苯的代谢物致造血毒性发生中的作用。
1 材料与方法
1.1 主要仪器与试剂
伊思柯夫改良培养液(Iscove’s modified Dulbecco’s medium,IMDM)购于Gibco公司;胎牛血清购于Gibco公司;1,4-苯醌(1,4-benzoquine,1,4-BQ),溶于甲醇,购于Sigma公司;氢醌(hydroquinone,HQ),溶于超纯水,购于Sigma公司;苯酚(phenol,PH),溶于甲醇,购于Sigma公司;四甲基偶氮噻唑盐(diphenyltetrazolium bromide, MTT)购于Sigma公司;二甲基亚砜(dimethyl sulfoxide,DMSO)购于泰坦公司;PBS购于Gibco公司;青霉素和链霉素购于Hyclone公司;遗传霉素(geneticin,G418)购于VWR公司;杀稻瘟菌素购于翊圣生物公司;Quick Change试剂盒购于Stratagene公司;Annexin V-FITC细胞凋亡检测试剂盒和PI细胞周期试剂盒购于BD公司;低温高速离心机购于Eppendorf 公司;二氧化碳培养箱购于Heraeus公司;Mithras LB941多功能酶标仪购于Berthold公司;BD FACS Calibur流式细胞仪购于BD公司。
1.2 实验方法
1.2.1 细胞株的构建及培养 K562细胞株购自中国科学院上海细胞库,常规培养于含体积分数10%胎牛血清、1%青霉素、1%链霉素的IMDM中,培养条件为37℃、CO2体积分数5%。采用Quick Change试剂盒定点突变HIF-1α的脯氨酸402、564(VHL结合位点)和天冬氨酸803位点(FIH结合位点),抑制HIF-1α泛素化降解,得到蛋白稳定表达的P1P2N-HIF-1α质粒。通过慢病毒载体转染进入慢性髓性白血病细胞系K562细胞,构建HIF-1α稳定高表达的K562 细胞,同时构建对照组K562细胞。高表达HIF-1α的K562细胞的HIF-1α蛋白水平显著高于对照组K562细胞。高表达HIF-1α的K562细胞具有杀稻瘟菌素抗性,所以为稳定筛选细胞并维持其抗性,在细胞培养时加入终体积分数为1∶5 000的杀稻瘟菌素。对照组K562细胞具有遗传霉素抗性,在完全培养基中加入1∶1 000的遗传霉素以稳定筛选细胞并维持其抗性。
1.2.2 MTT法检测细胞增殖率 取对数生长期细胞,800 r/min离心5 min,加入完全培养基制成单细胞悬液,按每孔10 000个细胞接种于96 孔培养板中。用完全培养基稀释1,4-苯醌及氢醌溶液至终浓度为0、10、20、40、80 μmol/L,苯酚终浓度为0、1、1.5、2、2.5、5 mmol/L,每个剂量组设5个复孔。每个剂量阴性对照组不加毒物,空白对照组不加细胞及毒物。染毒24 h结束后每孔加入20 μL MTT溶液(5 mg/mL),继续培养4 h,后将96 孔板1 000 r/min离心10 min,小心吸去孔内培养液,每孔加入150 μL DMSO溶解蓝紫色结晶物,混匀后,在酶标仪上选择490 nm波长测定吸光度D(490)值。按公式计算各组细胞相对增殖率。

1.2.3 PI/FITC双染色法结合流式细胞术检测苯代谢物诱导K562细胞凋亡的作用 采用的苯代谢物浓度:1,4-苯醌及氢醌溶液终浓度为0、10、20 μmol/L,苯酚终浓度为0、1、2 mmol/L。染毒24 h后1 500 r/min离心5 min,收集细胞,用PBS洗涤细胞1次后,1 500 r/min离心5 min,收集5×105个细胞,加入500 μL结合缓冲液悬浮细胞。在细胞悬液中加入5 μL异硫氰酸荧光素(fluorescein isothiocyanate,FITC)混匀后,加入5 μL碘化丙啶(propidium iodide,PI)混匀。室温避光反应15 min,1 h内用流式细胞仪检测。
1.2.4 碘化丙啶(PI)染色结合流式细胞术检测细胞周期分布 细胞分组处理同1.2.3,染毒24 h后1 500 r/min离心5 min,收集细胞,用PBS洗涤细胞1次后,1 500 r/min离心5 min,收集1×106个细胞,加入500 μL 70%冷乙醇固定2 h至过夜,4 ℃保存。固定结束后,用PBS洗涤细胞3次,1 500 r/min离心5 min,加入400 μL PI染色混匀,1 h内用流式细胞仪检测。
1.3 统计学方法
采用SPSS 19.0进行统计分析,计量资料组间差异采用单因素方差分析,两两比较采用Dunnett-t检验法,两组细胞间比较采用两独立样本t检验,检验水准α=0.05。
2 结果
2.1 苯代谢物对K562细胞的增殖抑制作用
3种苯代谢物染毒对照组K562细胞和高表达HIF-1α的K562细胞24 h后对其增殖率的影响见图1,可见1,4-苯醌染毒后,两株细胞在20~80 μmol/L浓度均出现增殖率降低且呈剂量效应关系(与未处理组比较,P<0.05);1,4-苯醌浓度为80 μmol/L时,高表达HIF-1α的K562细胞相对增殖率高于对照组K562细胞(P<0.05,图1A)。氢醌染毒后,对照组K562细胞在20~80 μmol/L浓度均出现细胞增殖率降低(与未染毒组比较,P<0.05),而高表达HIF-1α的K562细胞仅在80 μmol/L 浓度时增殖率降低,且在20和40 μmol/L时,高表达HIF-1α的K652细胞较对照组K562细胞增殖率高(P<0.05,图1B)。苯酚染毒后,对照组K562细胞在2.5 和5 mmol/L浓度时增殖率降低(与未染毒组比较,P<0.05),而高表达HIF-1α的K562细胞在1~5 mmol/L浓度染毒时增殖率与未处理组比较差异均无统计学意义(图1C)。

图1 苯代谢物染毒对照组K562细胞和高表达HIF-1α的K562细胞24 h后的增殖率
2.2 苯代谢物对K562细胞的凋亡诱导作用
3种苯代谢物染毒对照组K562细胞和高表达HIF-1α的K562细胞24 h后,流式细胞术检测对其凋亡率的影响,结果见图2。可见1,4-苯醌染毒后,两株细胞的细胞凋亡率增加且呈剂量效应关系(与未染毒组比较,P<0.05),在20 μmol/L浓度时高表达HIF-1α的K562细胞较对照组K562细胞凋亡率降低(P<0.05,图2A)。不同浓度的氢醌和苯酚染毒24 h后,两株细胞的凋亡率与未染毒组比较差异均无统计学意义(P>0.05),高表达HIF-1α的K562细胞的凋亡率较对照组K562细胞差异亦无统计学意义(P>0.05,图2B、2C)。
2.3 苯代谢物对K562细胞周期的影响
3种苯代谢物染毒对照组K562细胞和高表达HIF-1α的K562细胞24 h后的细胞周期分布见表1。可见1,4-苯醌染毒后,相对于未染毒组,两株细胞均出现S期比例上升,G2/M期比例下降(P<0.05),细胞阻滞在S期。在20 μmol/L浓度时,与对照组K562细胞相比,高表达HIF-1α的K562细胞S期、G2/M期比例上升(P<0.05)。氢醌染毒后,与未染毒细胞比较,对照组K562细胞G0/G1期比例上升,G2/M期比例下降(P< 0.05);高表达HIF-1α的K562细胞G0/G1期比例上升,S期比例下降(P<0.05)。与对照组K562细胞相比,未染毒时高表达HIF-1α的K562细胞的G0/G1期和S期比例上升(P<0.05);10 μmol/L浓度染毒时高表达HIF-1α的K562细胞G0/G1期比例上升(P<0.05)。苯酚染毒后,相对于未染毒组,对照组K562细胞G0/G1期比例上升;高表达HIF-1α的K562细胞G0/G1期比例下降,S期和G2/M期上升(P<0.05)。与对照组K562细胞相比未染毒时高表达HIF-1α的K562细胞G0/G1期比例下降,G2/M期上升(P<0.05);1、2 mmol/L浓度苯酚染毒时高表达HIF-1α的K562细胞G0/G1期比例下降,S期和G2/M期上升(P< 0.05)。

图2 苯代谢物染毒对照组K562细胞和高表达HIF-1α的K562细胞24 h后的凋亡率
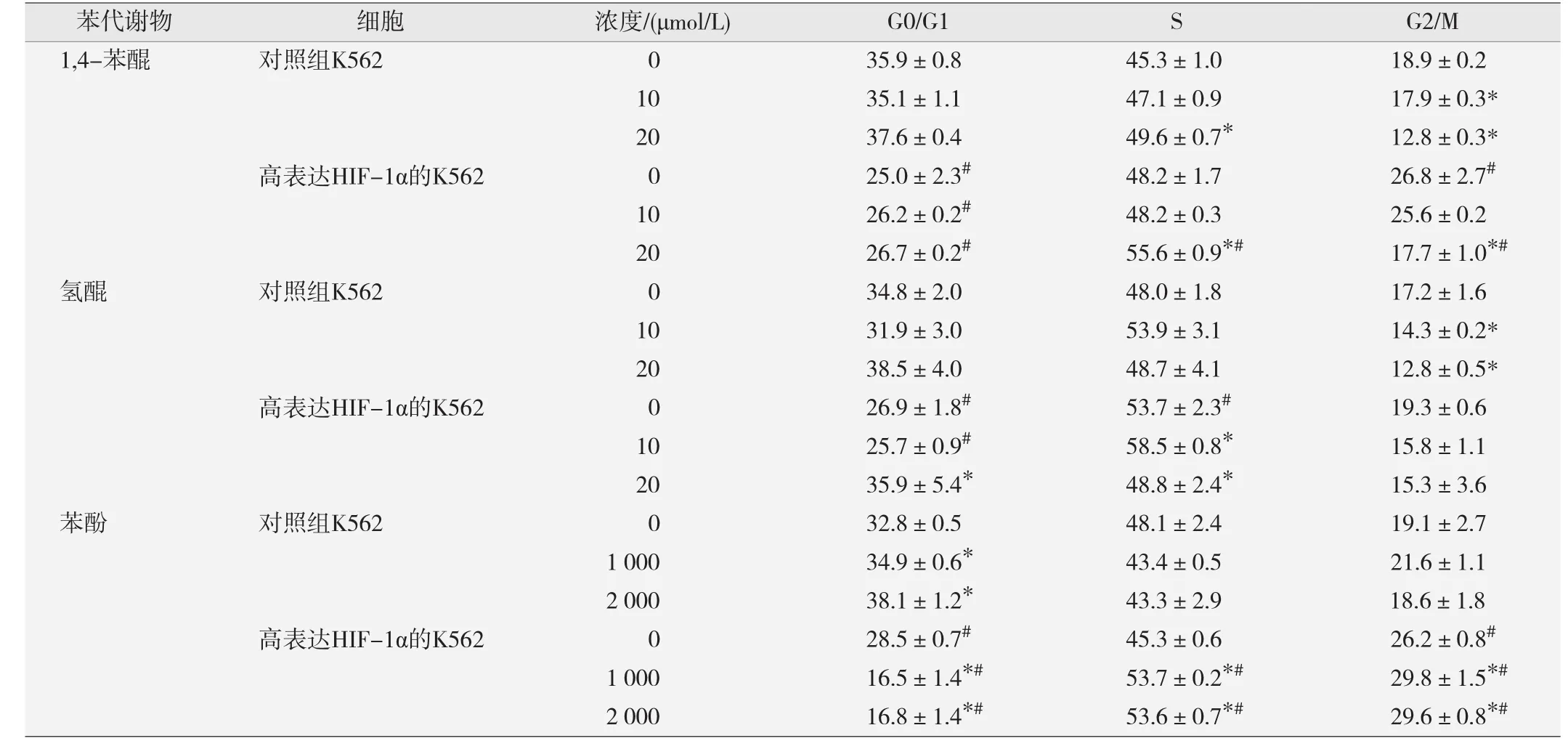
表1 3种苯代谢物染毒对照组K562细胞和高表达HIF-1α的K562细胞24 h后的细胞周期分布(%,-x±s)
3 讨论
苯是一种确认的致癌物,不仅在工业生产中应用广泛,还普遍存在日常生活中,如加油站及汽车尾气、家庭装修材料等。我国存在大量苯接触人群,如何更好地保护该人群健康是职业卫生领域的重要问题之一。目前职业苯暴露的特点是低浓度长期暴露,主要引起造血系统损害。研究认为苯的血液毒性主要是其在体内代谢过程中形成的代谢产物所引起。苯通过呼吸道进入机体后,在肝内细胞色素酶P4502E1的催化下,氧化生成苯氧化环等,苯氧化环可以自发转化为苯酚,也可以经环氧化物酶催化生成儿茶酚,苯氧化环也可打开进一步氧化形成粘糠醛、黏糠酸;苯酚可以羟基化形成儿茶酚、氢醌、1,2,4-苯三醇等,氢醌进入骨髓,在髓过氧化物酶(MPO)的作用下进一步氧化生成1,4-苯醌[4]。苯酚及其酚类代谢物均可与谷胱甘肽、硫酸盐或葡萄糖苷酸形成盐类,通过尿液排出体外。上述代谢物在苯的骨髓造血毒性中发挥不同程度的作用。缺氧诱导因子HIF-1α,在常氧状态下很快被泛素化降解,而在缺氧状态下高表达。HIF-1α是调节代谢适应和细胞对缺氧反应的转录因子,对造血干细胞的增殖、自我更新、骨髓归巢有重要作用[13-14]。
本研究中,构建HIF-1α稳定高表达的细胞模型,采用3种苯代谢物染毒高表达HIF-1α的K562细胞及对照组K562细胞24 h后,分别检测其增殖率、凋亡率和细胞周期分布。结果显示,1,4-苯醌染毒后,两株细胞均呈现增殖抑制且呈剂量效应关系,1,4-苯醌浓度为80 μmol/L时,高表达HIF-1α的K562细胞较对照组K562细胞增殖抑制减弱。氢醌和苯酚在较高浓度染毒后,对照组K562细胞亦出现增殖抑制,而高表达HIF-1α的K562细胞增殖抑制不明显。实验结果表明高表达HIF-1α后,可削弱3种苯代谢物对K562细胞的增殖抑制效应。流式细胞术结果显示,1,4-苯醌染毒后,两株细胞的细胞凋亡率增加且呈剂量效应关系。高浓度1,4-苯醌染毒时,高表达HIF-1α的K562细胞较对照组K562细胞凋亡减弱。氢醌和苯酚染毒后,两株细胞的凋亡率与未染毒组比较差异均无统计学意义,高表达HIF-1α 的K562细胞的凋亡率较对照组K562细胞亦无显著差异。以上结果表明HIF-1α高表达后,较高浓度苯的代谢物对K562细胞的凋亡诱导作用减弱。细胞周期的检测结果显示,3种苯代谢物均可引起K562细胞周期阻滞在G0/G1期或S期。综上结果,提示HIF-1α可在一定程度上降低苯代谢物引起的细胞毒性作用,其作用的发挥可能是通过调节细胞周期参与调节细胞增殖及凋亡。通过对3种苯代谢物细胞毒性的比较,发现1,4-苯醌引起的细胞毒性大于氢醌和苯酚。
既往研究使用苯的代谢物处理K562细胞后的细胞毒性结果和本研究结果基本一致[15-17]。 Jiang等[18]人通过腺病毒感染SCN-cells使HIF-1α高表达,使细胞增殖能力增强2倍、细胞迁移能力增强1.4倍。而Chen等[19]通过siRNA 降低K562细胞中的表达,结果发现HIF-1α低表达的K562细胞的增殖能力、集落形成能力降低。Zhang等[20]通过构建HIF-1α敲除的CML小鼠模型,发现HIF-1α敲除的CML小鼠通过诱导白血病干细胞的凋亡、损害细胞周期进程进而削弱其增殖及自我更新能力。Meng等[8]发现苯染毒的小鼠骨髓细胞中,HIF-1α表达降低,提示HIF-1α参与到小鼠骨髓增殖抑制过程中。
因此,HIF-1α高表达对于苯代谢物诱导的细胞毒性具有保护作用,但具体的调控机制仍有待研究,本研究可为进一步探讨HIF-1α在苯代谢产物诱导造血毒性中的作用提供线索。
[1] TOMATIS L. IARC benzene report[J]. Science,1982,218(4569):214.
[2] SMITH M T. Overview of benzene-induced aplastic anaemia[J].Eur J Haematol,1996,57:107-110.
[3] SNYDER R,HEDLI C C. An overview of benzene metabolism[J].Environ Health Perspect,1996,104(6):1165-1171.
[4] SNYDER R. Leukemia and benzene[J]. Int J Environ Res Public Health,2012,9(8):2875-2893.
[5] MCHALE C M, ZHANG L, SMITH M T. Current understanding of the mechanism of benzene-induced leukemia in humans:implications for risk assessment[J]. Carcinogenesis,2012,33(2):240-252.
[6] RICHARDSON C,YAN S,VESTAL C G. Oxidative stress,bone marrow failure,and genome instability in hematopoietic stem cells[J]. Int J Mol Sci,2015,16(2):2366-2385.
[7] ZHAO Z,HE X,BI Y,et al. Induction of CYP4F3 by benzene metabolites in human white blood cells in vivo in human promyelocytic leukemic cell lines and ex vivo in human blood neutrophils[J]. Drug Metab Dispos,2009,37(2):282-291.
[8] MENG X,ZHANG J,YIN L H,et al. Involvement of hypoxia-inducible factor-1 alpha (HIF-1 alpha) in inhibition of benzene on mouse hematopoietic system[J]. J Toxicol Environ Health A,2016,79(9/10):402-406.
[9] TESTA U,LABBAYE C,CASTELLI G,et al. Oxidative stress and hypoxia in normal and leukemic stem cells[J]. Exp Hematol,2016,44(7):540-560.
[10] SPENCER J A,FERRARO F,ROUSSAKIS E,et al. Direct measurement of local oxygen concentration in the bone marrow of live animals[J]. Nature,2014,508(7495):269-273.
[11] WU C,ZHOU Y,FAN W,et al. Hypoxia-mimicking mesoporous bioactive glass scaffolds with controllable cobalt ion release for bone tissue engineering[J]. Biomaterials,2012,33(7):2076-2085.
[12] LI T S,HAMANO K,SUZUKI K,et al. Improved angiogenic potency by implantation of ex vivo hypoxia prestimulated bone marrow cells in rats[J]. Am J Physiol Heart Circ Physiol,2002,283(2):468-473.
[13] HU C J,IYER S,SATAUR A,et al. Differential regulation of the transcriptional activities of hypoxia-inducible factor 1 alpha(HIF-1alpha) and HIF-2alpha in stem cells[J]. Mol Cell Biol,2006,26(9):3514-3526.
[14] JENNIFER M. S,JONATHAN H,PRATIBHA S,et al.Pharmacologic increase in HIF1a enhances hematopoietic stem and progenitor homing and engraftment[J]. Blood, 2014,123(2):203-207.
[15] 吴小荣,李晓飞,韩庆玲. 甲基化抑制剂对氢醌抑制K562细胞红系分化的干预作用[C]//全国生化/工业与卫生毒理学学术会议论文集. 大连:中国毒理学会,2010:241-242.
[16] 薛明,张光垚,吴晓荣. 苯代谢物苯酚对K562细胞的凋亡诱导和分化抑制作用[C]//中国毒理学会第五次全国学术大会论文集. 贵阳:中国毒理学会,2009:70.
[17] 韩庆玲,薛明,吴晓荣. 苯代谢物苯酚对K562细胞的凋亡诱导作用[C]//中国毒理学会第五次全国学术大会论文集. 贵阳:中国毒理学会,2009:138.
[18] JIANG Y Z,LI Y,WANG K,et al. Distinct roles of HIF1A in endothelial adaptations to physiological and ambient oxygen[J].Mol Cell Endocrinol,2014,391(1/2):60-67.
[19] CHEN H,SHEN Y,GONG F,et al. HIF-alpha promotes chronic myelogenous leukemia cell proliferation by upregulating p21 expression[J]. Cell Biochem Biophys,2015,72(1):179-183.
[20] ZHANG H J,LI H W,S. XI H L,et al. HIF1α is required for survival maintenance of chronic myeloid leukemia stem cells[J].BLOOD,2012,119(11):2595-2607.

