硒对慢性镉暴露致大鼠肾损伤的保护作用与机制
周庆彪,刘 颖,孔德钦,张佳欣,于卫华,柏 桦* , 海春旭*
(空军军医大学预防医学院毒理学教研室,陕西省自由基生物学与医学重点实验室,陕西西 安 710032)
镉(cadmium,Cd)作为重金属毒性元素,进入机体主要蓄积在肾脏,引起肾脏氧化应激损伤[1],破坏细胞氧化还原稳态,从而诱导内质网应激、自噬、凋亡和坏死[2-4],最终发展为肾功能障碍甚至是肾衰竭。国内外学者[5-7]试图找到能有效拮抗镉肾毒性的药物和干预措施,但效果一直不理想,如何有效预防和解决镉暴露导致的肾损伤仍是十分棘手的科学难题。维持细胞氧化还原(redox)稳态是生命活动中最基本的反应体系,许多因素影响该平衡体系。因此,为了探究硒在镉暴露导致的肾脏组织损伤中是否发挥保护作用及其可能机制,本研究以氯化镉诱导大鼠肾脏慢性损伤,并给予人体必需微量元素硒干预,通过观察肾脏结构改变,测定肾功能、氧化应激和分子生物学等指标,评估硒是否发挥保护作用。同时,对SETD6、DJ-1和Nrf2等氧化和抗氧化系统调控分子进行了检测,探讨了硒拮抗镉肾毒性的可能机制。
1 材料与方法
1.1 试剂与仪器
氯化镉(CdCl2·2.5H2O),分析纯,购自国药集团化学试剂有限公司(批号F20100208);亚硒酸钠(Na2S eO3· 5H2O),分析纯,购自美国Sigma公司(批号S5261);DHE和Hoechst 33528荧光探针购自美国Sigma公司;尿素氮(urea nitrogen,UN)、肌酐(creatinine,CREA)苦味酸法测定试剂盒购于北京利德曼生化股份有限公司;丙二醛(malondialdehyde,MDA)(TBA法)、总超氧化物歧化酶(superoxide dismutase,SOD)(羟胺法)及 N-乙 酰 -β-D-葡 萄 糖 苷 酶 (N-acetyl-beta-dglucosidase,NAG)检测试剂盒购于南京建成生物技术研究所;鼠抗β-actin抗体(1∶5 000稀释)购自Sigma公司;鼠抗Nrf2抗体(1∶500稀释)购自Novus公司;兔抗SETD6和DJ-1抗体(均1∶500稀释)购自Bioworld公司。主要仪器有:日立7020全自动生化检测仪(日立公司,日本);全波段酶标仪(Infinite M200 PRO,Austria);正置荧光显微镜、激光共聚焦显微镜为Olympus公司产品;高通量组织研磨器(Scientz-48,宁波新芝生物科技股份有限公司);Mini-Protein电泳系统、蛋白半干转装置及凝胶成像系统均为Bio-Rad公司产品。
1.2 方法
1.2.1 动物与饲养 48只SPF级雄性SD大鼠,体质量100~150 g,由空军军医大学实验动物中心提供。饲养于SPF级动物房,食物与饮水自由摄取,相对湿度50%±10%,温度(24±2) ℃,12 h/12 h交替照明和避光,每日观察动物情况。
1.2.2 实验分组与处理 将48只SD大鼠根据体质量随机分为空白对照组、镉暴露组、硒对照组、硒干预组,每组12只。空白对照组每天按10 mL/kg灌胃去离子水,镉暴露组按3 mg/kg灌胃CdCl2,硒对照组按0.01 mg/kg灌胃Na2S eO3, 硒干预组按3 mg/kg灌胃CdCl2同时按0.01 mg/kg灌胃Na2S eO3,每天1次,每周连续灌胃 6 d,共计12周。造模成功后,禁食12 h,处死动物取血、尿和肾脏组织,进行后续试验。
1.2.3 生化指标检测 未经抗凝的全血经3 500 r/min离心10 min后,取上部血清,用日立7020全自动生化仪测定血清中尿素氮和肌酐含量。各组大鼠置于代谢笼中,自由饮水,禁食,收集夜间12 h(晚20时至次日早8时)尿液,2 000 r/min离心10 min后,取上清液,用日立7020全自动生化仪测定尿液中尿素氮、肌酐和NAG,用BCA蛋白定量法测定尿液中总蛋白含量。
1.2.4 肾脏HE染色 肾组织用4%多聚甲醛固定,常规脱水、包埋、切片、脱蜡、HE染色、脱水、封片后于正置荧光显微镜下观察肾小球和肾小管病理改变。
1.2.5 肾皮质ROS水平检测 采用DHE荧光探针检测肾皮质ROS水平,具体步骤如下:制备厚度为10 μm的肾组织冰冻切片,置于湿盒中,将10 μmol/L 的DHE和Hoechst 33528均按1∶1 000的比例用1×PBS稀释,并将两种染料混匀,向每张切片上的肾组织滴加混合液150 μL,37 ℃避光孵育15 min,1×PBS洗3次,每次2 min,封片剂封片,于激光共聚焦显微镜下观察结果并拍照。
1.2.6 肾组织MDA、总SOD及NAG水平的测定用眼科剪将50 mg肾皮质部分剪碎,置于1.5 mL EP管中,加入450 μL预冷的生理盐水,低温机器匀浆(30 Hz频率,运行10 s,停止30 s,重复5次),制备成10%肾组织匀浆。匀浆液于4 ℃、3 000 r/min离心15 min,取上清,留取30 μL用作BCA蛋白定量,余分装保存于-80 ℃,用于MDA、总SOD及NAG水平的测定。
1.2.7 肾组织SETD6、DJ-1和Nrf2蛋白表达的测定称取100 mg肾皮质部分剪碎,置于2 mL EP管中,加入1 mL裂解缓冲液(1 mL RIPA裂解液+20 μL 矾酸钠+5 μL Cocktail),低温机器匀浆(50 Hz频率,运行10 s,停止30 s,重复5次),冰上裂解30 min,匀浆液于4 ℃、12 000 r/min离心15 min,取上清,留取30 μL用作BCA蛋白定量,余下部分加入等体积2×Loading Buffer和35 μ L 二 硫苏糖醇(dithiothreitol,DTT),100 ℃ 煮沸5 min,置于冰中使其降到室温后,12 000 r/min离心5 min,分装保存于-80 ℃ ,用于Western b lotting测定。
1.3 统计学方法
采用GraphPad Prism 5.01软件进行统计处理,数据
2 结果
2.1 体质量和肾脏质量的变化
实验大鼠体质量的变化如图1A所示,可见随动物饲养与染毒时间增加,各组大鼠体质量均逐渐增加,与对照组比较,镉暴露组、硒对照组和硒干预组的大鼠体质量均略有升高,但各组大鼠肾脏的脏器系数无明显差异(图1B)。

图1 大鼠体质量和肾脏的脏器系数(n=12)
2.2 肾功能变化
血清中尿素氮和肌酐水平是临床上常用的判断肾功能的指标。如图2A和2B所示,镉染毒12周后,与对照组相比,镉暴露组大鼠血清尿素氮水平显著升高(P<0.05);硒干预组大鼠与镉暴露组比较,血清中尿素氮和肌酐水平显著降低(P<0.05)。尿液中尿素氮与肌酐比值和总蛋白含量均能够反映肾损伤程度,如图2C和2D所示,与对照组相比,镉暴露组大鼠尿液中尿素氮与肌酐比值和总蛋白含量均显著升高(P<0.05);而硒对照组和硒干预组大鼠与镉暴露组比较,尿素氮与肌酐比值和总蛋白含量均显著降低,差异均具有统计学意义(P<0.05)。
2.3 肾组织病理学变化
He染色见图3。可见对照组大鼠肾脏组织结构完整,肾小球形状规则,毛细血管网轮廓清晰。肾小管轮廓清楚,游离面刷状缘清晰,上皮细胞排列整齐,管腔干净。镉暴露组大鼠肾脏病理损伤较对照组加重,可见肾小球肿胀,细胞数目增多,毛细血管网出现裂隙;肾小管广泛性病变,排列紊乱、肿胀、管腔狭窄几乎不见,上皮细胞坏死、结构消失,脱落细胞堆积于管腔,伊红染色阳性;肾间质充血严重,炎性细胞浸润程度明显增加。硒对照组大鼠与对照组相比,肾脏组织未见明显改变。而硒干预组肾脏病理损伤较镉暴露组减轻,肾小球肿胀程度减小,细胞数目减少,毛细血管网裂隙减少;肾小管虽有病变,但排列紊乱、肿胀、管腔狭窄程度均减轻,坏死、脱落的上皮细胞也减少;肾间质充血、炎细胞浸润程度明显减少。
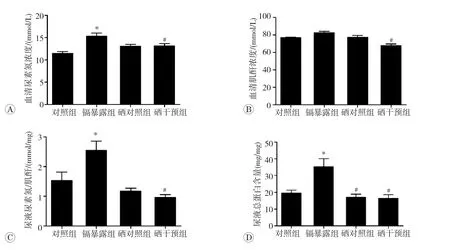
图2 大鼠肾功能变化(n=12)

图3 肾脏病理变化(×400)
2.4 肾脏ROS水平变化
DHE染色结果如图4A所示,与对照组相比,镉暴露组肾组织红色荧光强度显著升高,硒对照组红色荧光强度略高;而硒干预组红色荧光强度比镉暴露组显著降低。使用Image-Pro Plus 6.0 软件进行灰度分析,结果如图4B所示:与对照组相比,镉暴露组ROS水平显著上升(P<0.05);而硒对照组和硒干预组与镉暴露组相比ROS水平均明显下降(P<0.05)。
2.5 肾脏损伤检测指标变化
如图5A和C所示,与对照组相比,镉暴露组MDA和NAG水平显著升高(P<0.05),硒对照组无明显变化;而硒干预组与镉暴露组相比,MDA水平明显降低(P<0.05)。图5B中所示,与对照相比,镉暴露组总SOD活性较对照组显著降低(P<0.05),硒对照组无明显变化;而硒干预组与镉暴露组相比总SOD活性升高(P<0.05)。
2.6 肾脏组织蛋白表达
如图6所示,镉暴露组与对照组相比,DJ-1和Nrf2蛋白表达水平均显著降低(P<0.05);硒对照组与对照组相比,SETD6和DJ-1蛋白表达水平均较低(P<0.05);而与镉暴露组相比,硒对照组和硒干预组SETD6蛋白表达水平均显著降低(P<0.05),硒对照组DJ-1蛋白表达水平显著降低(P<0.05),而硒干预组DJ-1蛋白表达水平显著升高(P<0.05),硒干预组Nrf2蛋白表达水平显著升高(P<0.05)。

图5 肾组织损伤监测指标变化(n=6)
3 讨论
尽管镉进入机体后,能够通过氧化应激、自噬、凋亡、坏死等多种途径引起急性或慢性损伤,但越来越多的研究[8-10]认为其毒性作用主要是破坏细胞氧化还原稳态,诱导氧化损伤,具体机制尚不清楚。研究表明,游离的镉离子一方面具有高度的巯基亲和性,主要通过攻击细胞内的巯基,导致局部氧化还原失衡,引起氧化应激[11];另一方面镉离子能够替代各种蛋白质中的氧化还原活性元素[12],通过Fenton反应直接促进羟基自由基(·OH)的产生,加剧机体的氧化损伤[13]。但是,尚缺乏有效的药物和手段来应对镉毒性。因此,本研究通过CdCl2连续给予大鼠灌胃12周,建立慢性镉暴露动物模型,并给予硒干预,探讨硒对镉暴露致肾功能损伤的保护作用及其机制。
正常情况下,肾小球和肾小管发挥滤过和重吸收作用。镉暴露后大鼠血液和尿液中尿素氮、肌酐及总蛋白含量升高,肾组织NAG活性升高,均提示肾小球和肾小管功能障碍。而肾脏组织病理结果进一步证实了肾小球和肾小管的结构损伤。肾脏组织冰冻切片DHE染色结果(图4A)提示,镉暴露后ROS水平显著升高,且MDA水平显著升高(图6A)与总SOD活性被抑制(图6B)提示肾脏组织遭受氧化应激,自身清除ROS的能力受到影响,不能及时清除过量的ROS,使机体对镉更为敏感[14],如此恶性循环,最终导致肾脏组织脂质过氧化损伤程度加重。而给予硒干预(0.01 mg/kg)后,肾脏损伤指标如尿素氮、肌酐、尿液总蛋白、早期肾脏损伤标志物NAG[15]及脂质过氧化产物MDA等均得到了一定程度的改善,且硒干预组大鼠肾脏组织病理改变较镉暴露组明显减轻,表明硒对镉暴露致肾功能损伤具有保护作用。为了研究硒发挥保护作用的具体机制,本研究通过Western blotting实验对相关蛋白在各组中的表达进行了检测,以期发现其中的差异。
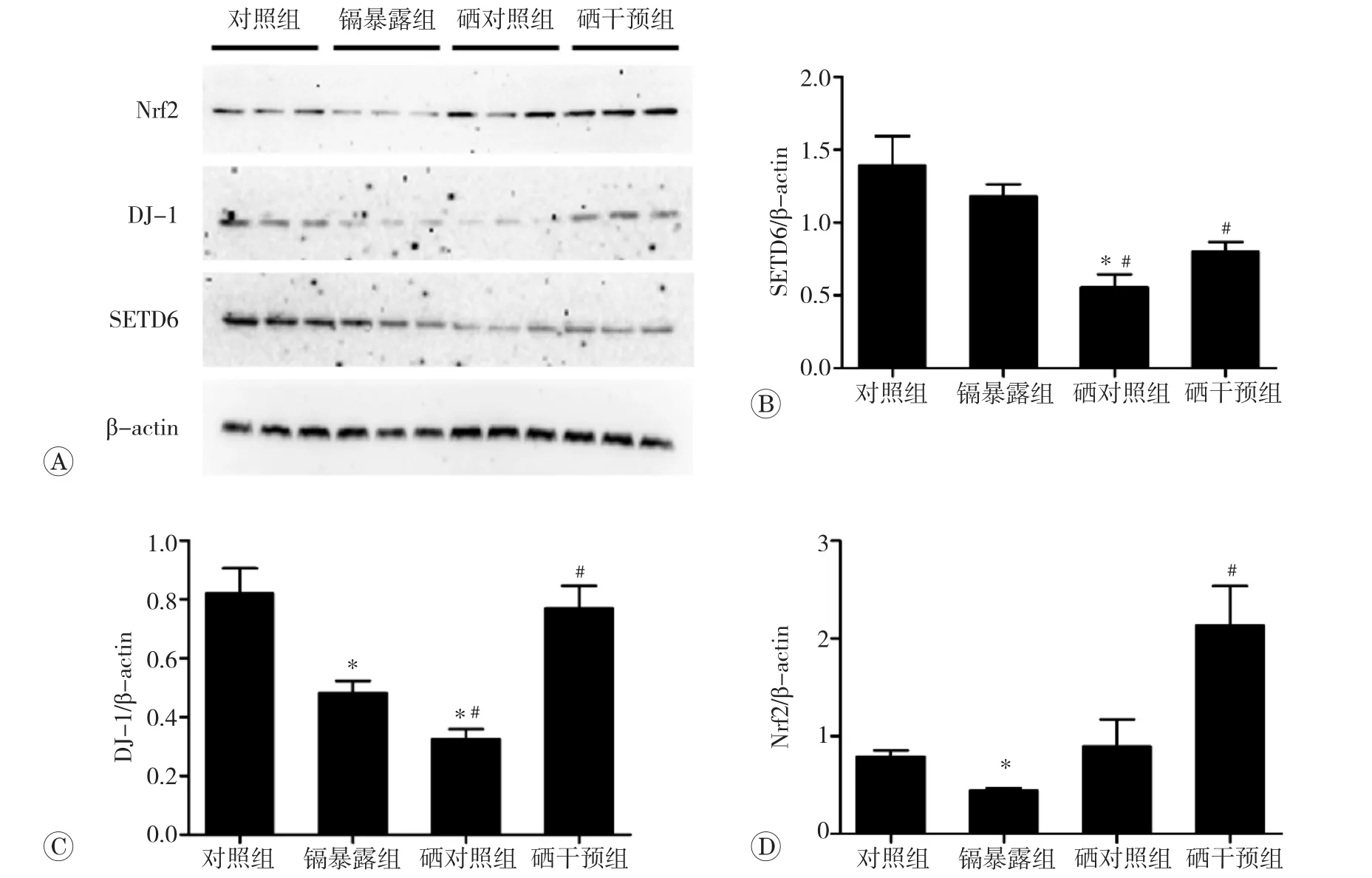
图6 肾组织蛋白表达水平(n=3)
Nrf2作为调控抗氧化系统的重要转录因子,被国内外许多研究[6,16-17]认为在维持机体氧化还原稳态过程中发挥着关键作用。本研究发现,镉暴露能显著抑制肾组织中Nrf2蛋白表达,减弱机体抗氧化系统功能;而硒干预后,减弱了镉对Nrf2的抑制作用,Nrf2蛋白表达量显著升高,机体抗氧化系统功能得到恢复,氧化应激损伤减轻。但是,我们前期的研究[18]发现单一使用或联合使用抗氧化剂,仍不能有效应对氧化应激和自由基链式反应,这提示想要有效解决镉毒性,仅仅考虑抗氧化系统可能是不够的。因此本研究对氧化应激传感器DJ-1进行了检测。DJ-1是DJ-1/PARK7基因的产物,广泛地表达并参与多种细胞过程的调控,能够调节NF-κB[19]、 Nrf2[20]等转录因子的表达和活性。DJ-1可以减弱Keap1对Nrf2的封闭作用,抑制Nrf2的泛素化,进而促进Nrf2稳定发挥抗氧化作用[20]。镉暴露后DJ-1蛋白表达被显著抑制,硒干预后DJ-1蛋白表达量升高。这些变化提示硒可能通过增强DJ-1的表达进而增强了其正向调控Nrf2的作用。硒对照组与对照组比较,DJ-1表达量低,提示DJ-1可能在氧化应激条件下才能发挥其作用,硒可能通过某未知途径抑制了DJ-1的 表 达 量 。 而Chen等[21-24]在HEL-K562细 胞 、HEK-293T细胞和MDA-MB-231细胞等肿瘤细胞中发现,在细胞增殖和炎症进程中发挥重要作用的蛋白甲基化转移酶SETD6(SET domain containing protein 6,SETD6),在正常生理条件下与DJ-1以物理形式结合在染色质上,抑制其功能,从而负调控抗氧化关键分子Nrf2的作用,可能是氧化还原平衡失调的关键因子。因此,我们又检测了SETD6的变化。图6B中,硒对照组与对照组和镉暴露组相比,SETD6蛋白表达量较低,表明硒抑制了SETD6表达;而硒干预组与镉暴露组相比,SETD6蛋白表达水平显著降低(P<0.05),DJ-1和Nrf2蛋白表达水平均显著升高,表明硒干预通过抑制SETD6表达促进了DJ-1和Nrf2的表达,但具体机制,仍有待继续研究挖掘。
综上所述,硒能有效拮抗慢性镉暴露导致的大鼠肾脏毒性,其作用机制可能是氧化应激条件下,硒通过抑制SETD6,促进DJ-1表达,进而促进抗氧化转录因子Nrf2表达,增强机体抗氧化能力,减轻镉暴露诱导的氧化应激损伤。这一发现为寻找有效防治镉中毒的药物和干预措施及其相关机制提供了新的研究思路,具有一定的现实意义。
[1] JARUP L,BERGLUND M,ELINDER C G,et al. Health effects of cadmium exposure-a review of the literature and a risk estimate[J]. Scand J Work Environ Health,1998,24 Sup 1:1-51.
[2] KIM J,SONG H,HEO H R,et al. Cadmium-induced ER stress and inflammation are mediated through C/EBP-DDIT3 signaling in human bronchial epithelial cells[J]. Exp Mol Med,2017,49(9):e372.
[3] THEVENOD F,LEE W K. Cadmium and cellular signaling cascades:interactions between cell death and survival pathways[J]. Arch Toxicol,2013,87(10):1743-1786.
[4] SO K Y,KIM S H,JUNG K T,et al. MAPK/JNK1 activation protects cells against cadmium-induced autophagic cell death via differential regulation of catalase and heme oxygenase-1 in oral cancer c ells[J]. T oxicol A ppl P harmacol,2017,332:81-91.
[5] 傅晗. 硒对镉暴露大鼠肝、睾丸毒性的剂量选择性保护作用[D]. 西安:第四军医大学,2015.
[6] 黎珊珊,徐兆发. 姜黄素激活Nrf2-ARE通路抑制镉肾毒性的研究进展[J]. 环境与健康杂志,2014,31(1):90-93.
[7] RINALDI M,MICALI A,MARINI H,et al. Cadmium,organ toxicity and therapeutic approaches:A review on brain,kidney and testis damage[J]. Curr Med Chem,2017,24(35):3879-3893.
[8] TRABELSI H, AZZOUZ I, FERCHICHI S, et al.Nanotoxicological evaluation of oxidative responses in rat nephrocytes induced by cadmium[J]. Int J Nanomedicine,2013,8:3447-3453.
[9] MONTES S,JUAREZ-REBOLLAR D,NAVA-RUIZ C,et al.Immunohistochemical study of Nrf2-antioxidant response element as indicator of oxidative stress induced by cadmium in developing rats[J]. Oxid Med Cell Longev, 2015,2015:570650.
[10] NAIR A R,LEE W K,SMEETS K,et al. Glutathione and mitochondria determine acute defense responses and adaptive processes in cadmium-induced oxidative stress and toxicity of the kidney[J]. Arch Toxicol,2015,89(12):2273-2289.
[11] LOPEZ E,ARCE C,OSET-GASQUE M J,et al. Cadmium induces reactive oxygen species generation and lipid peroxidation in cortical neurons in culture[J]. Free Radic Biol Med,2006,40(6):940-951.
[12] DORTA D J,LEITE S,DEMARCO K C,et al. A proposed sequence of events for cadmium-induced mitochondrial impairment[J]. J Inorg Biochem,2003,97(3):251-257.
[13] CUYPERS A,PLUSQUIN M,REMANS T,et al. Cadmium stress: an oxidative challenge[J]. Biometals, 2010,23(5):927-940.
[14] CHEN J,SHAIKH Z A. Activation of Nrf2 by cadmium and its role i n p rotection a gainst c admium-induced a poptosis i n r at k idney cells[J]. T oxicol A ppl P harmacol,2009,241(1):81-89.
[15] FUFAA G D,WEIL E J,NELSON R G,et al. Association of urinary KIM-1,L-FABP,NAG and NGAL with incident endstage renal disease and mortality in American Indians with type 2 diabetes mellitus[J]. Diabetologia,2015,58(1):188-198.
[16] PI J,ZHANG Q,FU J,et al. ROS signaling,oxidative stress and Nrf2 in pancreatic beta-cell function[J]. Toxicol Appl Pharmacol,2010,244(1):77-83.
[17] WANG Y,DACOSTA C,WANG W,et al. Synergy between sulforaphane and selenium in protection against oxidative damage in colonic CCD841 cells[J]. Nutr Res,2015,35(7):610-617.
[18] QIN X J,HE W,HAI C X,et al. Protection of multiple antioxidants Chinese herbal medicine on the oxidative stress induced by adriamycin chemotherapy[J]. J Appl Toxicol,2008,28(3):271-282.
[19] MCNALLY R S,DAVIS B K,CLEMENTS C M,et al. DJ-1 enhances cell survival through the binding of cezanne,a negative regulator of NF-κB[J]. J Biol Chem,2011,286(6):4098-4106.
[20] CLEMENTS C M,MCNALLY R S,CONTI B J,et al. DJ-1,a cancer- and Parkinson's disease-associated protein,stabilizes the antioxidant transcriptional master regulator Nrf2[J].PNAS,2006,103(41):15091-15096.
[21] CHEN A,FELDMAN M,VERSHININ Z,et al. SETD6 is a negative regulator of oxidative stress response[J]. Biochim Biophys Acta,2016,1859(2):420-427.
[22] MUKHERJEE N,CARDENAS E, BEDOLLA R, et al.SETD6 regulates NF-kappaB signaling in urothelial cell survival: Implications for bladder cancer[J]. Oncotarget,2017,8(9):15114-15125.
[23] VERSHININ Z,FELDMAN M,CHEN A,et al. PAK4 methylation by SETD6 promotes the activation of the wnt/betacatenin pathway[J]. J Biol Chem,2016,291(13):6786-6795.
[24] LEVY D,KUO A J,CHANG Y,et al. Lysine methylation of the NF-κB subunit RelA by SETD6 couples activity of the histone methyltransferase GLP at chromatin to tonic repression of NF-κB signaling[J]. Nat Immunol,2010,12(1):29-36.

