肺腺癌患者新鲜细胞学标本EGFR基因突变检测及意义
郭 晓,王 蕊,吴 娟,纪晓坤,王 珩,张 艳,马 阳,杜 芸*
(河北医科大学第四医院癌检中心,河北 石 家庄 050011)
表皮生长因子(epidermal growth factor receptor,EGFR)是一种具有酪氨酸激酶活性的跨膜糖蛋白,在肺腺癌中突变率较高。2015年美国国立综合癌症网络(national comprehensive cancer network,NCCN)建议对晚期的非小细胞肺癌(non-small cell lung cancer,NSCLC)患者进行EGFR基因常规检测,对于敏感突变患者推荐靶向药物作为一线治疗[1]。目前,用于EGFR基因突变检测的标本大多采用肿瘤组织的石蜡标本[2],但晚期患者很难获得,而此类患者常伴随远处体表淋巴结转移和胸腔积液,细胞学标本的获取相对容易且数量充足。本研究通过细针穿刺和抽取胸腔积液获得新鲜细胞学标本,经HE染色、免疫细胞化学明确诊断后进行EGFR基因突变检测,EGFR基因突变阳性的患者服用酪氨酸激酶抑制剂(tyrosine kinase inhibitor,TKI)或进行化疗,评估其预后。探讨采用新鲜细胞学标本进行EGFR基因突变检测的可行性和临床意义。
1 材料与方法
1.1 临床资料
收集2013年1月至2015年1月河北医科大学第四医院癌检中心要求行EGFR基因突变检测的313例晚期肺腺癌患者新鲜细胞学标本及病历资料,男性患者161例,女性患者152例;年龄28~89岁,平均年龄为60岁,其中≥60岁169例,<60岁的144例;细针穿刺标本112例,胸腔积液标本201例。预后评估的纳入标准:新鲜细胞学标本检测EGFR阳性,无20号外显子突变;有完整病例资料;无肺外原发性肿瘤;根据实体瘤疗效评价标准(response evaluation criteria in solid tumors,RECIST),有明确可评估和测量的病灶;服用一线药物后生存期≥1个月。
1.2 标本采集及处理
1.2.1 针吸标本采集及处理 细针穿入淋巴结负压抽取少量内容物,一部分注入1.5 mL的EP管,置于-20℃冰箱保存,用于EGFR基因突变检测;剩余部分制作10张细胞涂片,2张采用普通玻片用于常规诊断,8张采用防脱玻片用于免疫细胞化学诊断,均置于95%乙醇中固定。
1.2.2 胸腔积液标本采集及处理 将送检胸腔积液分成两部分:一部分胸腔积液(约100~200 mL)倒入20 mL离心管,1 800 r/min离心2 min,弃上清,留取底层沉淀物,重复倒入离心管,直至将这部分胸腔积液全部离心完毕,最后一次留取5 mL上清液,混匀,置于-20 ℃冰箱保存,用于EGFR基因突变检测;剩余胸腔积液用一次性病变细胞采集器富集细胞后,将载有细胞的膜片均匀地涂于10张载玻片,用途和固定同上。
以上标本经HE染色找到癌细胞且癌细胞占整张玻片上细胞总数的比例≥25%后进行免疫细胞化学染色。
1.3 免疫细胞化学
结合临床资料和其他影像学检查结果,选择NapsinA、TTF-1、CEA、CK7、CK5/6、P63、P40、Syn、CD56、E-cadherin、CR等抗体,采用SP法进行免疫细胞化学染色:将防脱玻片从固定液中取出,风干后水洗,置于过氧化氢中15 min;充分水洗后,抗原修复;滴加动物非免疫血清,室温孵育15 min;弃去多余血清后加一抗,4 ℃过夜;PBS冲洗,加二抗,孵育20 min;PBS冲洗,DAB显色,苏木素复染细胞核,然后酒精分化、氨水返蓝、梯度酒精脱水。吹干,中性树胶封片。
免疫细胞化学标记后观察目的细胞,抗体着色的位置准确,在相应部位出现明显棕黄色或者棕褐色颗粒才可判定为阳性。
1.4 EGFR基因突变检测
1.4.1 DNA提取 采用德国QIAGEN公司提取新鲜细胞学标本DNA的试剂盒(QIAamp DNA Mini Kit),经消化、结合、洗涤、洗脱等步骤在紫外线分光光度计下检测DNA样本的纯度和浓度,确保其纯度在1.7~2.1、浓度在2~10 ng/µL。
1.4.2 EGFR基因突变检测 使用武汉海吉力生物科技有限公司研发的人类EGFR基因突变检测试剂盒进行检测。该试剂盒采用扩增阻滞突变系统(amplification refractory mutation system,ARMS)技术进行实时荧光定量PCR,检测人类EGFR基因外显子18~21上的突变。主要步骤:将待测的DNA样品、阴性对照和阳性对照各取40 µL,分别加入4 µL热启动Taq DNA聚合酶,瞬时离心混匀后,依次取5 µL加入试剂盒的8联条后,置于ABI7500实时荧光定量PCR仪中,按照说明书设置程序。
1.4.3 检测结果判读 PCR仪收集到的信号应满足以下条件才能认为结果可信:①阴性对照无FAM信号升起;②阳性对照FAM信号CT值 应符合10≤CT≤ 20;③外控反应孔(EGFR 8联PCR反应条的第8孔)的FAM信号CT值 应符合10≤CT≤ 25。
此试剂盒采用ΔCT值 来判断样本的结果。每个样本检测完成后均有7个检测体系对应的突变信号(FAM)CT值 和内控信号(JOE/VIC)CT值 ,还有1个外控信号(FAM)CT值 。若突变信号CT值 >30,则检测结果为阴性。若突变信号CT值≤30,则应计算检测体系与外控检测体系FAM信号之间的ΔCT值 。EGFR基因的突变分布在18~21号外显子上,因此可能存在多种突变共存的情况(见表1)。
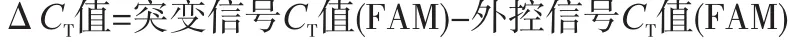

表1 EGFR基因突变含量判断
1.5 预后评估
将EGFR基因突变阳性的患者按1.1中所述纳入标准筛选,根据一线用药情况分成两组,即靶向治疗组和化疗组。靶向治疗组:口服厄洛替尼150 mg/d或者吉非替尼250 mg/d。化疗组:顺铂30 mg/m2,第1~3天静脉滴注;紫杉醇135 mg/m2,第1天静脉滴注,每3周为1个疗程。所有入组患者接受治疗直至出现疾病进展或者不可耐受的副反应,期间每3个月随访一次,观察患者的客观有效率(objective response rate,ORR)和无进展生存期(progression free survival,PFS)。
1.6 统计分析
运用SPSS 16.0统计分析软件,χ2检验评价ORR,Kaplan-Meier曲线进行PFS的分析。
2 结果
2.1 HE染色和免疫细胞化学染色结果
313例患者中,找到癌细胞297例。找到癌细胞的患者中,确诊为肺腺癌293例。
2.2 EGFR基因突变检测结果
293例肺腺癌患者,288例提取DNA成功,提取成功率约为98.3%。这288例患者进行EGFR基因突变检测,发生基因突变130例,突变率为45.1%。其中18号外显子突变的5例,占3.8%;19号外显子突变60例,占46.2%;20号外显子突变5例,占3.8%;21号外显子突变60例,占60%。EGFR突变与患者的临床特征关系见表2。

表2 EGFR突变与临床特征的关系
2.3 预后
截止到2016年1月,符合纳入标准的93例EGFR阳性患者中,中位随访时间14个月,共死亡54例。靶向治疗组和化疗组ORR的差异具有统计学意义(χ2≈24.544,P<0.01),即靶向治疗组的疗效优于化疗组(见表3)。靶向治疗组和化疗组的中位PFS分别为9.5个月和6个月,从图1中可看出靶向治疗组曲线在化疗组之上,即靶向治疗组的无进展生存期长于化疗组。
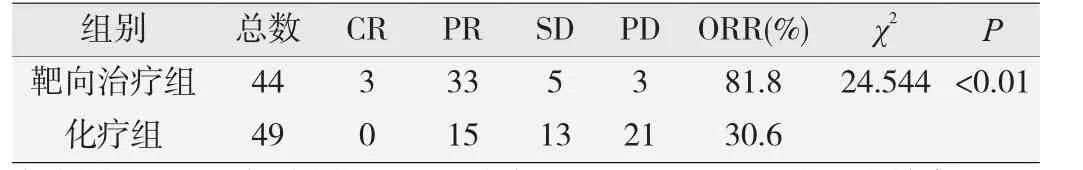
表3 3组NSCLC患者的疗效比较

3 讨论
当今,肺癌严重威胁人类的健康,是发病率和致死率最高的恶性肿瘤之一,而非小细胞肺癌又是肺癌中最常见的类型[3]。由于发病隐匿,大部分患者首次就诊时已是晚期,失去了手术机会,预后较差。以铂类为基础的化疗虽然是治疗晚期非小细胞肺癌的标准用药,但是可引起骨髓抑制、肝肾损害等毒副作用,极大地降低了患者的生存质量[4]。随着肿瘤分子生物学的发展,靶向治疗以其选择性高、副作用小、疗效好的特点[5-7],占据了越来越重要的地位。但是靶向药物价格比较昂贵且并不会使所有的用药患者都受益,只有选择合适的靶点才能为肺癌的个体化治疗提供依据。EGFR基因突变在我国非小细胞肺癌中最常见[8],该靶点的研究也成为最近的热点。目前,EGFR 基因突变检测大多为手术切除石蜡包埋的肿瘤组织标本。对于晚期失去手术机会的肺癌患者很难获得,因此,寻求一种替代标本进行EGFR基因突变检测已成为当务之急。
由于EGFR基因突变有一定的人群优势,多发生在女性、不吸烟、肺腺癌的患者中[9],因此对于体表淋巴结肿大和胸腔积液,应先明确性质和来源。体表淋巴结肿大在晚期肺癌患者中较常见,仅凭肿大淋巴结的位置、外观和影像学检测很难确定其性质,其原发部位也可以是全身各处。胸腔积液也在肺部疾病中较常见,尤其在肺腺癌中更加多见,但常规的细胞学检查主要依赖于癌细胞的形态学特点,由于癌细胞在积液中失去了原有的组织形态,加之间皮细胞受刺激反应性增生也有一些“癌细胞”的形态学特点,因此仅依赖形态学也很难作出判断,这就需要免疫细胞化学辅助诊断。同时在新鲜细胞学标本中可能混有较多的非肿瘤细胞,因此需要一种敏感性高的方法,ARMS 法所需肿瘤组织量小,10 ng基因组背景下突变含量为1%的DNA样本[10],就可以测定EGFR的突变情况。因此通过细针穿刺和抽取胸腔积液获得的新鲜细胞学标本,操作简单易行、损伤小、费用低、可重复性好、标本来源充足且便于收集,一定程度上可以解决标本获取的问题。
本研究的288例新鲜细胞学标本,18~21号外显子总的突变率为45.1%(130/288),与文献[11]报道的EGFR基因的突变率为36.4%~66.3%基本一致。Kasaka等[12]、 Paez等[13]和 Lynch等[14]报道90%的EGFR突变发生在19号外显子和20号外显子上,本研究发生19和21号外显子突变120例,两者之和突变率占92.4%(120/288),与报道也一致。同时结合新鲜细胞学检测的EGFR阳性患者靶向治疗组的客观有效率和无进展生存期优于化疗组,与IPASS研究[15]、NEJGSG002研究[16]、 WJTOG3405研究[17]以 及OPTIMAL研究相同[18],可以得出,新鲜细胞学标本作为EGFR的检测标本结果准确。
综上所述,在临床上无法获得肿瘤细胞标本的情况下,采用新鲜细胞学标本作为该标本的替代标本是行之有效的。
[1] 支修益,石远凯,于金明. 中国原发性肺癌诊疗规范(2015年版)[J]. 中华肿瘤杂志,2015,37(1):67-78.
[2] SHI S,SHI Y,TAYLOR C R. Antigen retrieval imunohisto chemistry:review and future prospects in research and diagnosis over two decades[J]. J Histochem Cytochem,2011,59(1):13-32.
[3] CAO F F,ZHANG L L,WANG S,et al. Comparison of EGFR TKIs and chemotherapy in the treatment of non-small cell lung cancer as a first-line therapy[J]. Chin J Lung Cancer,2015,18(3):146-154.
[4] SCHILL J H, HARRINGTON D, BELANI C P, et al.Comparison of four chemotherapy regimens for advanced nonsmall-cell l ung c ancer[J]. N E ngl J M ed,2002,346(2):92-92.
[5] 卢红阳,蔡菊芬,毛伟敏,等. 非小细胞肺癌辅助靶向治疗研究进展[J]. 肿瘤学杂志,2014,20(1):64-67.
[6] 王明华,刘明亮. 突变非小细胞肺癌一线治疗新进展[J]. 国外医药抗生素分册,2013,34(6):252-256.
[7] 陈晓莉,段秀梅,赵恒飞,等. 分子靶向药物治疗非小细胞肺癌的策略[J]. 中国药房,2014,25(22):2080-2083.
[8] 王荣,石冬琴,谢华,等. 非小细胞肺癌中EGFR基因突变及靶向药物治疗研究进展[J]. 中国药理学通报,2013,29(1):22-26.
[9] 李榕,韩宝惠. EGFR基因突变检测在肺癌中的临床意义[J].临床肿瘤学杂志,2004,9(4):420-425.
[10] 肖越. ARMS法在检测晚期肺腺癌不同小标本中EGFR基因突变的比较[D]. 南昌:南昌大学医学院,2014.
[11] FRANCIS H,SOLOMON B. The current status of targeted therapy for non-small cell lung cancer[J]. Int Med J,2010,40(9):611-618.
[12] KASAKA T,YATABE Y,ENDOH H,et al. Mutations of the epidermal growth fator receptor gene in lung cancer:biological and clinical implications[J]. Cancer Res, 2004, 64(24):8919-8923.
[13] PAEZ J G,JANNE P A,LEE J C,et al. EGFR mutat ions in lung cancer:Correlation with clicical response to gefitinib therapy[J]. Science,2004,304(5676):1497-1500.
[14] YNCH T J,BELL D W,SORDELLA R,et al. Activating mutations in the epidermal growth factor receptor underlying respon siveness of non small cell lung cancer to gefitinib[J]. N Engl J Med,2004,350(21):2129-2139.
[15] MOKTS,WU Y L,THONGPTASER S,et al. Gefitinib or carboplatin-paclitaxel inpulmoary adenocarcinoma[J]. N Eng J Med,2009,361(10):947-957.
[16] MAEMONDO M,INOUE A,KOBAYASHI K,et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. N Engl J Med,2010,362(25):2380-2388.
[17] MITSUDOMI T,MORITA S,YATABE Y,et al. Gefitinib versus cisplatin plusdocetaxel in patients with non-small-cell lung cancer harbouringmutations of the epidermal growth factor receptor:an open label,randomized phase 3 trial[J]. Lancet Oncol,2010,11(2):121-128.
[18] ZHOU C,WU Y L,CHEN G,et al. Erlotinib versus chemotherapy as first-line treatmer for patients with advanced EGFR mutation-positive non-small-cell lung cancer:a multicentre, open-label, randomized, phase 3 study[J].Lancet Oncol,2011,12(8):735-742.

