过表达miR-15b对斑马鱼血管发育的影响
栗晓亮杨 明黄 丽孙华钦许文明伍春莲
(1.西华师范大学生命科学学院 西南野生动植物资源保护教育部重点实验室,四川 南充 637009;2.四川大学华西第二医院 四川大学-香港中文大学生殖医学联合实验室教育部出生缺陷与相关妇儿疾病重点实验室,四川 成都 610041)
0 引 言
MicroRNAs(miRNAs)是一类调控基因表达,自身不参与基因编码的非编码RNA分子,长度在22个碱基左右。虽然miRNA不参与编码蛋白质,但是可通过结合目的mRNA的3'端非翻译区(3'UTR),在转录后调节基因的表达[1-2]。前人研究显示miRNA对细胞增殖、分化、凋亡,血管生成和肿瘤发生等现象具有重要作用[3-5]。此外,miRNA还可以调节早期的胚胎发育过程。斑马鱼做为动物研究的经典模式生物,具有通体透明,发育周期短,操作方便等优点;因此,研究miRNA在斑马鱼胚胎发育过程中的作用成为了关注热点。
miR-15b属于miR-15/107组群中的一员,核酸序列在不同的物种之间具有相对保守性。在人类的各种组织器官均可检测到miR-15/107家族[6]的存在,没有发现明显的组织特异性(空间特异性),但是Bruchova[7]和Nelson[8]针对miR-15/107家族做表达谱的筛查时,发现在红细胞生成和大脑发育过程中miR-15/107家族有发育阶段特异性(时间特异性)。目前研究结果表明,miR-15b在B细胞恶性肿瘤、神经胶质瘤、肝癌、胃癌和肺腺癌等人类恶性肿瘤疾病中表达降低,并且可以作为治疗癌症预后判断的分子靶标[9-12]。在胶质瘤中miR-15b可以靶向调节细胞周期蛋白(cyclin),从而调控细胞周期过程[13];在肝癌和胃癌细胞中miR-15b与Bcl-2的基因表达呈负相关,即可以通过过表达miR-15b下调Bcl-2而诱发癌细胞的凋亡[14-16]。此外,还有研究证明,在人参皂苷促进血管形成过程中miR-15b通过靶向降解血管内皮细胞生长因子受体2(VEGFR2)的mRNA,抑制血管内皮细胞血管的形成[17]。目前尚无miR-15b在斑马鱼的早期胚胎发育和后期血管形成过程中的功能研究。
本研究利用转基因斑马鱼(VEGFR2:GFP)为实验对象,通过尼康体视显微镜进行表型观察,可在体观察血管的发育情况,运用全胚原位杂交(whole mountin situhybridization)、蛋白免疫印迹(western blot)、双荧光素酶报告基因检测(dual-fluorescence reporter system)等技术手段,研究探索miR-15b对斑马鱼血管发育的影响及其机制。
1 材料与方法
1.1 实验材料
试验所用转基因斑马鱼为血管绿色荧光标记斑马鱼(VEGFR2:GFP),饲养3个月后即可产卵。每天定时添加咸水丰年虫充作饲料,照明14h黑暗10h交替,待其能够产出健康鱼卵后,将雌雄斑马鱼放入交配缸内,次日早上 8:00~10:00 时产卵后,将胚胎收集到含有小鱼水的培养皿中,于28℃培养。
试验用HEK293细胞及所用质粒为本实验室保存。
1.2 实验方法
1.2.1 斑马鱼全胚原位杂交
将不同发育时期的斑马鱼胚胎剥去卵膜,收集到1.5mL RNA-Free的EP管中,每管加入10~50个斑马鱼胚胎,利用4%多聚甲醛(PFA)溶液固定过夜(至少12h)。梯度甲醇/PBST水合、蛋白酶K消化后,再使用4%PFA固定10min。弃掉固定液,用PBST洗涤3次,然后在预杂交液中,58℃预杂交3h。接着置于含 20~80 nmol/L 探针(购买自exiqon,Denmark,序列TGTAAACCATGTGCTGCTA)的杂交液中,58℃杂交过夜。于58℃使用2×SSC和0.2×SSC依次洗去未结合的探针,再于室温下经梯度0.2×SSC/PBST溶液洗涤,以含山羊血清的PBST溶液室温封闭探针3h;在稀释5 000倍的抗地高辛抗体(anti-Dig-AP)中,4℃孵育过夜;之后用1×PBST溶液洗去未结合的抗体,然后加入显色溶液(NBT+BCIP溶液)显色1 h,用终止液快速洗去多余的显色液,在尼康体视显微镜下观察拍照并记录。
1.2.2 细胞培养与质粒转染
人胚肾细胞HEK-293培养于含有10%FBS的DMEM高糖培养基中,培养皿置于5%CO2、37℃的孵育箱内。
miR-15b mimic(miR10000784-1-5)购买自锐博生物。
1.2.3 蛋白免疫印迹实验
从不同处理组的293细胞中提取总蛋白,使用BCA法对蛋白样品进行定量检测,使用5×SDS在99℃下煮10min变性处理,调整蛋白上样量一致。用8%的SDS-PAGE凝胶60V恒压30min,进入分离胶后90V恒压90min后,将蛋白转印到聚偏二氟乙烯(PVDF)膜80 V恒压2 h。5%脱脂奶粉室温封闭1 h,一抗(anti-VEGFR2 1∶5000;anti-VEGFa 1∶5000;anti-βtubulin 1∶10 000)4℃孵育过夜,1×TBST 洗膜 3 次,二抗使用偶联辣根过氧化物酶HRP的抗鼠或兔的抗体(1∶10 000)室温孵育 1 h,TBST 洗 3 次,HRP 底物ECL发光液冲淋PVDF膜5min,曝光结果呈现于X光胶片。
1.2.4 双荧光素酶活性检测
1.2.5 数据分析
实验数据使用GraphPad Prism 5软件进行分析与作图,图表数据以平均值±标准差(Mean±SEM)呈现。*表示P<0.05为显著差异;**表示P<0.01为极显著差异;***表示P<0.001。
2 结果与分析
2.1 miR-15b在斑马鱼胚胎发育过程中的时空特异性表达
本实验首先运用斑马鱼全胚原位杂交检测miR-15b在斑马鱼胚胎发育不同时期的时间和空间分布。检测结果见图1,蓝色荧光区域表明miR-15b在胚胎发育早期高水平表达,随着胚胎发育的进行,miR-15b表达水平逐步降低,到24 hpf(hours post-fertilization),检测信号减弱。实验结果显示,miR-15b可能是母源性分子,推测其可能影响斑马鱼胚胎的发育。
2.2 过量表达miR-15b导致斑马鱼血管发生阻滞
本实验利用血管绿色荧光标记斑马鱼(VEGFR2:GFP)模型,研究miR-15b在斑马鱼胚胎发育后期对血管形成能力的影响。将miR-15b MO注射到斑马鱼受精卵内,在胚胎发育早期过量表达miR-15b。实验结果表明(见图2),VEGFR2在斑马鱼整个血管系统内均有表达,在过量表达miR-15b处理组的斑马鱼中,VEGFR2在血管中的表达较弱于阴性对照miR-15b control处理组,并且实验组斑马鱼表现出血管系统的发育畸形(58.4%)远大于阴性对照组的斑马鱼畸形胚胎率18.7%(P<0.05)。实验结果中还揭示了在血管发育畸形的斑马鱼心脏周围没有出现血管簇。
2.3 miR-15b对VEGFR2表达的影响
由于过表达miR-15b会对斑马鱼血管系统有影响,因此在HEK-293细胞内研究miR-15b对VEGFR2的具体作用机制。分别将miR-15b mimic和miR-15b inhibitor转染到HEK-293细胞体内,培养48 h后进行蛋白免疫印迹检测。实验结果表明(见图 3(a),图 3(b)),VEGFR2 基因表达水平与miR-15b基因表达水平呈负相关性,即抑制miR-15b的表达可以升高VEGFR2的表达水平,提高miR-15的表达则降低VEGFR2的表达水平。为了证明miR-15b可以靶向调控VEGFR2 mRNA水平,构建了含有VEGFR2 mRNA 3'UTR的pGL3-basic质粒,运用双荧光素酶报告基因检测技术,分别将miR-15b mimic,mimic control与 VEGFR2 mRNA 3'UTR 共同转染HEK-293细胞48 h后进行检测。双荧光素酶报告基因检测结果显示(见图3(c)),过量表达miR-15b后萤火虫荧光值/海肾荧光值比对照组降低了57.2%,结果提示miR-15b可能通过靶向结合VEGFR2 mRNA 3'UTR来调控VEGFR2的表达。

图1 miR-15b在斑马鱼早期胚胎发育过程中的时空表达
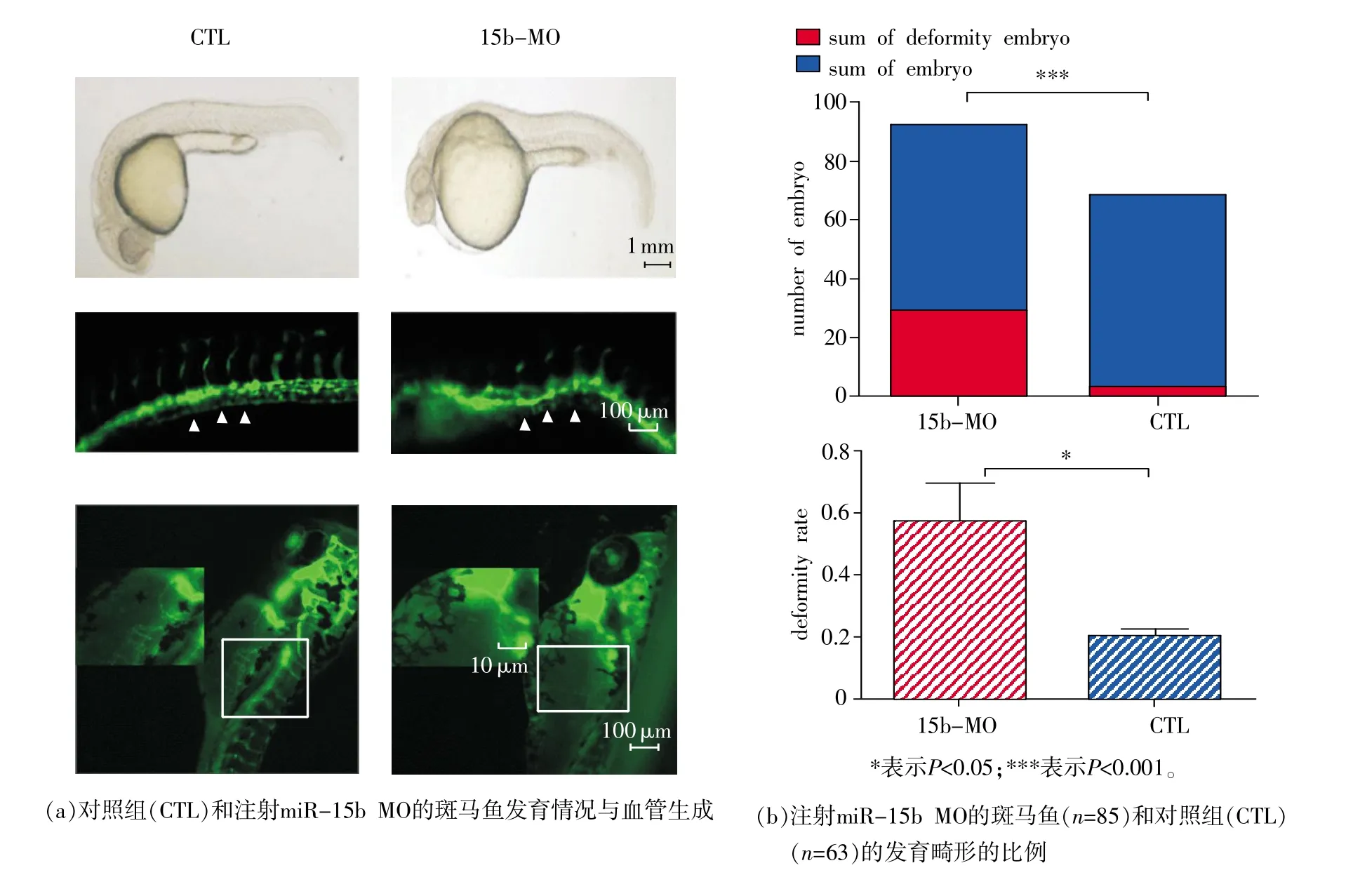
图2 斑马鱼胚胎过表达miR-15b影响斑马鱼血管发育

图3 miR-15b结合VEGFR2 mRNA的3'UTR区调控VEGFR2的表达
3 结束语
miRNA对斑马鱼胚胎发育、细胞分化、细胞凋亡、血管生成以及肿瘤发生等功能具有重要作用。miR-15b通过影响不同基因mRNA的稳定性,从而在基因转录后改变相应基因的表达水平,最终决定斑马鱼胚胎发育的生命历程。斑马鱼作为胚胎发育研究的经典模式生物,已经有miRNA在斑马鱼胚胎发育的表达谱研究[18],但是关于miR-15b对斑马鱼早期胚胎的发育过程中的功能研究报道较为少见,因此本研究对miR-15b对斑马鱼胚胎早期胚胎发育的影响做了一定的基础研究。
本研究利用斑马鱼全胚原位杂交技术发现miR-15b在斑马鱼胚胎早期表达水平最高并且广泛存在,随发育的进行,miR-15b的探针信号逐渐减弱。说明miR-15b是母源性分子并且不具有空间特异性,这与Finnerty[6]研究miR-15家族在人类组织中的分布一致。有报道miR-15b[16]调控细胞凋亡和血管生成,进而导致心血管疾病,由此推测miR-15b或许会影响斑马鱼早期胚胎血管生成过程中有关基因的功能。
本研究利用转基因斑马鱼(VEGFR2:GFP)为模式动物,在体内研究了miR-15b对斑马鱼血管系统早期发育的影响。通过注射miR-15b的类似物导致斑马鱼胚胎血管发育畸形,证实miR-15b的表达异常可导致斑马鱼血管系统发育异常。体外细胞研究结果表明,miR-15b通过调节VEGF下游信号通路分子VEGFR2影响血管系统发育,提示miR-15b的正常表达是斑马鱼胚胎发育良好的重要保证之一。
斑马鱼胚胎的正常发育过程需要不同的基因间精细而又复杂的调控[19],斑马鱼胚胎的发育包括胚胎三胚层的分化,器官的发育和体节的形成等,需要包括Bmp,Wnt和RA等信号通路参与调控。miR-15b通过调节VEGF下游信号通路分子VEGFR2影响血管系统发育,为miRNA影响血管发育的机制提供了新的参考。miR-15b是否还参与调控了其他信号通路需要进一步的深入研究。之后将继续围绕miR-15b寻找其他的靶基因进行实验研究,逐渐揭露miR-15b在斑马鱼胚胎早期发育中的作用机制。
[1]BARTEL D P.MicroRNAs:genomics biogenesis mechanism and function[J].Cell,2004,116(2):281-97.
[2]BARTEL D P.MicroRNAs:target recognition and regulatory functions[J].Cell,2009,136(2):215-233.
[3]PASQUINELLI A E.MicroRNAs and their targets:recognition regulation and an emerging reciprocal relationship[J].Nature Reviews Genetics,2012,13(4):271-282.
[4]XU Q,ZHANG Y,CHEN Y,et al.Identification and differential expression of microRNAs in ovaries of laying and Broody geese(Anser cygnoides) by Solexa sequencing[J].PloS one,2014,9(2):87920.
[5]MENDELL JT,OLSON E N.MicroRNAs in stress signaling and human disease[J].Cell,2012,148(6):1172-1187.
[6]FINNERTY J R,WANG W X,HEBERT S S,et al.The miR-15/107 group of microRNA genes:evolutionary biology cellular functions and roles in human diseases[J].Journal of Molecular Biology,2010,402(3):491-509.
[7]BRUCHOVA H,YOON D,AGARWAL A M,et al.Regulated expression ofmicroRNAsin normaland polycythemia vera erythropoiesis[J].Experimental Hematology,2007,35(11):1657-1667.
[8]NELSON P T,BALDWIN D A,KLOOSTERMAN W P,et al.RAKE and LNA-ISH reveal microRNA expression and localization in archival human brain[J].RNA(New York NY),2006,12(2):187-191.
[9]LOVAT F,FASSAN M,GASPRINI P,et al.miR-15b/16-2 deletion promotes B-cell malignancies[J].Proceedings of the National Academy of Sciences of the United States of America,2015,112(37):11636-11641.
[10]XIA H,QI Y,NG S S,et al.MicroRNA-15b regulates cellcycle progression by targeting cyclinsin glioma cells[J].Biochemical and Biophysical Research Communications,2009,380(2):205-210.
[11]SUN G,YAN S,SHI L,et al.Decreased expression of miR-15b in human gliomas is associated with poor prognosis[J].Cancer Biotherapy&Radiopharmaceuticals,2015,30(4):169-173.
[12]CHEN Y,CHEN J,LIU Y,et al.Plasma miR-15b-5p miR-338-5p and miR-764 as biomarkers for hepatocellular carcinoma[J].Medical Science Monitor:International Medical Journal of Experimental and Clinical Research,2015(21):1864-1871.
[13]OFIR M,HACOHEN D,GINSBERG D.MiR-15 and miR-16 are direct transcriptional targets of E2F1 that limit E2F-induced proliferation by targeting cyclin E[J].Molecular Cancer Research:MCR,2011,9(4):440-447.
[14]AN F,GONG B,WANG H,et al.miR-15b and miR-16 regulate TNF mediated hepatocyte apoptosis via BCL2 in acute liver failure[J].Apoptosis:An International Journal on Programmed Cell Death,2012,17(7):702-716.
[15]GUO C J,PAN Q,LI D G,et al.miR-15b and miR-16 are implicated in activation of the rat hepatic stellate cell:An essential role for apoptosis[J].Journal of Hepatology,2009,50(4):766-778.
[16]LIU Z,YANG D,XIE P,et al.MiR-106b and MiR-15b modulate apoptosis and angiogenesis in myocardial infarction[J].Cellular Physiology and Biochemistry:International Journal of Experimental Cellular Physiology Biochemistry and Pharmacology,2012,29(5/6):851-862.
[17]CHAN L S,YUE P Y,WONG Y Y,et al.MicroRNA-15b contributes to ginsenoside-Rg1-induced angiogenesis through increased expression of VEGFR-2[J].Biochemical Pharmacology,2013,86(3):392-400.
[18]THATCHER E J,BOND J,PAYDAR I,et al.Genomic organization of zebrafish microRNAs[J].BMC Genomics,2008(9):253.
[19]SCHIER A F,TALBOT W S.Molecular genetics of axis formation in zebrafish[J].Annual Review of Genetics,2005(39):561-613.

