低氮对酿酒酵母发酵过程中酯类物质合成的影响
董书甲,秦伟帅,刘灿珍,杨 雪,赵新节*
(1.齐鲁工业大学(山东科学院)山东省微生物工程重点实验室,山东 济南 250353;2.泰山学院 生物与酿酒工程学院,山东 泰安 271021)
在酒精发酵过程中酵母合成葡萄酒中的大部分挥发性物质,这些挥发性物质主要包括醇类、酯类和酸类化合物[1-2]。葡萄酒中酯类物质的含量很少,通常总量<100mg/L,但酯类物质即使浓度较低也很容易被察觉到。酯类物质的成分、含量和比例等发生微小的变化时,都会对葡萄酒的风味产生巨大的影响,因此酯类对葡萄酒的香气具有重要影响[3]。葡萄酒中的酯类物质主要包括乙酸酯和乙基酯,其中乙酸乙酯是葡萄酒中含量较高的乙酸酯,其赋予葡萄酒水果香味,另外含量较高的乙酸酯还有乙酸异戊酯和乙酸苯乙酯,这两种乙酸酯分别赋予葡萄酒香蕉味和玫瑰花香味,形成乙酸酯的酸为乙酸,醇包括乙醇和氨基酸与糖代谢产生的高级醇[4]。葡萄酒中的乙基酯主要有辛酸乙酯、己酸乙酯和癸酸乙酯,它们往往赋予葡萄酒草莓和青苹果的香味[5-7],形成乙基酯的酸来源于碳、氮的生物代谢或者脂肪酸的生物合成[4],醇是乙醇。
氮素是发酵液中重要的组成成分,酵母菌的可同化氮(yeastassimilable nitrogen,YAN)为除脯氨酸外的游离α-氨基氮化合物、铵态氮和小分子多肽[9]。目前较多的研究表明,酿酒酵母进行正常的生长代谢所需要的较合适的氮浓度为380 mg N/L[9-10],低氮处理会改变酵母体内的氮代谢及糖代谢途径,酵母体内许多代谢产物的生成都要有氮代谢及糖代谢途径的参与,其中低氮条件下高级醇的生成量会增加,酯类物质的合成也需要糖代谢及氮代谢下游产物的参与[2]。目前关于酯类物质的研究多只关注发酵结束时酯类物质的最终含量及其影响因素,而关于发酵过程中各种酯类物质的生成规律及低氮对酯类合成的研究较少。本研究以模拟葡萄汁为试验材料,采用顶空固相微萃取-气相色谱-质谱法分析了不同低氮条件下模拟葡萄汁酒精发酵过程中酯类物质的生成规律,并探讨了低氮对酯类物质生成规律及含量的影响,为了解葡萄酒发酵过程中葡萄酒香气的变化及调整氮源含量以提高葡萄酒中酯类物质的含量提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 酵母菌株
酿酒酵母(Saccharomyces cerevisiae)EC1118:上海杰兔工贸有限公司。该酿酒酵母广泛应用于葡萄酒的生产,综合发酵能力强,具有较高的果糖发酵能力,通常能使葡萄酒发酵至干,也能成功进行二次发酵接种。
1.1.2 化学试剂
葡萄糖、果糖、酒石酸、DL-苹果酸、盐酸硫胺素、吡哆醇盐酸盐、L-脯氨酸、MgSO4·7H2O、CaCl2·2H2O、NaCl、MnSO4·H2O、ZnSO4、CuSO4·5H2O、KI、CoCl2·6H2O、H3BO3、NaMoO4·2H2O、NH4Cl:国药集团化学试剂有限公司;肌醇、烟酸、泛酸钙、生物素、麦角甾醇(95%)、油酸钠:上海源叶生物科技有限公司;烟酸、L-谷氨酰胺、L-精氨酸、L-色氨酸、L-丙氨酸、L-谷氨酸、L-丝氨酸、L-苏氨酸、L-天门冬氨酸、L-苯丙氨酸、L-组氨酸、L-甲硫氨酸、L-酪氨酸、L-甘氨酸、L-赖氨酸、L-半胱氨酸、Tween 80:北京索莱宝科技有限公司;L-缬氨酸,L-亮氨酸、L-异亮氨酸:上海阿拉丁生化科技股份有限公司;KH2PO4、KCL、KOH:天津市大茂化学试剂厂;4-甲基-2-戊醇(纯度98%):美国Aldrich公司。
1.1.3 模拟葡萄汁
本试验所用的发酵介质为模拟葡萄汁,其配方参见文献[9,11],并用缓冲液调节其pH至3.3。
葡萄汁中碳源含量:120 g/L葡萄糖、120 g/L果糖、6 g/L酒石酸、6 g/LDL-苹果酸。
模拟葡萄汁中矿物盐含量:750mg/LKH2PO4、272mg/L KCl、250mg/LMgSO4·7H2O、155mg/LCaCl2·2H2O、200 mg/L NaCl、4mg/LMnSO4·H2O、4 mg/LZnSO4、1 mgCuSO4·5H2O、0.4 mg CoCl2·6H2O、1 mg/L H3BO3,1 mg/L NaMoO4·2H2O、1mgKI。
模拟葡萄汁中生长素含量:20 mg/L肌醇、2 mg/L烟酸、1.5 mg/L泛酸钙、0.25 mg/L盐酸硫胺素、0.25 mg/L吡哆醇盐酸盐、0.003 mg/L生物素。
氮源中各组分比例为:18.6%NH4Cl、20.5%L-脯氨酸、16.9%L-谷氨酰胺、12.5%L-精氨酸、6%L-色氨酸、4.9%L-丙氨酸、4%L-谷氨酸、2.6%L-丝氨酸、2.6%L-苏氨酸、1.6%L-亮氨酸、1.5%L-天门冬氨酸、1.5%L-缬氨酸、1.3%L-苯丙氨酸、1.1%L-异亮氨酸、1.1%L-组氨酸、1.1%L-甲硫氨酸、0.6%L-酪氨酸、0.6%L-甘氨酸、0.6%L-赖氨酸、0.4%L-半胱氨酸。
厌氧因子组分:15 mg/L麦角甾醇、5 mg/L油酸钠、0.5 mL/L Tween 80。
1.2 仪器与设备
自动固相微萃取(solid phase microextraction,SPME)进样器、50/30 μm DVB/CAR/PDMS萃取头、7890B气相色谱-5977A型质谱联用仪:美国Supelco公司;DB-WAX毛细管柱(30 m×0.25 mm×0.25 μm):美国J&W公司;SW-CJ-2D型双人无菌工作台:苏州净化设备有限公司;UV-1600PC型紫外分光光度计:上海美谱达仪器有限公司;PHS-3D型pH计:上海精密科学仪器有限公司。
1.3 方法
1.3.1 试验设计
将配制好的180 mgN/L、280 mgN/L、380 mgN/L三种氮源质量浓度的模拟葡萄汁110℃灭菌30 min。将酿酒酵母EC1118在37℃温水中活化30 min,分别以106CFU/mL接种于氮源质量浓度分别为180mgN/L、280mgN/L、380mgN/L的模拟葡萄汁中,发酵温度控制在25℃,以380 mgN/L作为对照组。每个实验设计3个重复。
1.3.2 发酵液理化指标的测定
发酵液理化指标检测严格按照国家标准GB/T15038—2006《葡萄酒、果酒通用分析方法》中的方法进行检测。主要包括残糖、酒精度、总酸、挥发酸、pH值等指标。
1.3.3 酵母菌生长曲线测定
本试验中测定的OD600nm值是酵母菌体在波长600 nm处的吸光度值,以此反映模拟葡萄汁中酵母菌体的数量[12]。发酵启动后,每隔12 h测定一次发酵液的OD600nm值,每组处理做3次重复取平均值。
1.3.4 酯类物质的分析
酯类物质的提取:参照BARBOSA C等[13]的方法进行。在20 mL顶空瓶中,加入8 mL发酵液,2 g NaCl和20 μL的2.00 g/L内标物(4-甲基-2-戊醇),以及转子。放置于45℃的可加热磁力搅拌器上,预热10 min后进行萃取,萃取50 min后进样,解吸10 min。
气相色谱条件:色谱柱为VF-WAXms(30 m×0.32 mm×0.25 μm);升温程序:40℃下保持2 min,然后以6℃/min的速度升到230℃,保持15 min;载气为氦气,平均线速度为25 cm/s,不分流进样。
质谱条件:电子电离(electron ionization,EI)源;电子能量70 eV;离子源温度230℃;检测器温度250℃;质量扫描范围30~400 m/z。
定性分析:用计算机谱库美国国家标准技术研究所(national institute of standards and technology,NIST)14.L进行人工解析定性。
定量分析:采用内标法进行定量分析。
2 结果与分析
2.1 不同氮源浓度下酿酒酵母的生长曲线
3种氮源浓度下酿酒酵母的生长曲线如图1所示。整体而言,酿酒酵母的生长速率随着氮源浓度的增加而加快。由图1可以看出,3种氮源浓度下达到稳定期的时间和稳定期酵母菌体的浓度存在一定差异。氮源质量浓度为280 mg/L(YAN280)和氮源质量浓度为380 mg/L(YAN380)条件下酵母同时在第4天达到稳定期,且稳定期酵母菌体的浓度相差不大;氮源质量浓度为180 mg/L(YAN180)条件下酵母在第5天达到稳定,且菌体浓度明显低于YAN280和YAN380下菌体的浓度,这与孙悦[14]的研究结果相似。这说明低氮胁迫抑制了酵母菌的繁殖速率,并降低了其稳定期的菌体浓度。
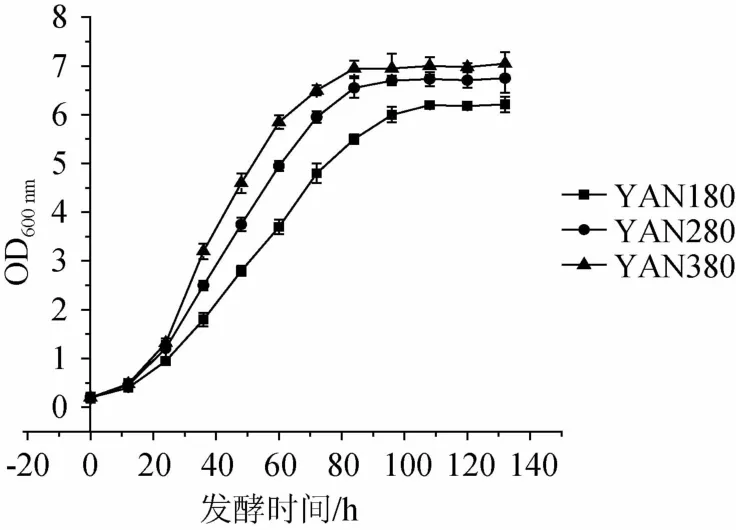
图1 不同氮源浓度对发酵过程中酵母生长量的影响Fig.1 Effects of different nitrogen concentrations on yeast biomass during fermentation
2.2 不同氮源浓度对发酵液理化指标的影响
3种氮源浓度的模拟葡萄汁分别在25℃条件下发酵,发酵结束后对各组发酵液的基本指标(残糖、酒精度、总酸、挥发酸和pH)进行分析检测,结果见表1。由表1可知,三组发酵液中的残糖含量均<4 g/L,其中氮源质量浓度为280 mgN/L的模拟葡萄汁发酵结束后具有较低的残糖含量(3.57 g/L),且其酒精含量为最高(12.41%vol);氮源质量浓度为380 mgN/L的模拟葡萄汁发酵结束后其残糖含量为最高(3.85 g/L),其酒精含量最低(2.41%vol)。氮源浓度为180 mgN/L的发酵液具有较低总酸(9.01 g/L)及挥发酸(0.49 g/L)含量;3种氮源浓度下发酵液pH相差不大。
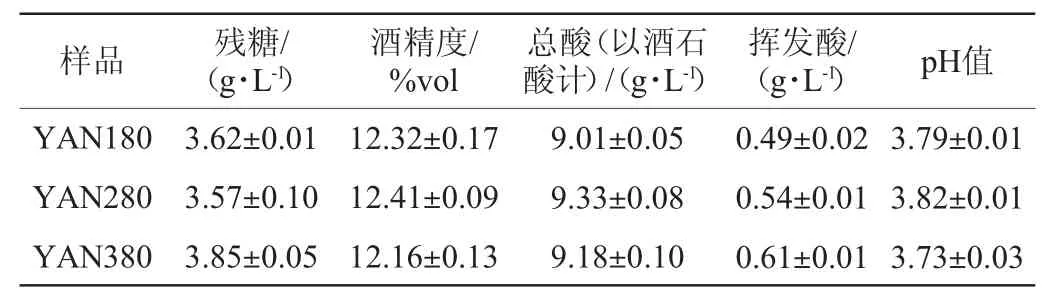
表1 不同氮源浓度对发酵液理化指标的影响Table 1 Effects of different nitrogen concentrations on physicochemical indexes of fermentation must
2.3 不同氮源浓度下酯类物质的生成规律
利用自动固相微萃取-气相色谱-质谱法对3种氮源浓度的发酵液进行酯类物质的定性定量分析,三种氮源浓度下酵母合成的酯类物质的种类没有差别,共有7种,包括3种乙酸酯(乙酸乙酯、乙酸异戊酯、乙酸苯乙酯)和4种乙基酯(丁酸乙酯、己酸乙酯、辛酸乙酯、癸酸乙酯)。发酵结束后发酵液中酯类物质的总量,结果见图2。
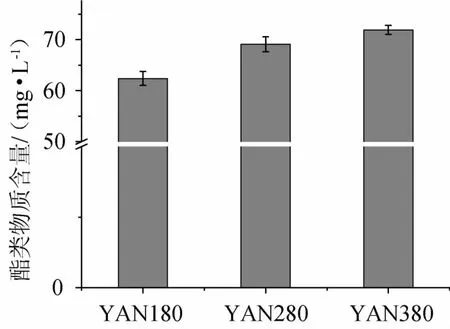
图2 不同氮源浓度发酵液中酯类的总量Fig.2 Total esters content in fermentation must with different nitrogen concentrations
由图2可以看出,酯类物质的总量随着氮源浓度的降低而减少,说明低氮处理会降低发酵液中酯类物质的含量,这可能是低氮处理抑制了中链脂肪酸的生成,也就降低了相应脂肪酸乙酯的含量[8]。同时低氮处理也会抑制醇乙酰基转移酶的合成,从而降低了乙酸酯的生成量[15]。不同氮源浓度发酵液中乙酸酯与乙基酯的含量,结果见图3。
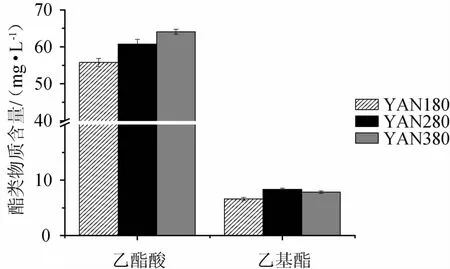
图3 不同氮源浓度发酵液中乙酸酯与乙基酯的含量Fig.3 Contents of acetate and ethyl ester in fermentation must with different nitrogen concentrations
由图3可以看出,3种氮源浓度下酿酒酵母生成的乙酸酯含量(55.77~64.08mg/L)明显高于乙基酯的含量(6.63~8.33 mg/L),这与参与发酵的菌株有关,酿酒酵母通常生成较高含量的乙酸酯,而非酿酒酵母生成乙基酯含量较高[1,16]。另外酿酒酵母合成的各种酯类物质需要穿过细胞膜才能释放到葡萄酒中,其中乙酸酯穿越细胞膜的速率较快,但乙基酯的跨越细胞膜的速度与脂肪酸碳链的长度有关,脂肪酸碳链的越长其转移速率越低,研究表明己酸乙酯可以全部转移到细胞外,而癸酸乙酯只有8%~17%的释放量[17]。
醇乙酰基转移酶途径和酯酶途径是乙酸酯合成的两条主要途径[18]。乙酸酯的酯酶途径是一个可逆反应,乙酸酯的合成与分解都可以由酯酶催化[19]。发酵过程中乙酸乙酯、乙酸异戊酯及乙酸苯乙酯的动态变化结果见图4。
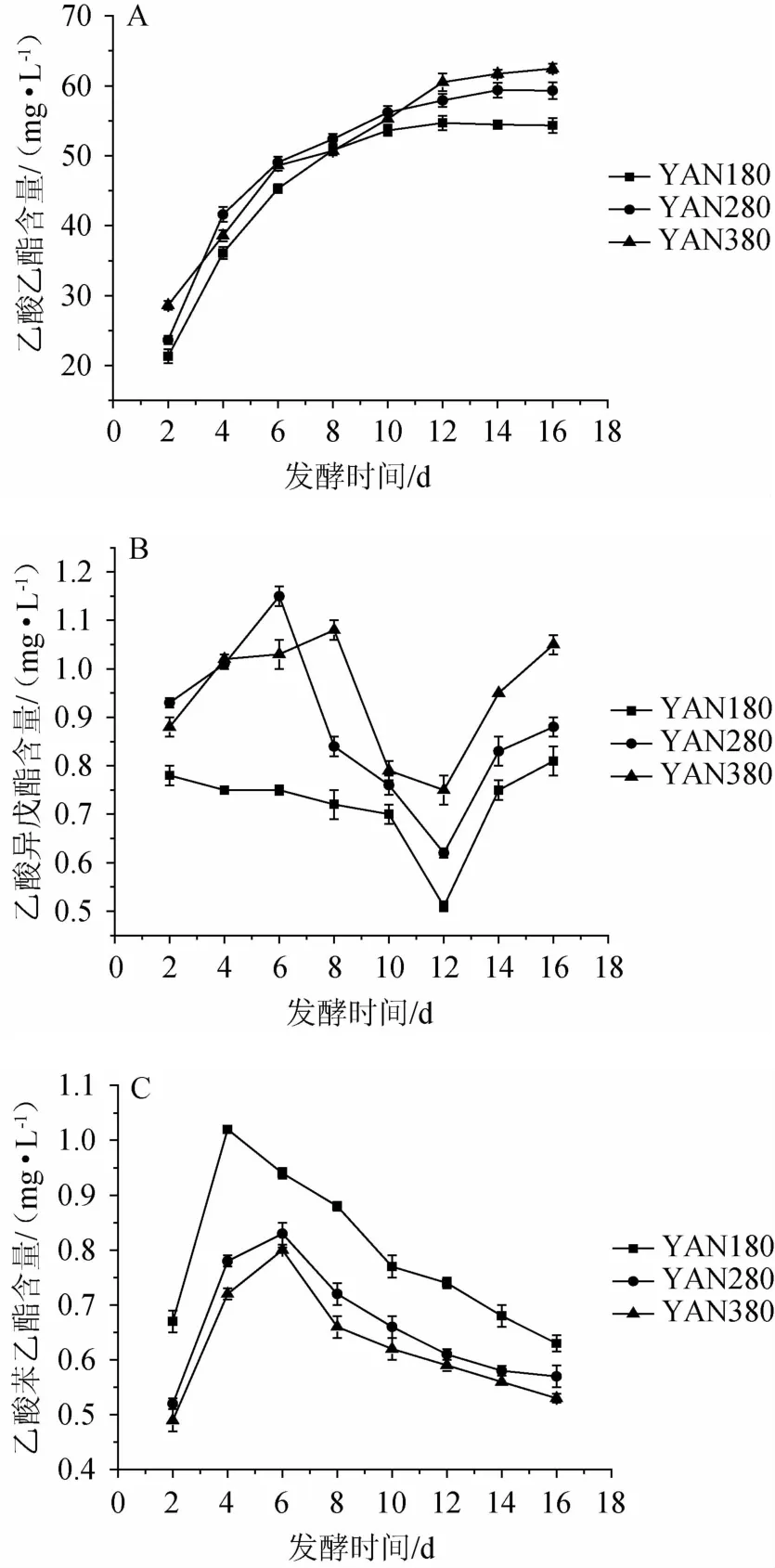
图4 发酵过程中乙酸乙酯(A),乙酸异戊酯(B)及乙酸苯乙酯(C)的动态变化Fig.4 Dynamic changes of ethyl acetate(A),isoamyl acetate(B)and phenethyl acetate(C)during the fermentation
由图4A可知,乙酸乙酯在发酵过程中的生成趋势在3种氮源浓度下是相似的,其含量在发酵过程中逐渐增加,其中发酵前期(发酵前4 d)乙酸乙酯的生成速率较快,平均每天增加9.03~10.40 mg/L,随着发酵的进行其含量逐渐稳定,氮源质量浓度为180 mg/L的发酵液中乙酸乙酯的含量在发酵12d后逐渐稳定在54mg/L,氮源质量浓度为280mg/L和380 mg/L的发酵液中乙酸乙酯的含量在发酵14 d后分别稳定在54mg/L和62mg/L。由图4B可知,氮源质量浓度为280 mg/L和380 mg/L的发酵液中乙酸异戊酯的含量分别在第6天和第8天达到最大值后又逐渐降低,3种氮源浓度的发酵液在第12d达到最低值后又迅速增加。由图4C可知,随着发酵的进行氮源质量浓度为180 mg/L的发酵液中乙酸苯乙酯的含量在第4天达到一个峰值(1.02 mg/L),氮源质量浓度为280 mg/L和380 mg/L的发酵液中乙酸苯乙酯的含量在第6天达到峰值(0.83 mg/L、0.80 mg/L),随后其含量缓慢降低。在发酵过程中酵母会合成各种酯类,同时由于发酵液的pH和酯酶的存在也会导致酯类的水解[2,8],在各个发酵阶段酯类的含量都是水解与合成平衡的结果。研究表明酯酶的水解作用要远大于合成作用,对于不同的乙酸酯其水解效果也不同,在发酵中后期乙酸异戊酯和乙酸苯乙酯含量的波动的较大,而乙酸乙酯的含量相对稳定,这可能是由于酯酶对乙酸异戊酯和乙酸苯乙酯的水解能力大于其对乙酸乙酯的水解能力[20]。发酵结束时YAN180的发酵液中乙酸乙酯和乙酸异戊酯的含量明显低于YAN280和YAN380的发酵液中乙酸乙酯和乙酸异戊酯的含量,而YAN180的发酵液中乙酸苯乙酯的含量明显高于YAN280和YAN380的发酵液中乙酸苯乙酯的含量,这可能是由于低氮胁迫改变了糖代谢途径中α-酮酸的代谢路径,从而导致相应高级醇含量的变化,进而影响了相应的乙酸酯的含量[8]。
在酵母体内,乙醇酰基转移酶和乙醇己酰转移酶催化脂肪酸和乙醇生成乙基酯[21]。在发酵过程中丁酸乙酯、己酸乙酯、辛酸乙酯及癸酸乙酯含量变化,结果见图5。由图5A可知,3种氮源浓度的发酵液中丁酸乙酯的含量在第8天达到最大值后逐渐降低。乙醇酰基转移酶和乙醇己酰转移酶同时具有合成与水解作用[8],在发酵前期这两种酶可能对丁酸乙酯主要起到合成作用,当丁酸乙酯的含量达到最大时,这两种转移酶主要通过其水解作用调节丁酸乙酯在葡萄酒中含量的平衡。由图5B、图5C可知,己酸乙酯和辛酸乙酯的含量随着发酵的进行逐渐增加,其中己酸乙酯在发酵前期(发酵前10 d)其含量增加缓慢,在发酵后期迅速增加,而在发酵前期(发酵前6 d)辛酸乙酯的生成速率(平均每天增加0.54~0.6 mg/L)明显高于其在发酵后期(发酵6~16 d)的生成速率(平均每天增加0.11~0.15 mg/L)。由图5D可知,其含量随着发酵的进行逐渐增加,3种氮源浓度的模拟葡萄汁中癸酸乙酯的含量在发酵6~10 d达到相对稳定的含量(0.12~0.14 mg/L),YAN180和YAN280的发酵液中癸酸乙酯的含量在发酵后期又出现了一个缓慢增加的趋势,其发酵结束时的含量分别达到了0.23 mg/L、0.17 mg/L。发酵结束时丁酸乙酯的含量随着氮源浓度的降低而降低,由0.20 mg/L降低至0.11 mg/L;YAN180的发酵液中己酸乙酯的含量(2.19 mg/L)明显低于YAN280和YAN380的发酵液中己酸乙酯的含量(3.05mg/L);癸酸乙酯的含量随着氮源浓度的降低逐渐增加,其含量由0.13 mg/L增加至0.23 mg/L,这可能是由于低氮处理改变了相应脂肪酸的代谢[8,22]。

图5 发酵过程中丁酸乙酯(A)、己酸乙酯(B)、辛酸乙酯(C)及癸酸乙酯(D)的动态变化Fig.5 Dynamic changes of ethyl butyrate(A),ethyl hexanoate(B),ethyl octanoate(C)and ethyl caprate(D)during fermentation
3 结论
本试验研究结果表明,低氮胁迫抑制了酵母菌的繁殖速率,并降低了其稳定期的菌体浓度。三种氮源浓度下酵母合成的酯类物质的种类没有差别,共有7种,包括3种乙酸酯和4种乙基酯。低氮胁迫下酯类物质的总量降低,氮源质量浓度为380mg/L的发酵液中酯类物质的总量为71.9mg/L,氮源质量浓度为180 mg/L的发酵液中酯类物质的总量为62.4 mg/L。3种氮源浓度下酿酒酵母生成的乙酸酯含量(55.77~64.08mg/L)明显高于乙基酯的含量(6.63~8.33mg/L)。总体来说,低氮并没有改变这7种酯类物质的生成规律,但影响了发酵结束时酯类物质的含量。乙酸乙酯、己酸乙酯、辛酸乙酯和癸酸乙酯的含量在发酵过程中逐渐增加。随着发酵的进行3种氮源浓度的发酵液中丁酸乙酯的含量在发酵第8天达到最大值后逐渐降低。乙酸苯乙酯的含量在发酵前期(发酵4~6 d)迅速达到一个峰值,随后其含量缓慢降低。随着发酵的进行乙酸异戊酯的含量先增加后降低,在发酵12 d时达到最低值后又迅速增加。低氮胁迫下增加了乙酸苯乙酯和癸酸乙酯的生成量,降低了乙酸乙酯、乙酸异戊酯、丁酸乙酯和己酸乙酯的含量。因此,当可同化氮含量为380 mg/L时,将会促进酯类物质的生成,在葡萄酒的生产过程中可适当提高可同化氮含量来提升葡萄酒花果香气,尽量避免低氮胁迫;发酵过程中各种酯类化合物含量的动态变化为理解葡萄酒发酵过程中的香气变化提供了理论支撑。
[1]刘峻溪.酿酒酵母酯类代谢关键酶对葡萄酒中相关挥发性物质的影响[D].济南:齐鲁工业大学,2016.
[2]BELL S J,HENSCHKE P A.Implications of nitrogen nutrition for grapes,fermentation and wine[J].Aust J Grape Wine Res,2005,11(3):242-295.
[3]PINEAU B,BARBE J,VAN LEEUWEN C.Examples of perceptive interactions involved in specific"red-"and"black-berry"aromas in red wines[J].J Agr Food Chem,2009,57(9):3702-3708.
[4]郝瑞颖,王肇悦,张博润,等.葡萄酒中酿酒酵母产生的重要香气化合物及其代谢调控[J].中国食品学报,2012,12(11):121-127.
[5]韦广鑫,杨笑天,周永文,等.葡萄酒中酯类化合物研究进展[J].食品工业科技,2015,36(14):394-399.
[6]BOULTON R B,SINGLETON V L,BISSON L F,et al.Principles and practices of winemaking[M].New York:Springer,1999:26-29.
[7]苗丽平,赵新节,董书甲,等.商业酵母对马瑟兰干红葡萄酒香气成分的影响[J].中国酿造,2016,35(10):56-61.
[8]UGLIANO M,HENSCHKE P A.Yeast and wine flavour[M]//Wine chemistry and biochemistry.New York:Springer,2009:313-392.
[9]VARELA C,PIZARRO F,AGOSIN E.Biomass content governs fermentation rate in nitrogen-deficient wine musts[J].Appl Environ Microbiol,2004,70(6):3392-3400.
[10]SALMON J M,BARRE P.Improvement of nitrogen assimilation and fermentation kinetics under enological conditions by derepression of alternative,nitrogen-assimilatory pathways in an industrial,Saccharomyces cerevisiaestrain[J].Appl Environ Microbiol,1998,64(10):3831-3837.
[11]潘 婷.模拟汁中可同化氮和还原糖对酵母酒精发酵和香气成分的影响[D].杨凌:西北农林科技大学,2015.
[12]曹国珍,缪建顺,张苗苗,等.分光光度法测定酿酒酵母细胞悬液浓度研究[J].中国酿造,2014,33(4):129-133.
[13]BARBOSA C,FALCO V,MENDES-FAIA A,et al.Nitrogen addition influences formation of aroma compounds,volatile acidity and ethanol in nitrogen deficient media fermented bySaccharomyces cerevisiae,wine strains[J].J Biosci Bioeng,2009,108(2):99-104.
[14]孙 悦.不同氮素水平对酿酒酵母混合发酵特征的影响及其代谢物研究[D].杨凌:西北农林科技大学,2015.
[15]YOSHIMOTO H,FUJIWARA D,MOMMA T,et al.Characterization of theATF1,andLg-ATF1,genes encoding alcohol acetyltransferases in the bottom fermenting yeastSaccharomyces pastorianus[J].Yeast,1999,15(5):409-417.
[16]MENDES-FERREIRA A,MENDES-FAIA A,LEAO C.Growth and fermentation patterns ofSaccharomyces cerevisiaeunder different ammonium concentrations and its implications in winemaking industry[J].J Appl Microbiol,2004,97(3):540-5.
[17]NYKANEN L,NYKANEN I.Production of esters by different yeast strains in sugar fermentation[J].J Inst Brew,1977,83(1):30-31.
[18]LIU S Q,HOLLAND R,CROW V L.Esters and their biosynthesis in fermented dairy products:a review[J].Int Dairy J,2004,14(11):923-945.
[19]ELMI F,LEE H T,HUANG J Y,et al.Stereoselective esterase from Pseudomonas putidaIFO12996 reveals alpha/beta hydrolase folds for D-beta-acetylthioisobutyric acid synthesis[J].J Bacteriol,2005,187(24):8470-8476.
[20]LILLYI M,BAUER F F,LAMBRECHTS M G,et al.The effect of increased yeast alcohol acetyltransferase and esterase activity on the flavour profiles of wine and distillates[J].Yeast,2006,23(9):641-659.
[21]SAERENS S M G,VERSTREPEN K J,LAERE V,et al.TheSaccharomyces cerevisiaeEHT1 and EEB1 genes encode novel enzymes with medium-chain fatty acid ethyl ester synthesis and hydrolysis capacity[J].J Biol Chem,2006,281(7):4446-4456.
[22]VILANOVA M,UGLIANO M,VARELA C,et al.Assimilable nitrogen utilisation and production of volatile and non-volatile compounds in chemically defined medium bySaccharomyces cerevisiaewine yeasts[J].Appl Microbiol Biot,2007,77(1):145-157.

