自然发酵肉制品中乳酸菌的体外降胆固醇特性
云月英,马宇南,王文龙
(1.内蒙古科技大学 生命科学与技术学院,内蒙古 包头 014010;2.内蒙古科技大学 后勤处,内蒙古 包头 014010)
胆固醇在人体内具有重要的生理作用,但血清胆固醇水平过高会增加心血管疾病的患病风险[1-2]。近年来,随着国民生活方式和膳食结构类型的转变,我国居民心血管疾病的患病率持续上升,对人体健康造成了巨大的影响,成为城乡居民死亡的首要原因[3]。据报道,血清胆固醇水平下降1%,冠心病的患病风险可降低2%~3%[4]。所以,选择恰当的方法降低膳食及血清中胆固醇的水平尤为重要。
利用微生物降胆固醇因具有高效、低成本、安全性高等特点,受到研究者的广泛关注[5]。乳酸菌是发酵肉制品生产中最常用的发酵剂,研究表明其中的一些菌株具有高效降胆固醇的能力,如植物乳杆菌[6-7]、戊糖片球菌[8]、消化乳杆菌[9]等。目前认为,乳酸菌主要通过共沉淀作用、菌体对胆固醇的同化吸收作用以及两者协同作用等方式来发挥其降胆固醇的功效[10]。因此,选育具有降低胆固醇能力的乳酸菌菌株,并对其机制进行研究,对于乳酸菌在功能性发酵肉制品中的应用具有重要的意义[11]。
本研究通过邻苯二甲醛法测定胆固醇的含量,对来源于自然发酵肉制品中的乳酸菌的体外降胆固醇特性进行初步研究,筛选出降胆固醇性能优良的菌株并进行鉴定,为功能性肉制品发酵剂的开发提供科学依据。
1 材料与方法
1.1 材料与试剂
菌株:从自然发酵肉制品中分离筛选[12],编号为M5、M6、M7、M8、M9、M12、M14、M15、M16、M18、M21、M23、M24。
邻苯二甲醛、蔗糖脂肪酸酯:北京索莱宝科技有限公司;牛胆盐:天津风船化学试剂科技有限公司;胆固醇:美国Sigma公司。所有试剂均为分析纯。
MRS肉汤培养基:广东环凯微生物科技有限公司。
高胆固醇MRS液体培养基:胆固醇0.1 g,蔗糖脂肪酸酯0.1 g,牛胆盐0.2 g,1 mL吐温-80,置于小烧杯中,搅拌均匀,加入5 mL冰乙酸,60℃水浴中溶解,超声波间歇处理15 min,快速加入1 000 mL MRS肉汤培养基中,即为含0.1 mg/mL胆固醇胶束的高胆固醇MRS液体培养基[13]。
1.2 仪器与设备
PSX智能型恒温恒湿培养箱:宁波莱福科技有限公司;SW-CJ-2FD洁净工作台:上海博讯实业有限公司医疗设备厂;F200显微镜:上海长方光学仪器厂;R20BC台式高速冷冻离心机:湖南凯达科学仪器有限公司;YXQ-LS-30SII立式压力灭菌器:上海东亚压力容器制造有限公司;JA5003电子分析天平:上海超平科技仪器有限公司;UV-7504单光束-可见分光光度计:上海欣茂仪器有限公司;JY92-IIN超声波细胞粉碎机:宁波新芝生物科技股份有限公司;CX-AG050厌氧罐:上海川翔生物科技有限公司。
1.3 方法
1.3.1 降胆固醇乳酸菌的初筛
供试菌液按4%(V/V)的接种量接种于高胆固醇MRS液体培养基中,37℃厌氧培养24h,离心(12000r/min、4℃、10 min),测定上清液中胆固醇的含量,以未接菌的高胆固醇MRS液体培养基为对照,计算胆固醇去除率[14]。
1.3.2 菌体的同化吸收及共沉淀试验
供试菌液按4%(V/V)的接种量接种于高胆固醇MRS液体培养基中,37℃厌氧培养24h,离心(12000r/min、4℃、10min),取上清液;倾出剩余上清液,加入0.1mol/L、pH7.0的Na2HPO4/NaH2PO4缓冲液5 mL,混匀后离心(12 000 r/min、4℃、10 min),取上清液为菌体洗涤液;倾出剩余菌体洗涤液,再加入0.1mol/L、pH7.0的Na2HPO4/NaH2PO4缓冲液5mL,于冰浴条件下超声波破碎细胞,离心(12 000 r/min、4℃、10min),取上清液为菌体破碎液。以未接种的高胆固醇MRS液体培养基为对照,分别测定上清液、洗涤液和破碎液中的胆固醇含量[14]。
1.3.3 胆盐对菌体降胆固醇能力的影响
将上述高胆固醇MRS液体培养基中牛胆盐的添加量调整为0、3g,其他成分不变,即得胆盐质量浓度为0、0.3g/100mL的高胆固醇MRS液体培养基。供试菌液按4%(V/V)的接种量分别接种于这两种培养基中,37℃厌氧培养24 h,离心(12 000 r/min、4℃、10 min),测定上清液中胆固醇含量,以未接菌的高胆固醇MRS液体培养基为对照,计算胆固醇去除率[15]。
1.3.4 菌体细胞对超声波的抗性
供试菌液按4%(V/V)的接种量分别接种于MRS液体培养基、胆盐质量浓度为0和0.3 g/100 mL的高胆固醇MRS液体培养基中,37℃厌氧培养24h,离心(12000r/min、4℃、10 min),收集菌体,用5 mL无菌生理盐水悬浮,菌悬液置于冰浴条件下进行超声破碎,取破碎前后的菌悬液,采用平板计数法,计算菌体存活率[16]。
1.3.5 热灭活细胞和休眠细胞的降胆固醇作用
取等量供试菌液,一份121℃灭菌15 min,离心(12 000 r/min、4℃、10 min),收集菌体,然后加入5 mL高胆固醇MRS液体培养基;另一份同样条件下离心,菌体重悬浮于5 mL含相同浓度胆固醇胶束的0.05 mol/L,pH 6.8的磷酸盐缓冲液中。空白不接种菌体,37℃厌氧培养24 h,离心(12 000 r/min、4℃、10 min),测定上清液中胆固醇含量,计算胆固醇去除率[17]。
1.3.6 16S rRNA分子生物学鉴定
采用Axygen细菌基因组DNA小量制备试剂盒提取细菌基因组DNA。以细菌基因组DNA为模版,用通用引物27F(5′-AGAGTTTGATCCTGGCTCAG-3′)和1492R(5′-CTACGGCTACCTTGTTACGA-3′)进行16S rRNA基因序列扩增。聚合酶链式反应(polymerase chain reaction,PCR)条件:95℃、5 min;95℃、30 s,58℃、30 s,72℃、90 s,35个循环;72℃、7 min。PCR产物经凝胶电泳分析后送上海派森诺生物科技股份有限公司测序,测序结果在NCBI基因库中进行BLAST同源性分析。
1.3.7 测定方法
胆固醇含量的测定:根据参考文献[18]的方法进行测定,其计算公式如下:
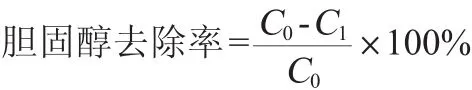
式中:C0为未接种菌株培养基中胆固醇含量,μg/mL;C1为实验菌株发酵上清液中胆固醇含量,μg/mL。

式中:N0为超声波破碎前菌悬液的活菌数,CFU/mL;N1为超声波破碎后菌悬液的活菌数,CFU/mL。
2 结果与分析
2.1 降胆固醇乳酸菌初筛结果
待测菌株对培养基中胆固醇的去除率如表1所示。
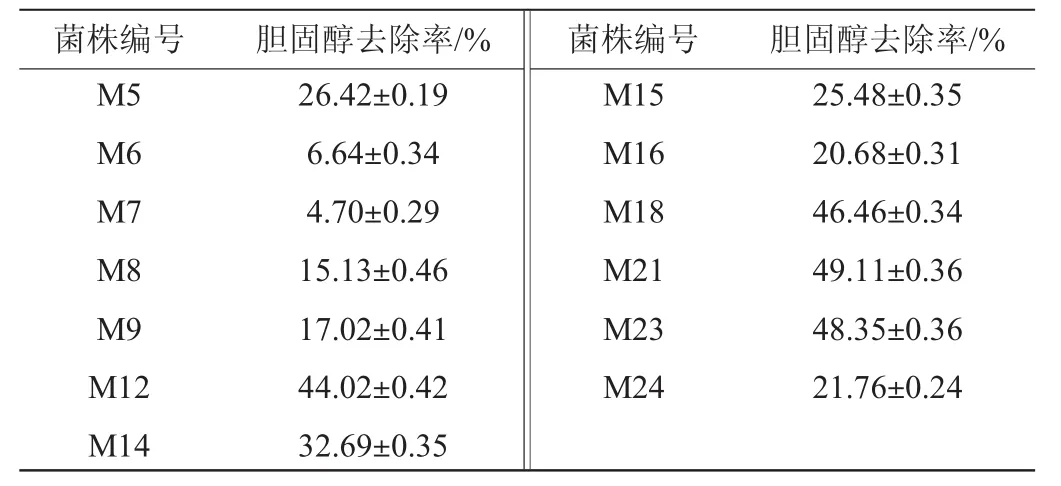
表1 乳酸菌降胆固醇能力Table 1 Cholesterol-degrading capability of lactic acid bacteria
由表1可知,不同菌株的降胆固醇能力有很大的差异,胆固醇去除率为4.70%~49.11%,其中菌株M12、M18、M21和M23的去除率>40%。乳酸菌对胃肠道的耐受性是其发挥生理功能的关键因素[19]。菌株耐受性实验表明,菌株M12和M23分别在pH值为3.0的MRS液体培养基、含0.3g/100mL胆盐的MRS液体培养基以及人工模拟胃肠道环境中显示出较好的耐受性,而M18和M21的耐受性较差。综合以上结果,选择菌株M12和M23为目标菌株,对其降胆固醇的机理进行初步的探讨。
2.2 菌体的同化吸收及共沉淀试验

图1 菌株M12、M23培养液各部分的胆固醇含量Fig.1 Cholesterol contents in all parts of culture solution of strains M12 and M23
由图1可知,原培养液中23.20%和30.10%的胆固醇存在于受试菌体的洗涤液中,25.26%和19.40%的胆固醇存在于菌体破碎液中。菌体洗涤液中的胆固醇主要来自胆盐与胆固醇的共沉淀,破碎液中的胆固醇主要来自菌体细胞对胆固醇的同化吸收。因此,这两株菌都是依靠同化吸收作用与胆盐共沉淀作用协同来降低培养基中的胆固醇含量,且菌株M23的共沉淀作用高于同化吸收作用。
2.3 胆盐对菌体降胆固醇能力的影响
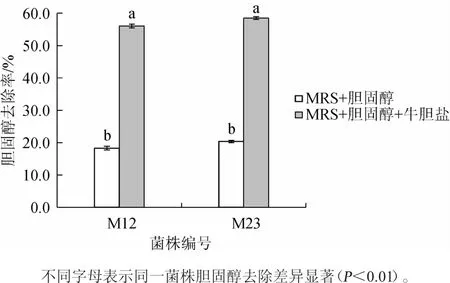
图2 牛胆盐对菌株M12、M23降胆固醇能力的影响Fig.2 Effect of bile salt on cholesterol-degrading capability of strains M12 and M23
研究表明[20-21],添加一定量的胆盐可与胆固醇发生共沉淀作用,同时还可以增加菌体细胞的通透性,利于其对胆固醇的吸收,从而提高菌体细胞的降胆固醇能力。通常认为人体肠道胆盐浓度平均为0.3g/100mL[22]。因此,在培养基中添加0.3 g/100 mL的牛胆盐研究其对菌体去除胆固醇能力的影响。由图2可知,在不添加胆盐时,菌株M12和M23的胆固醇去除率仅为18.29%和20.36%;当添加0.3 g/100 mL的牛胆盐时,菌株对胆固醇的去除能力显著升高(P<0.01),去除率分别为56.05%和58.49%。
2.4 菌体对超声波的抗性
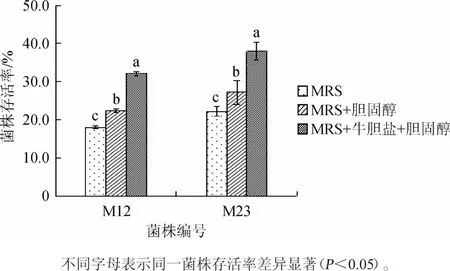
图3 菌株M12、M23对超声波的抗性Fig.3 Resistance of strains M12 and M23 to ultrasonic wave
由图3可知,菌株M12和M23在3种培养基中对超声波的耐受性有明显的差异(P<0.05),在未添加胆固醇的培养基中存活率仅为18.00%和22.22%,在加入胆固醇的培养基中存活率提高为22.45%和27.21%,这可能与菌体细胞吸收胆固醇,增强细胞膜的抗性有关[23]。在同时添加胆固醇和牛胆盐的培养基中菌株的存活率进一步提高,可达到32.09%和37.93%,可能是因为添加胆盐可增强菌体对胆固醇的吸收,从而使细胞膜的抗性更强,这与上述实验中添加胆盐提高了菌体对胆固醇的去除能力结果相符。
2.5 热灭活菌体和休眠菌体的降胆固醇作用
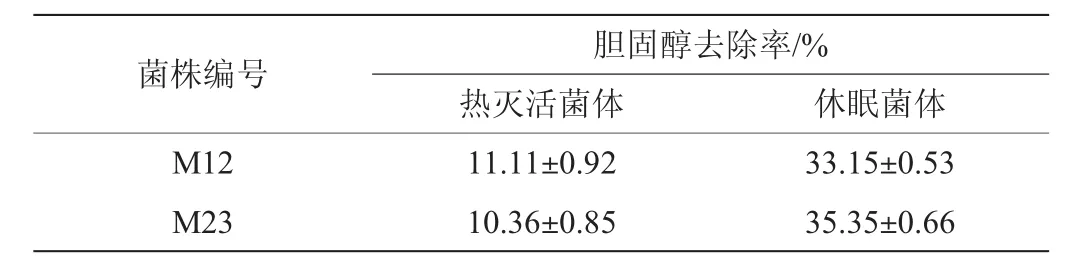
表2 热灭活菌体和休眠菌体的降胆固醇作用Table 2 Cholesterol-degrading capability of the thermal inactivated cells and dormant cells
由表2可知,菌株M12和M23的休眠菌体对胆固醇的去除率较高,虽然与上述活菌体相比有一定的下降,但仍可达到30%以上。热灭活菌体也具有一定的去除胆固醇的能力,但去除率较低,仅为10%左右。以上结果表明菌体细胞的降胆固醇作用与其生长状态有关,菌体细胞生长越旺盛,降胆固醇能力越强,这与刘长建等[24]报道的结论一致。
2.6 菌株16S rRNA序列分析
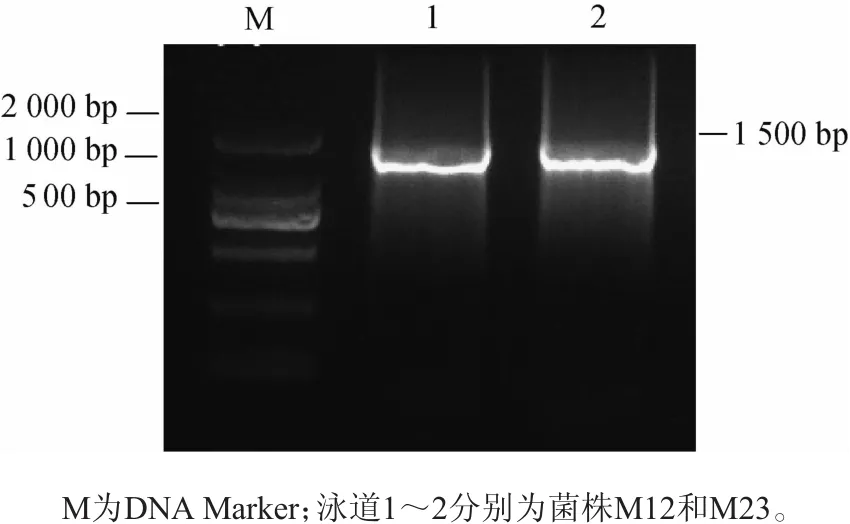
图4 菌株M12、M23的PCR产物电泳图Fig.4 Electrophoretograms of PCR products of strains M12 and M23
由图4所示,对菌株M12、M23的PCR产物进行电泳分析,得到大小约为1 500 bp的特异性扩增产物,测序片段长度分别为1 496 bp、1 509 bp,符合16S rRNA序列长度。将获得的序列在NCBI上进行BLAST同源性分析,这2株菌分别与弯曲乳杆菌(Lactobacillus curvatus)和戊糖片球菌(Pediococcus pentosaceus)有99%的同源性。因此确定菌株M12为弯曲乳杆菌(Lactobacillus curvatus),菌株M23为戊糖片球菌(Pediococcus pentosaceus)。
3 结论
对自然发酵肉制品中分离出的13株乳酸菌的体外降胆固醇能力进行了测定,结果显示其去除率差别较大,为4.70%~49.11%。选择其中胆固醇去除率较高且耐受性较好的2株菌作为目标菌株,进一步探讨其降胆固醇的作用机理。通过研究发现,2株菌的降胆固醇机制为同化吸收和共沉淀协同作用;添加0.3 g/100 mL胆盐可显著增加菌体对胆固醇的去除作用(P<0.01),去除率分别为56.05%和58.49%;添加胆固醇和胆盐均可显著提高菌株经超声波处理后的存活率(P<0.05),存活率分别为32.09%和37.93%;2株菌的热灭活菌体和休眠菌体也具有一定的胆固醇去除能力,且休眠菌体的去除率高于热灭活菌体。经16SrRNA序列分析,菌株M12为弯曲乳杆菌(Lactobacillus curvatus),菌株M23为戊糖片球菌(Pediococcus pentosaceus)。对于菌株M12和M23的降胆固醇影响因素、体内降胆固醇能力及作为发酵剂在肉制品中的应用等问题,仍需进一步研究。
[1]任衍钢,宋玉奇.胆固醇的发现与认识历程[J].生物学通报,2012,47(10):59-62.
[2]于志会.益生性降胆固醇植物乳杆菌的筛选、发酵特性及体内功效研究[D].长春:吉林大学,2013.
[3]陈伟伟,王 文,隋 辉,等.《中国心血管病报告2016》要点解读[J].中华高血压杂志,2017,25(7):605-608.
[4]MANSON J E,TOSTESON H,RIDKER P M,et al.The primary prevention of myocardial infarction[J].New Engl J Med,1992,326(21):1406-1416.
[5]黄润庭,李宗军,伍 婧.几种常见微生物降胆固醇机制探讨[J].食品工业科技,2015,36(6):385-390.
[6]LEE J,PYUN C,HONG G,et al.Effects of Kimchi powder orLactobacillus plantarumadded fermented sausages on serum lipid and cholesterol levels in rats[J].Korean J Food Sci Anim Resour,2013,33(4):435-438.
[7]JIN Z,DUAN Y,TONG L,et al.Screening ofLactobacilluswith cholesterol-lowering activity and its application in inner mongolian fermented sausages[J].食品科学,2015,36(5):99-103.
[8]KANTACHOTE D,RATANABUREE A,SUKHOOM A,et al.Use of γ-aminobutyric acid producing lactic acid bacteria as starters to reduce biogenic amines and cholesterol in Thai ermented pork sausage(Nham)and their distribution during fermentation[J].LWT-Food Sci Technol,2016,70:171-177.
[9]丁 苗,刘 洋,葛平珍,等.发酵酸肉中降胆固醇乳酸菌的筛选、鉴定及降胆固醇作用[J].食品科学,2014,35(19):203-207.
[10]蒲 博,张驰翔,王 周,等.乳酸菌降胆固醇作用及其机理的研究进展[J].中国酿造,2014,33(7):5-9.
[11]张春晖.发酵肉制品加工技术[M].北京:中国农业出版社,2014:5-6.
[12]云月英,许 铭,王文龙,等.自然发酵肉制品中乳酸菌的筛选[J].肉类研究,2017,31(6):19-23.
[13]赖 文,刘书亮,张倩颖,等.降胆固醇乳酸菌鉴定及其在体外模拟胃肠环境中抗性研究[J].中国酿造,2011,30(3):90-93.
[14]王立平.内蒙古传统酸马奶酒中乳杆菌潜在益生特性的研究[D].呼和浩特:内蒙古农业大学,2005.
[15]尹军霞,沈国娟,谢亚芳.分离自酸菜汁的乳酸乳球菌体外去除胆固醇特性[J].食品与生物技术学报,2009,28(6):850-853.
[16]郭 翔.降胆固醇益生乳酸菌筛选及其功能机理的研究[D].无锡:江南大学,2009.
[17]LYE H S,RAHMAT-ALI G R,LIONG M T.Mechanisms of cholesterol removal by lactobacilli under conditions that mimic the human gastrointestinal tract[J].Int Dairy J,2010,20(3):169-175.
[18]RUDEL L L and MORRIS M D.Determination of cholesterol using o-phthalaldehyde[J].J Lipid Res,1973,14(3):364-366.
[19]胡爱华,敖晓琳,陈 岑,等.乳酸菌耐酸耐胆盐机制的研究进展[J].食品工业科技,2015,36(8):380-383,389.
[20]TAHRI K,GRILL J P,SCHNEIDER F.Involvement of trihydroxy conjugated bile salts in cholesterol assimilation by Bifidobacteria[J].Currt Microbiol,1997,34(2):79-84.
[21]LYE H S,RUSUL G,LIONG M T.Removal of cholesterol by lactobacilli via incorporation and conversion to coprostanol[J].J Dairy Sci,2010,93(4):1383-1392.
[22]王今雨,满朝新,杨相宜,等.植物乳杆菌NDC 75017的降胆固醇作用[J].食品科学,2013,34(3):243-247.
[23]NOH D O,KIM S H,GILLILAND S E.Incorporation of cholesterol into the cellular membrane ofLactobacillus acidophilusATCC 43121[J].J Dairy Sci,1997,80(12):3107-3113.
[24]刘长建,刘 秋,孙军德,等.雉鸡乳酸菌DCe13的分离及降胆固醇特性的研究[J].食品与发酵工业,2015,41(11):47-51.

