宁夏玉泉营地区酿酒葡萄酵母菌的分离筛选及分子鉴定
王志恒,冯翠娥,王 冲,罗 慧,邹 芳,刘雅琴*,魏玉清
(1.北方民族大学 生物科学与工程学院 发酵酿造工程生物技术国家民委重点实验室 宁夏葡萄与葡萄酒技术创新中心,宁夏 银川 750021;2.宁夏大学 生命科学学院,宁夏 银川 750021)
宁夏玉泉营位于贺兰山东麓、黄河岸边,隶属于我国著名的优质葡萄产区之一的贺兰山东麓葡萄产区,该产区与美国的纳帕谷葡萄酒产区以及法国的波尔多葡萄酒产区都处于同一纬度,是适合优质酿酒葡萄生长发育的北纬38°。20世纪80年代,玉泉营开始大面积种植鲜食和酿酒葡萄。经过三十多年的努力,现在玉泉营地区葡萄种植面积已达10万亩,是全区最大的酿酒葡萄种植基地。在此期间玉泉营葡萄获得国家“绿色食品”称号、自治区“三个十工程”的葡萄基地、国家八部委确定其为国家级农业产业化龙头企业、“贺兰山东麓葡萄酒原产地域”、国家首批的“工农业生态旅游示范点”等。现如今,玉泉营地区分布着巴格斯、西夏王等著名酒庄,是宁夏贺兰山东麓葡萄酒产区的中心地带,该地区的生态条件与世界著名的葡萄产地波尔多地区相比,也具有一定优势[1-3]。
酵母菌是使一些糖类物质进行降解的各种单细胞真菌,在目前的分类地位上酵母菌还没有一个规定的标准[4-9]。酵母菌在葡萄酒酿造过程中的作用十分重要[10],它不仅对于葡萄酒的酒精产量有决定性作用,也对葡萄酒的品质有着深刻影响[11]。酿酒大师在酿造葡萄酒时,为了发挥出葡萄的全部能量来提升葡萄酒的整体品质,会特别注重酿酒酵母菌的选择,优良品质的酵母菌是葡萄酒品质的必不可少条件之一[12]。目前我国的葡萄酒产业发展日新月异,但在葡萄酒酵母研究方面已经和葡萄酒产业规模的差距越拉越大,现如今国内大部分葡萄酒厂所使用的酵母菌大多是国外的商业酵母,此种酵母的大量使用会使葡萄酒酿造过程中本土酵母失去发酵主导地位,这样就会导致酿造出的葡萄酒风格单一,体现不出产区特色[13]。随着社会的发展,国人对于葡萄酒品质要求愈来愈高,同时葡萄酒的酿造技艺和风味深刻影响葡萄酒品质,因此精确分类酵母菌对于提高葡萄酒质量具有一定的研究价值[14]。
本研究对宁夏贺兰山东麓葡萄酒产区的核心地区——玉泉营中的酿酒葡萄进行菌株分离,使用WL培养基进行初步聚类分析,通过26S rDNA D1/D2序列分析进行菌株鉴定,确认分类地位,进而初步确定宁夏贺兰山东麓酿酒葡萄产区酵母菌的主要种类,为葡萄酒产区酵母菌的研究提供基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
从宁夏玉泉营葡萄园的土壤、成熟度好的酿酒葡萄浆果以及酿酒葡萄自然发酵的不同时期的自然发酵醪中分离酵母菌株。
1.1.2 化学试剂
酵母浸粉、蛋白胨、胰蛋白胨(均为生化试剂):北京奥博星生物技术有限责任公司;葡萄糖、磷酸二氢钾、氯化钾、氯化钙、硫酸镁、氯化铁、硫酸锰、溴甲酚绿(均为分析纯):天津大茂化学试剂厂。
1.1.3 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基[14]:葡萄糖20g/L,酵母浸粉10g/L,琼脂20g/L,蛋白胨20 g/L,自然pH,121℃高压蒸汽灭菌20 min左右。
WL营养琼脂培养基[15]:酵母浸粉4g/L,氯化铁0.0025g/L,胰蛋白胨5 g/L,硫酸镁0.125 g/L,葡萄糖5 g/L,琼脂20 g/L,氯化钙0.125g/L,硫酸锰0.002 g/L,磷酸二氢钾0.055 g/L,溴甲酚绿0.022 g/L,氯化钾0.425 g/L,pH值为6.5左右,121℃高压蒸汽灭菌20 min。
1.2 仪器与设备
APOLLO型PCR仪:美国伯乐公司;DYCP-31B琼脂糖凝胶电泳系统:北京六一仪器厂;SHP-250生化培养箱:上海森信试验仪器有限公司;酵母基因提取试剂盒:康为世纪生物科技公司;BIO-RAD凝胶成像系统:美国伯乐公司;JA5003B电子天平:上海精科天美科学仪器公司。
1.3 实验方法
1.3.1 菌株分离
(1)将采集好的成熟葡萄10粒,捣碎后置于0.9%无菌生理盐水中,完全振荡成菌悬液,将其梯度稀释涂布接种于YEPD固体培养基28℃培养24~72 h。
(2)采用五点取样法采集葡萄园土壤,将土壤置于0.9%无菌生理盐水中,完全振荡成菌悬液,将其梯度稀释涂布接种于YEPD固体培养基28℃培养12~72 h。
(3)选取成熟度较好的葡萄样品进行人工破碎,将破碎后的葡萄进行自然发酵。观察自然发酵过程,依次于葡萄自然发酵的前、中、后期取1 mL发酵液置于0.9%无菌生理盐水,完全振荡成菌悬液,将其梯度稀释涂布接种于YEPD固体培养基28℃培养24~72 h。
1.3.2 菌株WL培养基聚类分析
将保藏的酵母菌株使用YEPD液体培养基进行活化,振荡培养24~72 h,吸取0.1 mL培养完全的菌液于试管中,采用稀释涂布法接种于WL培养基上,28℃倒置培养72~144 h后,观察并记录菌落形态特征[15]。
1.3.3 菌株DNA提取
酵母菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取方法参照酵母基因提取试剂盒说明,提取后置于-20℃冰箱保藏备用。
1.3.4 PCR扩增与测序分析
聚合酶链反应(polymerase chain reaction,PCR)扩增所需引物参考刘爱国等[16]的实验方法,PCR扩增程序参考王国平等[14]的实验方法。然后将PCR结果通过琼脂糖凝胶电泳检测目标产物。最终将PCR产物交由昆泰锐(武汉)生物技术有限责任公司进行纯化和测序。将得到的7个序列进行校正后提交至美国国家生物技术信息中心(national centerofbiotechnologyinformation,NCBI),在GenBank核酸序列数据库中进行同源序列搜索(basiclocalalignmentsearch tool,BLAST),采用邻接法(neighbor-joining,NJ)模型进行进化树构建[14]。
2 结果与分析
2.1 菌种筛选与初步聚类分析
对分别从葡萄浆果、葡萄自然发酵的不同时期以及葡萄园土壤中初步分离出来的菌株进行YEPD固体培养基筛选,在自然发酵过程中分离酵母菌株共18株(前期10株、中期6株、后期2株),从葡萄园土壤中分离1株,从葡萄浆果分离3株,共分离出22株酵母菌株,部分酵母菌株的菌落形态见图1。由图1可知,菌株的菌落形态特征为表面光滑,不透明,菌落呈卵圆形。
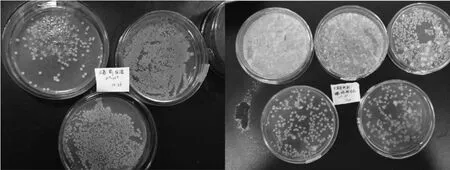
图1 部分分离酵母菌株的菌落形态Fig.1 Colonial morphology of some isolated yeast strains
将筛选出的酵母菌株在WL培养基上进行培养,分离酵母菌株所形成的菌落特征结果见表1。由表1可知,22株酵母菌株经过WL培养基的培养后,依据菌落颜色及形态特征可分为6种类型。
上述分离酵母菌株所形成的菌落特征与CAVAZZA A等[17-18]的研究结果进行对比,结果见图2。由图2可知,分离酵母菌株大致分为6个类型,菌落类型Ⅰ为克鲁维毕赤酵母(Pichiakluyveri);菌落类型Ⅱ为美极梅奇酵母(Metschnikowia pulcherrima);菌落类型Ⅲ为葡萄酒有孢汉生酵母(Hanseniaspora vineae);菌落类型Ⅳ为酿酒酵母(Saccharomyces cerevisiae);菌落类型Ⅴ为大隐球酵母(Cryptococcus magnus);菌落类型Ⅵ未能鉴定出。

表1 分离酵母菌株在WL培养基上的菌落形态Table 1 Colony morphology of isolated yeast strains on WL medium

图2 分离酵母菌株在WL培养基上的初步聚类分析结果Fig.2 Results of preliminary cluster analysis of isolated yeast strains on WL medium
2.2 酵母菌的分子生物学鉴定

图3 分离酵母菌株26S rDNA D1/D2序列扩增电泳结果Fig.3 Amplification electrophoresis results of 26S rDNA D1/D2 sequence of isolated yeast strains
依据分离酵母菌在WL培养基上的初步聚类分析结果,参考刘爱国等[16]的实验方法及各类型酵母菌株在培养时期的生长情况和菌落特征,从6种菌落类型中选出具有代表性的6株酵母菌(Q-02、Q-03、Z-01、H-01、T-01、Z-06)进行26S rDNA D1/D2序列扩增,菌株扩增后的电泳结果见图3。由图3可知,各菌株PCR扩增引物大小为500~700 bp。
将目标产物送往武汉昆泰锐生物技术有限责任公司进行测序。最后将测序结果在GenBank数据库中进行BLAST search[19]。得到菌株鉴定结果。
2.3 系统发育分析
对6株菌株的基因序列进行扩增,共获得6个序列。选择同源性匹配最高的菌株作为参照,下载序列文件,然后进行ClusterW序列多重比对,采用邻接法模型进行进化树构建,bootstrap method设为1000,构建结果见图4。

图4 6株供试菌株基于26S rDNA D1/D2区序列的系统发育树Fig.4 Phylogenetic tree of 6 tested strains based on 26S rDNA D1/D2 domain sequence
由图4可知,在系统发育树上,菌株Z-01与葡萄酒有孢汉生酵母(Hanseniaspora vineae)亲缘关系最近,序列的相似度为99.5%。菌株H-01与酿酒酵母(Saccharomyces cerevisiae)序列的相似度为99.6%,说明它们亲缘关系很近。菌株Q-02与克鲁维毕赤酵母(Pichia kluyveri)序列的相似度为100%,可以确定菌株Q-02是克鲁维毕赤酵母(Pichia kluyveri)。菌株Q-03与美极梅奇酵母(Metschnikowia pulcherrima)序列的相似度为99.9%。菌株T-01与大隐球酵母(Cryptococcus magnus)序列的相似度为100%,说明菌株T-01为大隐球酵母(Cryptococcus magnus)。菌株Z-06与东方伊萨酵母(Issatchenkia orientalis)序列的相似度为99.8%,说明它们的亲缘关系很近。
3 结论
本研究共分离筛选出酵母菌株22株,通过初步聚类分析,可将所分离到的酵母菌分为6种类型。依据分类结果,选出具有代表性的酵母菌株,结合26S rDNA D1/D2区序列分析,鉴定结果表明,6种酵母菌株依次为克鲁维毕赤酵母(Pichia kluyveri)、美极梅奇酵母(Metschnikowia pulcherrima)、葡萄酒有孢汉生酵母(Hanseniaspora vineae)、酿酒酵母(Saccharomyces cerevisiae)、大隐球酵母(Cryptococcus magnus)、东方伊萨酵母(Issatchenkia orientalis)。
本研究结果为宁夏贺兰山东麓葡萄酒产区酵母菌分离筛选奠定基础,有关该产区酵母菌的发酵特性及其进一步利用仍需继续研究。
[1]了一容.玉泉营的甜葡萄·贺兰山麓的葡萄酒[J].中国民族,2012(6):123-125.
[2]马永明.宁夏农垦葡萄产业发展战略研究[D].杨凌:西北农林科技大学,2011.
[3]马荣芳.宁夏农垦打造玉泉葡萄小镇——加快葡萄产业园区建设[J].中国农垦,2014(12):17-18.
[4]程 雷.葡萄自然发酵过程中酵母的分离鉴定及优良葡萄酒酵母筛选[D].哈尔滨:东北林业大学,2010.
[5]李银聪.自然发酵酸牦牛奶的微生物区系及其抗氧化活性研究[D].重庆:西南大学,2011.
[6]吕雪峰.发酵乳制品中酿酒酵母安全性评价的初步研究[D].长春:吉林农业大学,2013.
[7]商敬敏.蓬菜、德钦产地葡萄酒相关酵母的分离鉴定及其耐受性研究[D].济南:山东轻工业学院,2012.
[8]崔 艳,刘金福,等.非酿酒酵母在葡萄酒酿造中应用的研究现状[J].中国酿造,2010,29(11):13-16.
[9]徐建东.优势葡萄酒酵母菌的筛选及鲜食葡萄酿造甜性葡萄酒工艺的研究[D].石河子:石河子大学,2011.
[10]张春芝,江志国.微生物对葡萄酒香气的影响综述[J].中国酿造,2013,32(9):28-31.
[11]张 众,顾沛雯.葡萄酒病害相关酵母的分离与鉴定[J].中国酿造,2017,36(10):56-60.
[12]李双石,陈晶瑜,韩北忠.中国本土葡萄酒酵母种群多样性分布的研究进展[J].中国酿造,2011,30(12):4-8.
[13]NIKOLAOU E,SOUFLEROS E H,BOULOUMPASI E,et al.Selection of indigenousSaccharomyces cerevisiaestrains according to their oenological characteristics and vinification results[J].Food Microbiol,2006,23(2):205-211.
[14]王国平,宋育阳,裴颖芳,等.宁夏御马葡萄酒厂野生酵母菌株的分离筛选及分子鉴定[J].中国酿造,2009,28(8):38-41.
[15]薛军侠,徐艳文,杨 莹,等.WL培养基在酿酒酵母筛选中的应用[J].中国酿造,2007,26(9):36-39.
[16]刘爱国,刘延琳,王泽举,等.宁夏葡萄自然发酵过程中酵母菌的分子生物学鉴定[J].西北农林科技大学学报:自然科学版,2008,36(11):203-207.
[17]CAVAZZA A,GRANDO M S,ZINI C.Rilevazione della flora microbicadi most ievini[J].Vignevini,1992,9:17-20.
[18]PALLMANN C L,BROWN J A,OLINEKA T L,et al.Use of WL medium to profile native flora fermentations[J].Am J Enol Viticul,2001,52(3):198-203.
[19]王泽举,王汝瑱,孙 悦,等.几株酵母菌的分子系统学鉴定[J].食品科学,2012,33(15):195-200.

