不同方法制备大鼠宫内发育迟缓模型的比较
高琳琳,王 军,李子英,刘晓梅*
(1.中国医科大学附属盛京医院实验研究中心动物实验室,沈阳 110004;2.本溪市中心医院,辽宁 本溪 117022)
宫内发育迟缓(intrauterine growth retardation,IUGR)儿又称小于胎龄(small for gestational age,SGA)儿,是指出生体重低于同胎龄平均体重的第十个百分位或低于同胎龄平均体重的2个标准差的新生儿[1]。我国人群中IUGR的发生率平均为6.39%,IUGR不仅是围产儿的死亡和发病的重要原因之一,而且还会增加成年后心血管疾病、糖尿病、高血压等疾病的发生[2]。目前,IUGR动物模型有较多建立方法,包括酒精干预(alcohol intervention)法、子宫动脉结扎(uterine artery ligation)法、低蛋白饮食(low protein diet)法等;尽管制备模型的方法多样,但是没有公认建立IUGR模型的唯一标准[3]。
因此,稳定而简便地建立与人类临床病理特征相似的IUGR模型,对研究该疾病的发生机制、疾病的治疗方法具有十分重要的科学意义。本文着重介绍三种IUGR模型的造模方法比较及新生大鼠生长变化,进而探讨建立IUGR模型最适合的方法及对大鼠远期代谢的影响,为相关科学研究提供理论依据。
1 材料和方法
1.1 实验动物
SPF级Wistar大鼠33只,25只雌性,体重230~250 g,8只雄性,体重280~300 g,来源于辽宁长生生物技术有限公司 [SCXK (辽) 2015-0001]。动物饲养及实验操作于中国医科大学附属盛京医院实验动物中心 [SYXK (辽) 2017-0004],随机将雌雄比例为4∶1合笼过夜,次日做阴道涂片,在显微镜下检出精子则定为受孕第0天[4],每组为5只孕鼠,随机分为A、U、LP、CON四组,即酒精干预组、子宫动脉结扎组、低蛋白饮食组、正常对照(normal control)组。本实验符合伦理要求,伦理编号:2015PS41K。
1.2 主要试剂与仪器
95%乙醇,由盘锦天源药业有限公司生产,批准文号:辽卫药准字(1996)第004754号,生产批号:20160302;0.9%氯化钠注射液,由大连大冢制药有限公司生产,批准文号:国药准字H12020010,生产批号:16101138;水合氯醛,由国药集团化学试剂有限公司提供,生产批号:20160705。T系列电子天平,由美国双杰兄弟(集团)有限公司生产。
1.3 实验方法
1.3.1 各组IUGR模型制备
酒精干预组:正常饮食饮水(热卡约为1558 kJ/100 g、蛋白质约为23%),饲料由北京华阜康提供 [SCXK (京) 2014-008],于孕第7天开始,给予孕鼠自配50%的酒精进行灌胃处理 [0.9 mL/(100 g·d)][5]。
子宫动脉结扎组:正常饮食饮水于孕第17天以水合氯醛0.3 mL/kg的剂量进行麻醉,从腹中线的位置纵切,切口约为3~4 cm,暴露子宫,用温的生理盐水浸润纱布铺在子宫表面来维持子宫的温度及湿度,寻找子宫角动脉,结扎处平行放置一号钢针,同时结扎子宫动脉和钢针,后将钢针轻轻抽出,结扎单侧子宫动脉后关闭腹腔并用酒精进行消毒[6]。
低蛋白饮食组:于孕第0天给予低蛋白饮食(热卡约为1558 kJ/100 g、蛋白质约为8%),饲料由北京华阜康提供 [SCXK (京) 2014-008],每天给予低蛋白饲料[7],正常饮水。
正常对照组:于孕第0天给予正常饮食饮水。
1.3.2 取材
孕第20天时剖宫产取胎鼠,随机选取5组样本进行考察,并测量其身长、尾长、体质量、脑质量、胎盘质量、双肾质量、肝质量、肺质量;剩余部分胎鼠继续饲养分别于饲养后3周、6周、12周随机选取5只实验鼠,分别对其肝脏、双肾及肾周脂肪质量进行测量。
1.4 统计学方法

2 结果
2.1 实验组胎鼠成活率及IUGR发生率的比较
子宫动脉结扎组1只孕鼠死亡,其他实验组及对照组均无死亡。三组实验组胎鼠IUGR发生率明显高于对照组(P< 0.05),实验组胎鼠成活率明显低于对照组(P< 0.05),其中子宫动脉结扎组中胎鼠成活率低于其他两组。各组的孕鼠成活数、活胎数、死胎数、吸收胎、IUGR发生率等详见表1。
2.2 实验组胎鼠体质量、体长及脏器质量的变化
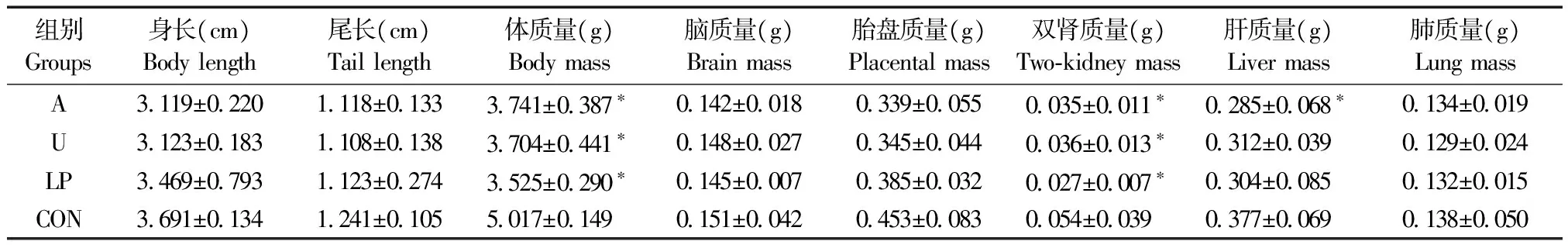
三组实验组胎鼠平均体质量分别为3.741 g、3.704 g、3.525 g,明显低于对照组胎鼠平均体质量5.017 g(P< 0.05),除脑质量外,实验组脏器质量均明显低于对照组脏器的平均质量;其中,子宫动脉结扎组与低蛋白饮食组肝脏的质量低于对照组肝脏的质量,但差异无显著性(P> 0.05)。各组胎鼠平均体质量、体长及脏器质量详见表2,图1、2。
2.3 实验组胎盘比重、胎鼠肝等脏器比重的变化
三组实验组的胎盘比重(胎盘质量与胎鼠体质量比)均低于对照组(P< 0.05),且酒精干预组低于低蛋白饮食组的胎盘比重;酒精干预组肝脏比重明显低于对照组肝脏比重(P< 0.05),子宫动脉结扎组和低蛋白饮食组肝脏比重低于对照组肝脏比重,但差异无显著性(P> 0.05)。各组胎鼠脏器比重详见表3、图3。
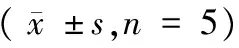
表1 各组孕鼠剖其胎鼠的情况
注:与对照组比较,*P< 0.05。
Note. Compared with the CON group,*P< 0.05.

注:A:各组剖宫产胎鼠生长情况;B:各组剖宫产胎鼠的体质量。A:酒精干预组;U:子宫动脉结扎组;LP:低蛋白饮食组;CON:正常对照组。与正常对照组比较,* P< 0.05。图1 各组剖宫产胎鼠生长及体质量情况Note. A: Growth of fetal rats delivered by cesarean section. B: Body mass of fetal rats delivered by cesarean section. A: Alcohol intervention group; U: Uterine artery ligation group; LP: Low protein diet group; CON: Normal control group. Compared with the CON group,*P< 0.05.Fig.1 Growth status and body mass of the fetal rats delivered by cesarean section in each group
组别Groups身长(cm)Bodylength尾长(cm)Taillength体质量(g)Bodymass脑质量(g)Brainmass胎盘质量(g)Placentalmass双肾质量(g)Two⁃kidneymass肝质量(g)Livermass肺质量(g)LungmassA3119±02201118±01333741±0387∗0142±00180339±00550035±0011∗0285±0068∗0134±0019U3123±01831108±01383704±0441∗0148±00270345±00440036±0013∗0312±00390129±0024LP3469±07931123±02743525±0290∗0145±00070385±00320027±0007∗0304±00850132±0015CON3691±01341241±01055017±01490151±00420453±00830054±00390377±00690138±0050
注:与对照组比较,*P< 0.05。
Note. Compared with the CON group,*P< 0.05.
注:A:剖宫产胎鼠脑质量;B:剖宫产胎鼠双肾质量;C:剖宫产胎鼠肝脏质量。A:酒精干预组;U:子宫动脉结扎组;LP:低蛋白饮食组;CON:正常对照组。与正常对照组比较,* P< 0.05。图2 各组剖宫产胎鼠的脑、双肾、肝脏质量Note. A: Brain mass. B: Two-kidney mass. C: Liver mass. A: Alcohol intervention group; U: Uterine artery ligation group; LP: Low protein diet group; CON: Normal control group. Compared with the CON group,* P< 0.05.Fig.2 Brain mass, two-kidney mass and liver mass of the fetal rats delivered by cesarean section in each group
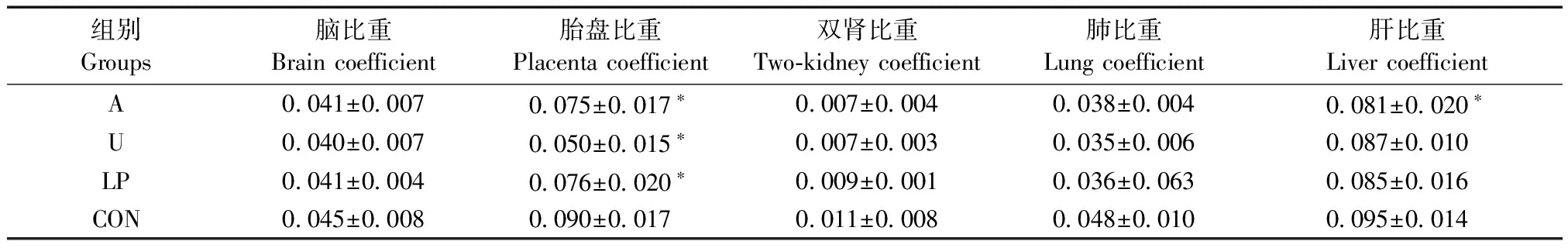
组别Groups脑比重Braincoefficient胎盘比重Placentacoefficient双肾比重Two⁃kidneycoefficient肺比重Lungcoefficient肝比重LivercoefficientA0041±00070075±0017∗0007±00040038±00040081±0020∗U0040±00070050±0015∗0007±00030035±00060087±0010LP0041±00040076±0020∗0009±00010036±00630085±0016CON0045±00080090±00170011±00080048±00100095±0014
注:与对照组比较,*P< 0.05。
Note. Compared with the CON group,*P< 0.05.
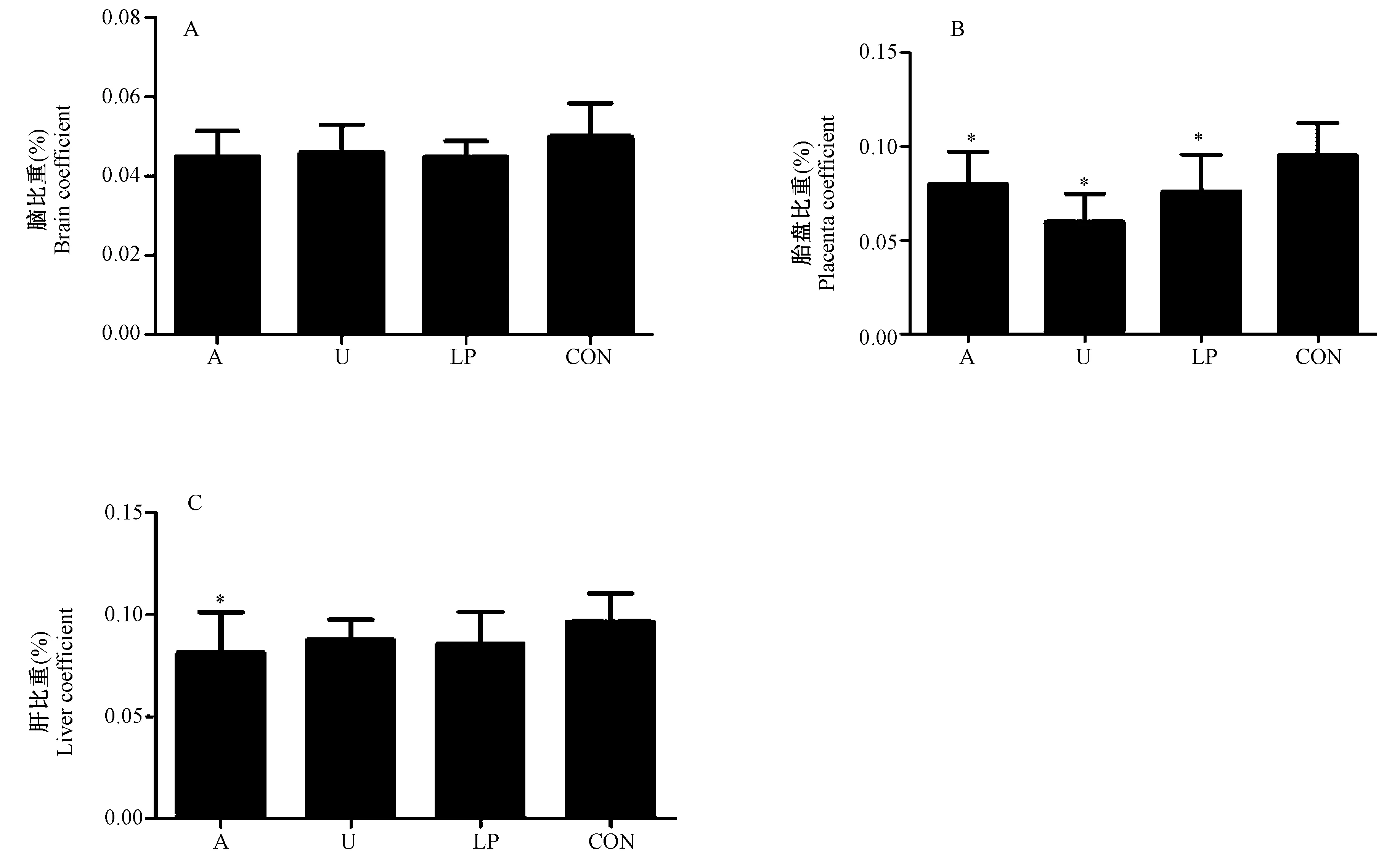
注:A:剖宫产胎鼠的脑比重;B:剖宫产胎鼠的胎盘比重;C:剖宫产胎鼠的肝比重。A:酒精干预组;U:子宫动脉结扎组;LP:低蛋白饮食组;CON:正常对照组。与正常对照组比较,* P< 0.05。图3 各组剖宫产胎鼠的脑、胎盘、肝脏比重Note. A: Brain coefficient. B: Placenta coefficient. C: Liver coefficient. A: Alcohol intervention group; U: Uterine artery ligation group; LP: Low protein diet group; CON: Normal control group. Compared with the CON group, *P< 0.05.Fig.3 Brain, placenta and liver coefficients of the fetal rats delivered by cesarean section in each group
2.4 实验组体质量的变化
大鼠饲养3周后,酒精干预组、子宫动脉结扎组、低蛋白饮食组三组大鼠平均体质量均明显低于对照组(P< 0.05);饲养6周后,实验组大鼠平均体质量仍低于对照组的水平,差异无显著性(P> 0.05);饲养12周后,酒精干预组、低蛋白饮食组两组实验组大鼠平均体质量明显高于对照组(P< 0.05)。各组大鼠平均体质量增长情况详见图4。
2.5 12周部分脏器及肾周脂肪质量的比较
三组实验组测量12周肝脏、双肾及肾周脂肪的质量,其中,三组实验组的肝脏、双肾脏质量均低于对照组,酒精干预组、低蛋白饮食组肾周脂肪质量明显高于对照组(P< 0.05),子宫动脉结扎组肾周脂肪质量高于对照组,但差异无显著性(P> 0.05)。各组肝脏、双肾、肾周脂肪质量详见图5。
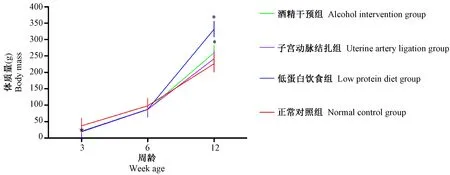
注:与正常对照组比较,* P< 0.05。图4 各组大鼠体质量变化Note. Compared with the CON group,* P< 0.05.Fig.4 Changes of body mass of the rats in each group
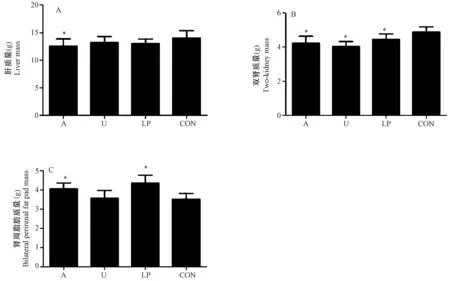
注:A:12周各组肝脏质量;B:12周各组双肾质量;C:各组肾周脂肪质量。A:酒精干预组;U:子宫动脉结扎组;LP:低蛋白饮食组;CON:正常对照组。与正常对照组比较,* P< 0.05。图5 12周时各组大鼠肝脏、双肾、肾周脂肪质量情况Note. A: Liver mass. B: Two-kidney mass. C: Perirenal fat pad mass. A: Alcohol intervention group; U: Uterine artery ligation group; LP: Low protein diet group; CON: Normal control group. Compared with the CON group,* P< 0.05.Fig.5 Liver, two-kidney and perirenal fat pad mass of the rats in each group at age of 12 weeks
3 讨论
宫内发育迟缓胎儿在子宫内会出现器官发育不良、窒息缺氧、宫内流产等现象,是造成围产儿死亡的重要原因之一。其远期影响是宫内发育迟缓儿在成年后发生代谢综合征(包括糖耐量减低、2型糖尿病)的易感性明显增加,与成年后的心血管病、肥胖、高血压等疾病的发生密切相关[8]。作为围产科学研究的热点问题,宫内发育迟缓发生的分子机制尚未阐明,目前认为可能与宫内不良发育造成的持续终生的胰岛素抵抗有关[9]。研究宫内发育迟缓的近远期并发症,必须建立稳定的研究模型。然而受伦理影响,人体实验无法实现,因此动物宫内发育迟缓模型具有无可替代的模拟价值。
酒精干预法能成功地建造大鼠宫内发育迟缓模型,本法最大的优点是能精准地掌握酒精用量及孕鼠的给予剂量(mL),缺点是酒精干预法的给予途径是灌胃,易刺激胃肠,易影响胎鼠的正常发育[10]。在此研究中,酒精干预法对胎鼠的肝脏发育影响最为明显[11],因此,酒精干预法在探讨制备IUGR模型对长期肝脏代谢变化中的影响值得进一步研究。
子宫动脉结扎法通过实验操作来减少胎鼠的血液供应,并以此影响胎鼠正常发育,此实验方法简易,但实验操作难度较高;结扎过紧会导致瞬间的血液供应中断,常引起胎鼠死于宫内而致流产率、死亡率上升。结扎过松则导致宫内发育迟缓模型的发生率下降[12]。在本文的三种模型制备方法中,子宫动脉结扎法存活胎鼠数最少,死亡率最高,IUGR发生率最低,这可能与手术中的麻醉和外科手术造成的失血有一定的关系。在此研究中,子宫动脉结扎法制备宫内发育迟缓模型对胎鼠脑部的影响较小,与正常对照组最为接近[13],该造模方法对研究脑部的影响不具有说服力,同时该造模方法在制备大鼠宫内发育迟缓模型时,对实验人员专业的外科技术要求较为严格,不具有普及性与推广性;而且,该实验组的体质量始终低于对照组,没有明显的生长追赶,12周肾周脂肪质量无明显增加[14]。因此,对于追赶性生长的相关研究也不适宜采取此类造模方法。
低蛋白饮食法是通过减少母鼠饮食中的蛋白质含量来减少供给胎鼠的蛋白质,从而限制了胎鼠的发育[15]。此方法对实验饲料配制、饲料中营养水平的控制、饲料饲喂时间的控制等要求严格。本实验采用北京华阜康公司的低蛋白饲料,成功构建了IUGR大鼠模型,此方法制备大鼠宫内发育迟缓模型成功率高,死亡率低,孕鼠接近自然状态,无刺激、无创伤,而且效果稳定,相比于其他方法具有不可替代的优势,12周时出现了明显的追赶性生长,肾周脂肪质量增长明显,对脂肪沉积及肥胖发生相关研究起着重要的作用。
通过上面三种建立IUGR的实验方法可知,酒精干预法、子宫动脉结扎法、低蛋白饮食法均可成功建立IUGR的实验动物模型;本实验三种模型建立方法,对脑质量的影响很小,说明大鼠本身具有脑保护效应[16];在本实验所涉及的实验方法中,子宫动脉结扎法IUGR发生率低,死亡率高,不是建立IUGR模型的首选,酒精干预法和低蛋白饮食法均可很好地建立IUGR模型,而且低蛋白饮食法较酒精干预法IUGR发生率高,死亡率更低,因此,低蛋白饮食法可作为建立IUGR模型的首选之一。本研究目前只是初步研究了各组模型中胎鼠的死亡率,胎鼠出生后的体质量、脏器质量,胎鼠到成年鼠的体重变化,并未深入研究追赶性生长这个危险因素,因此IUGR的远期代谢影响值得进一步研究。
[1] 万婷, 何援利, 潘石蕾. 建立胎儿生长受限大鼠动物模型的实验研究 [J]. 实用医学杂志, 2011, 27(12): 2133-2135.
[2] 朱秋凤, 张卫辉, 黄进, 等. 胎儿宫内发育迟缓胎盘形态学的研究进展 [J]. 畜牧与兽医, 2008, 40(6): 103-106.
[3] 李瑶. 宫内发育迟缓对胰腺β细胞发育和功能影响机制的研究进展 [J]. 国际儿科学杂志, 2011, 38(2): 124-126.
[4] 何秋明, 肖尚杰, 夏慧敏, 等. 大鼠阴道涂片的观察 [J]. 广州医学院学报, 2007, 35(4): 54-56.
[5] 刘彦慧, 刘振宅, 梁明辉. IUGR动物模型建立及宫内胚胎心电改变的研究 [J]. 齐齐哈尔医学院学报, 2005, 26(6): 614-615.
[6] Wigglesworth JS. Experimental growth retardation in the foetal rat [J]. J Pathol Bacteriol, 1964, 88: 1-13.
[7] Fernandez-Twinn DS, Ozanne SE, Ekizoglou S, et al. The maternal endocrine environment in the low-protein model of intra-uterine growth restriction [J]. Br J Nutr, 2003, 90(4): 815-822.
[8] Gluckman PD, Harding JE. The physiology and pathophysiology of intrauterine growth retardation [J]. Horm Res, 1997, 48 Suppl 1: 11-16.
[9] 程海霞, 孙丽霞, 薛萍. 低出生体质量早产儿宫外生长发育状况的探讨 [J]. 中国医药指南, 2016, 14(9): 180-181.
[10] Guo W, Gregg JR, Fonkalsrud EW. Effect of maternal ethanol intake on fetal rabbit gastrointestinal development [J]. J Pediatr Surg, 1994, 29(8): 1030-1033.
[11] 柳云恩, 姚宝玉, 杨冬华, 等. 不同周龄SD大鼠脏器重量及其变化趋势分析 [J]. 中国比较医学杂志, 2012, 22(1): 22-27.
[12] Phillips ID, Anthony RV, Simonetta G, et al. Restriction of fetal growth has a differential impact on fetal prolactin and prolactin receptor mRNA expression [J]. J Neuroendocrinol, 2001, 13(2): 175-181.
[13] 陈联辉, 梁黎. 宫内生长迟缓对生后脂代谢的影响及其机制 [J]. 国际儿科学杂志, 2014, 41(4): 347-350.
[14] 郭丽, 李超, 李淑媛, 等. 长期低剂量金雀异黄素导致雄性子代大鼠肥胖及其机制研究 [J]. 中国医药导报, 2017, 14(6): 12-14.
[15] 吴秋珏, 吕佳琪, 王恬. 营养不良对宫内胎儿发育迟缓动物模型影响的研究进展 [J]. 中国畜牧兽医, 2011, 38(2): 232-236.
[16] Moloney AM, Griffin RJ, Timmons S, et al. Defects in IGF-1 receptor, insulin receptor and IRS-1/2 in Alzheimer’s disease indicate possible resistance to IGF-1 and insulin signaling [J]. Neurobiol Aging, 2010, 31(2): 224-243.

