二苯乙烯苷对APP/PS1小鼠老年斑形成和炎症反应的影响①
黄蕊,杨翠翠,李林,张兰
首都医科大学宣武医院药物研究室,北京市神经药物工程研究中心,神经变性病教育部重点实验室,北京市100053
阿尔茨海默病(Alzheimer's disease,AD)是一种以认知功能障碍为主要临床表现的中枢神经系统退行性疾病,现已成为严重威胁老年人健康的四大疾病之一。其主要特征是β淀粉样蛋白(beta amyloid,Aβ)沉积和神经元纤维缠结(neurofibrillary tangles,NFTs)[1]。目前AD的发病机制尚未完全明确,包括氧化、压力和炎症等多个致病因素[2-3],但越来越多的证据表明,神经炎症是AD发病的一个重要因素。在AD发病过程中,炎症反应是神经元丢失的重要原因之一[4-6]。由于过量Aβ聚集和纤维化,小胶质细胞和星形胶质细胞被激活,炎症因子大量释放,诱发过度炎症反应,导致突触和神经元大量损伤和丢失[7]。
二苯乙烯苷(2,3,5,4'-tetrahydroxy-stilbene-2-O-β-D-glycoside,TSG)是中药何首乌的主要有效成分和标志成分,具有抗衰老、神经保护、降血脂以及抗动脉硬化等作用[8]。多奈哌齐是第二代高选择性乙酰胆碱酯酶抑制剂,主要用于治疗轻度和中度AD。课题组前期研究显示,TSG能够改善不同月龄APP转基因小鼠的学习记忆障碍[9],并能改善β淀粉样肽致痴呆模型小鼠的学习记忆,增强胆碱能神经功能[10]。本实验用APPswe/PS1dE9双转基因小鼠为动物模型,以多奈哌齐作为阳性对照药,探讨TSG对Aβ沉积以及胶质细胞过度活化的影响,从而进一步证实TSG对AD的潜在治疗作用。
1 材料与方法
1.1 实验动物
SPF级APP/PS1双转基因阳性小鼠64只及野生型(wild type,WT)小鼠32只,体质量30~35 g,购自南京大学模式动物所,许可证号SCXK(苏)2015-0001。小鼠分笼饲养于首都医科大学宣武医院实验动物室屏障环境,12 h光照,自由进食和进水,室温20~25℃,湿度50%~70%。
1.2 主要药品、试剂及仪器
TSG:本实验室从何首乌中提取,纯度85%,实验中采用干粉剂,溶解于蒸馏水,制成药液。多奈哌齐(国药准字H20050978,批号1502016):卫材(中国)药业有限公司。刚果红染液(货号MST-8013):上海迈新生物技术有限公司。胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)(货号ZA-0529)、一抗山羊血清(货号ZLI-9021)、一抗稀释液(货号ZLI-9030)、生物素标记的山羊抗兔IgG(货号ZB-2010)、辣根酶标记链酶卵白素(货号ZB-2404)、DAB显色试剂盒(货号ZLI-9018):北京中杉金桥生物技术有限公司。Aβ一抗(货号2454):美国CELL SIGNALINGTECHNOLOGY公司。离子钙结合蛋白1(ionized calcium binding adapter molecule 1,Iba1)一抗(货号 019-19741):日本WAKO公司。
BH-2光学显微镜:日本OLYMPUS公司。BS210S电子天平:北京赛多利斯天平有限公司。A78910100冰冻切片机:美国THERMO公司。新物体识别设备:本室自制。
1.3 动物分组及给药
64只5月龄APP/PS1小鼠,按随机数字表分为4组,每组16只。每天模型组予蒸馏水10 ml/kg灌胃;TSG低剂量组予TSG 0.05 g/kg灌胃;TSG高剂量组予TSG 0.1 g/kg灌胃;多奈哌齐组予多奈哌齐0.001 g/kg灌胃。
32只5月龄WT小鼠,按随机数字表分为两组,每组16只。每天正常对照组予蒸馏水10 ml/kg灌胃;TSG高剂量WT组予TSG 0.1 g/kg灌胃。
各组给药时长均为7个月,至小鼠12月龄。
1.4 新物体识别实验
给药结束后,各组行新物体识别实验。实验第1天,将小鼠放于475×350×200 mm塑料空盒中自由探索10 min。第2天,在盒子里放置两个相同物体,秒表记录小鼠10 min内对这两个物体的探索时间,小鼠鼻子靠近物体1 cm距离内视为对物体进行探索。第3天,将其中一个物体换成新物体,秒表记录小鼠在10 min内对新旧物体的探索时间。计算识别指数(discrimination index,DI)。

1.5 取材及检测
新物体识别实验后,小鼠以10%水合氯醛4 ml/kg腹腔注射麻醉,开胸,剪开心包膜,暴露心脏和主动脉弓。用7号钝头针头插入左心室至主动脉弓,剪开右心耳,灌注0.9%氯化钠注射液100 ml,待右心耳流出液无色透明时,用4%多聚甲醛(pH=7.4)100 ml灌注固定至小鼠四肢僵直。灌注2 h后开颅取脑,固定于后固定液中;1周后冰冻切片,冠状位,片厚30 μm,连续切片。脑片置PBST缓冲液中,4℃储存。
1.5.1 刚果红染色
每组3只,每只取3张皮质及海马脑组织切片,捞至载玻片上,晾干,滴加饱和刚果红染液染色10 min,滴加分化液约20 s,镜下控制,水洗5 min;苏木精浅染约10 s。梯度酒精脱水,二甲苯透明,中性树胶封片。应用Image J软件计数,以模型组斑块数为1进行标准化(各组数据/模型组均值)。
1.5.2 免疫组化染色
每组3只,每只取3张脑片,捞至载玻片上,晾干。枸橼酸缓冲液沸水煮10 min,PBS冲洗3次,每次5 min,3%H2O2室温孵育10 min;PBS冲洗3次,每次5 min,10%山羊血清(PBST稀释)室温孵育30 min。弃去血清,滴加一抗及稀释液,Aβ稀释度为1∶200,Iba1稀释度为1∶500,GFAP稀释度为1∶200,4℃过夜。次日37℃复温30 min,PBS冲洗3次,每次5 min,滴加生物素标记山羊抗兔IgG(PBST稀释,1∶100),37℃孵育2 h;PBS冲洗3次,每次5 min;滴加辣根过氧化物酶标记的链酶卵白素(PBST稀释,1∶100),37℃孵育1 h,PBS冲洗3次,每次5 min;DAB显色液显色,镜下控制,并用自来水终止显色。梯度酒精脱水,二甲苯透明,中性树胶封片。Aβ、Iba1和GFAP染色阳性面积用Image-pro Plus 6.0软件进行统计,以模型组面积为1,进行标准化(各组数据/模型组均值)。
1.6 统计学分析
数据采用SPSS 20.0软件进行统计分析。计量资料用(xˉ±σXˉ)表示,多组间样本比较应用单因素方差分析(One-way ANOVA)。显著性水平α=0.05。
2 结果
2.1 新物体识别实验
与正常对照组相比,模型组DI降低(P<0.05);与模型组相比,各治疗组DI均明显升高(P<0.01)。见表1。

表1 各组新物体识别实验DI比较
2.2 刚果红染色
与正常对照组相比,模型组皮层及海马均散在分布大量砖红色斑块(P<0.001),与AD疾病细胞外斑块沉积病理改变一致。与模型组相比,各治疗组脑内斑块沉积均有不同程度减少(P<0.05)。见图1~图4。
2.3 Aβ40/42
与正常对照组相比,模型组皮层及海马出现大量褐色团块状Aβ40/42沉积(P<0.001)。与模型组相比,各治疗组小鼠皮层及海马Aβ40/42沉积均有不同程度减少(P<0.05)。见图5~图8。
2.4 Iba-1和GFAP
正常对照组与TSG高剂量WT组海马小胶质细胞和星形胶质细胞形态正常且分布均匀,模型组海马染色呈现团块状分布(活化的小胶质细胞和星形胶质细胞),Iba-1和GFAP阳性面积显著增加(P<0.001)。与模型组相比,各治疗组海马部位Iba-1和GFAP阳性面积均有所减少(P<0.05)。见图9~图12。

图1 各组皮层淀粉样斑块沉积情况比较

图2 各组海马淀粉样斑块沉积情况比较

图3 各组皮层淀粉样斑块沉积(刚果红染色,20×)

图4 各组海马淀粉样斑块沉积(刚果红染色,20×)

图5 各组皮层Aβ40/42沉积情况比较

图6 各组海马Aβ40/42沉积情况比较

图7 各组皮层Aβ40/42沉积(免疫组化染色,20×)

图8 各组海马Aβ40/42沉积(免疫组化染色,20×)

图9 各组海马Iba-1表达情况比较

图10 各组海马GFAP表达情况比较
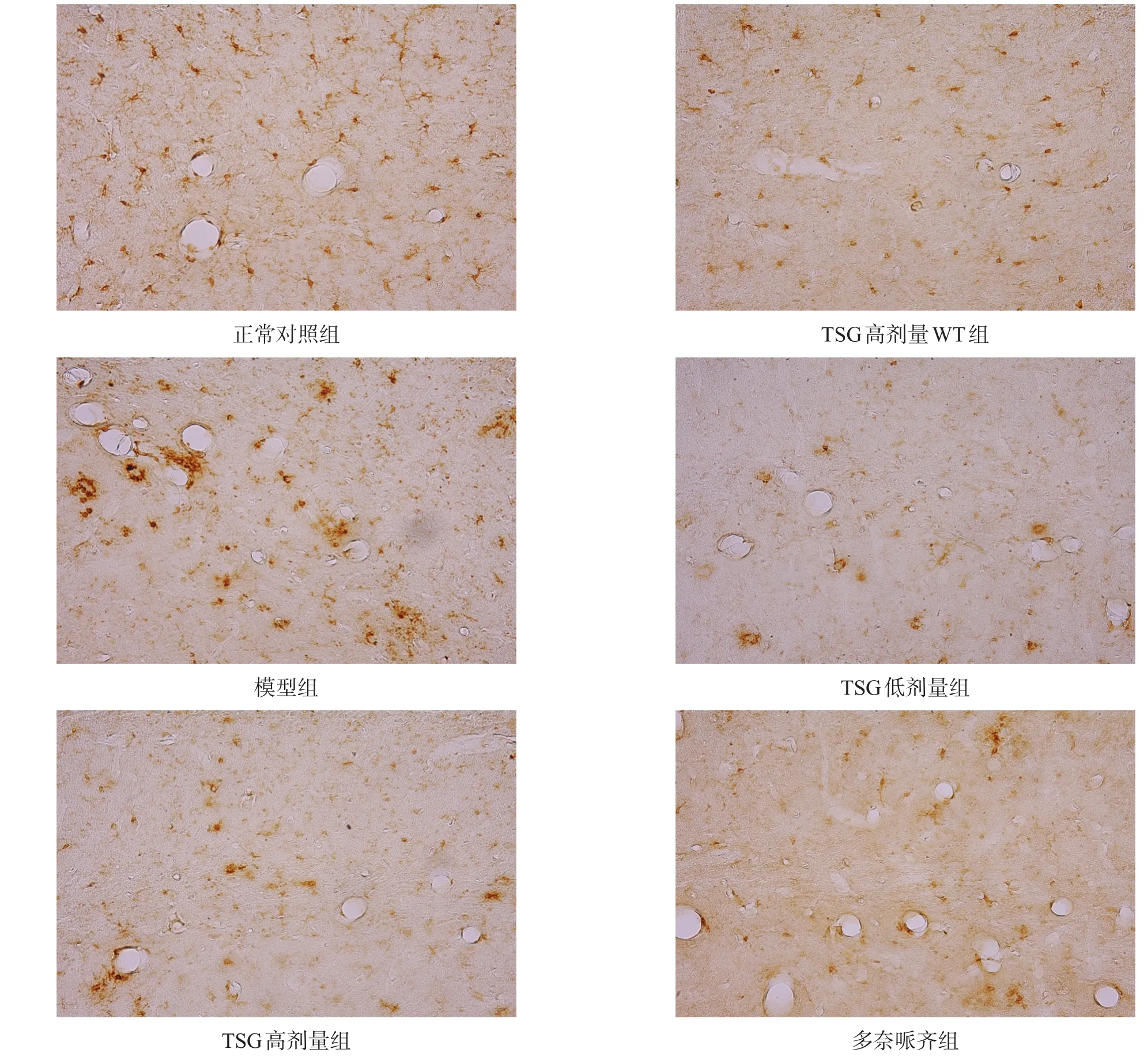
图11 各组海马Iba-1表达(免疫组化染色,40×)
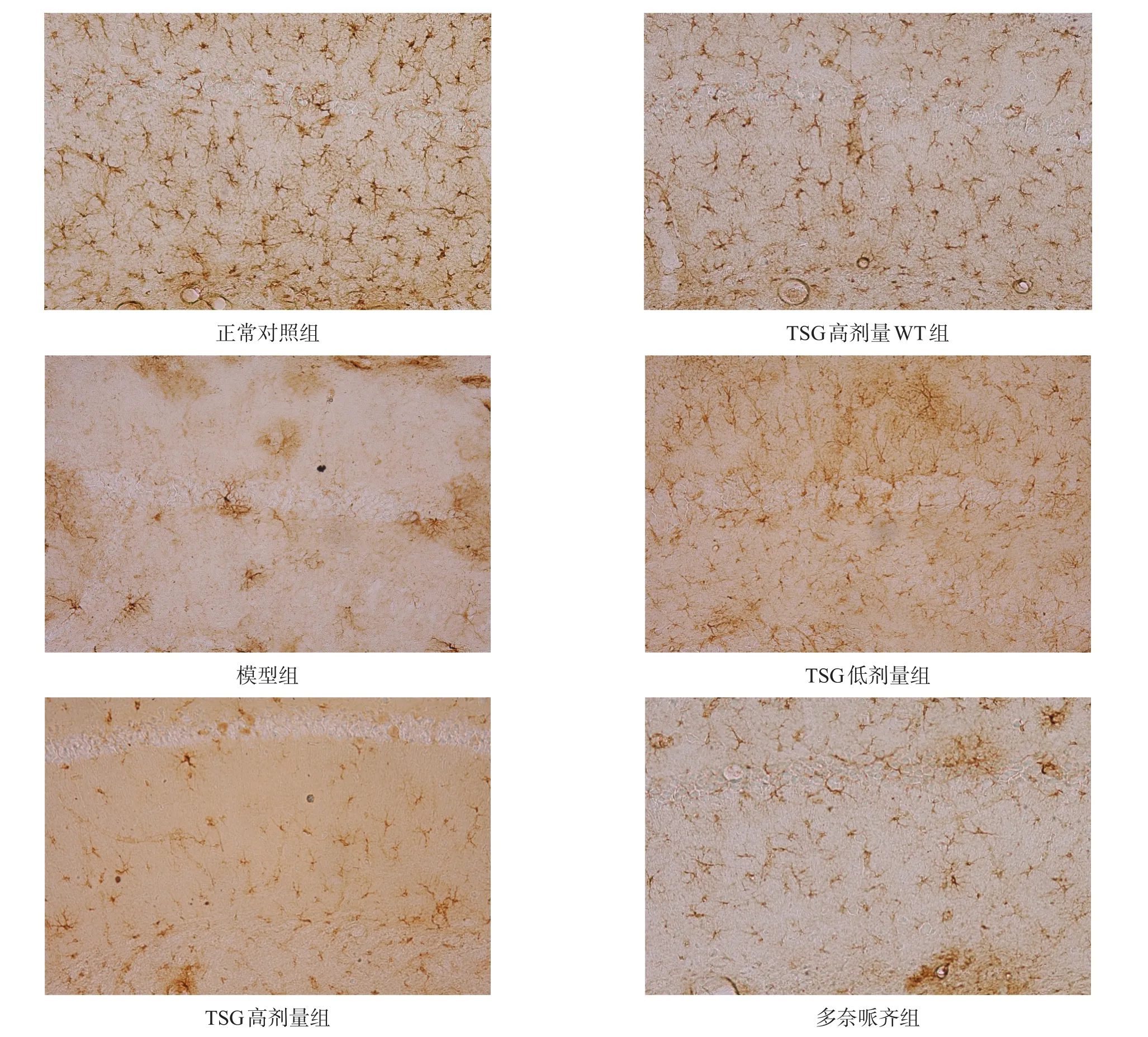
图12 各组海马GFAP表达(免疫组化染色,40×)
3 讨论
AD的病理生理机制非常复杂,AD脑内病变是一个慢性炎症的观点已被普遍接受。AD脑内慢性炎症反应涉及大量细胞和分子,包括与Aβ沉积和老年斑形成有关的小胶质细胞激活、反应性星形胶质细胞增生,以及炎性细胞因子的表达增加,同时激活细胞内信号转导途径[11-13]。小胶质细胞和星形胶质细胞是胶质细胞的主要类型,反应性胶质细胞与AD中斑块密切相关[14]。
刚果红染色能显示脑内淀粉样斑块沉积,是诊断淀粉样变性最简便易行的方法[15],也常应用于淀粉样蛋白示踪剂研究[16-17]。本研究显示,12月龄APP/PS1小鼠脑内已经出现大量老年斑;给予TSG后,老年斑数量有所减少;Aβ40/42也显示同样趋势。这印证了Aβ40/42是老年斑的主要成分[18]。Aβ经淀粉样前体蛋白水解产生,并可以被胰岛素降解酶、中性内肽酶等水解酶水解清除[19-20]。
在中枢神经系统中,小胶质细胞约占成年脑细胞的5%~10%[21]。正常生理状态下,小胶质细胞处于抑制免疫应答反应的状态;Aβ可作为始动因素激活小胶质细胞产生炎症反应,过度增殖和活化的小胶质细胞合成和释放大量炎症因子和过氧化物,加重炎症反应强度,最终导致细胞死亡[22-23]。
Iba1是小胶质细胞特异性表达,约17 kDa的钙结合蛋白,在活化的小胶质细胞中表达升高。本研究中12月龄模型小鼠脑内Iba1标记的小胶质细胞过度活化呈团块状,与文献中描述一致[24],而治疗组脑内小胶质细胞活化程度明显降低。
星形胶质细胞参与神经保护和神经组织损伤后修复过程,约占神经系统细胞总数35%[25]。与小胶质细胞一样,星形胶质细胞暴露于Aβ后释放炎症因子,加剧神经炎症反应。GFAP是星形胶质细胞的主要成分,可标记正常和活化的星形胶质细胞。本研究中12月龄模型小鼠脑内星形胶质细胞过度活化,治疗组星形胶质细胞活化程度明显降低。TSG对小胶质细胞和星形胶质细胞过度活化的抑制,说明TSG的显著抗炎作用。
综上所述,目前认为Aβ引起的神经炎性损伤是AD的重要发病机制之一,小胶质细胞和星形胶质细胞作为主要的免疫细胞参与炎症反应过程。通过7个月给予TSG,12月龄AD模型小鼠学习记忆能力改善,脑内老年斑以及组成老年斑的主要成分Aβ40/42减少,同时小胶质细胞和星形胶质细胞活化被抑制,推测TSG可能通过抑制APP/PS1双转基因小鼠脑内Aβ的形成,减少斑块沉积,进而抑制小胶质细胞活化和反应性星形胶质细胞增生,降低炎症反应,同时改善学习记忆。
本文通过免疫组化染色,直观呈现各组小鼠脑内Aβ40/42沉积、小胶质细胞以及星形胶质细胞的形态,将为进一步研究TSG的抗炎作用机制提供有意义的实验依据。TSG对于Aβ的减低是通过降低Aβ的生成还是增加Aβ的清除,TSG是否通过降低炎症因子发挥其抗炎作用,以上机制目前尚不明确,还需进一步深入研究。
[1]Zhang Y,Li P,Feng J,et al.Dysfunction of NMDA receptors in Alzheimer'sdisease[J].Neurol Sci,2016,37(7):1039-1047.
[2]Baldeiras I,Santana I,Proença MT,et al.Oxidative damage and progression to Alzheimer's disease in patients with mild cognitive impairment[J].JAlzheimers Dis,2010,21(4):1165-1177.
[3]Heneka MT,O'Banion MK.Inflammatory processes in Alzheimer's disease[J].JNeuroimmunol,2007,184(1-2):69-91.
[4]Birch AM,Katsouri L,Sastre M.Modulation of inflammation in transgenic models of Alzheimer's disease[J].J Neuroinflammation,2014,11:25.
[5]Huang Y,Mucke L.Alzheimer mechanisms and therapeutic strategies[J].Cell,2012,148(6):1204-1222.
[6]McNaull BB,Todd S,McGuinness B,et al.Inflammation and anti-inflammatory strategies for Alzheimer's disease-a mini-review[J].Gerontology,2010,56(1):3-14.
[7]Morales I,Guzman-Martinez L,Cerda-Troncoso C,et al.Neuroinflammation in the pathogenesis of Alzheimer's disease.A rational framework for the search of novel therapeutic approaches[J].Front Cell Neurosci,2014,8:112.
[8]Chen X,Tang K,Peng Y,et al.2,3,4',5-tetrahydroxystilbene-2-O-β-D glycoside attenuates atherosclerosis in apolipoprotein E-deficient mice:role of reverse cholesterol transport[J].Can JPhysiol Pharmacol,2018,96(1):8-17.
[9]Zhang L,Xing Y,Ye CF,et al.Learning-memory deficit with aging in APPtransgenic mice of Alzheimer's disease and intervention by using tetrahydroxystilbene glucoside[J].Behav Brain Res,2006,173(2):246-254.
[10]楚晋,叶翠飞,李林,等.二苯乙烯苷对β-淀粉样肽致痴呆模型小鼠行为及胆碱能功能的影响[J].基础医学与临床,2006,26(2):197-198.
[11]Zhang F,Jiang L.Neuroinflammation in Alzheimer's disease[J].Neuropsychiatr Dis Treat,2015,11:243-256.
[12]Hensley K.Neuroinflammation in Alzheimer's disease:mechanisms,pathologic consequences,and potential for therapeutic manipulation[J].JAlzheimers Dis,2010,21(1):1-14.
[13]Akiyama H,Barger S,Barnum S,et al.Inflammation and Alzheimer's disease[J].Neurobiol Aging,2000,21(3):383-421.
[14]Serrano-Pozo A,Mielke ML,Gómez-Isla T,et al.Reactiveglianot only associates with plaques but also parallels tangles in Alzheimer's disease[J].Am JPathol,2011,179(3):1373-1384.
[15]李玉莲,袁宏伟,徐晓艳.刚果红染色在临床病理诊断中的应用价值[J].山西医科大学学报,2014,45(7):661-662.
[16]Willander H,Askarieh G,Landreh M,et al.High-resolution structure of a BRICHOSdomain and its implications for anti-amyloid chaperone activity on lung surfactant protein C[J].Proc Natl Acad Sci U S A,2012,109(7):2325-2329.
[17]Eisenmenger LB,Huo EJ,Hoffman JM,et al.Advances in PET imaging of degenerative,cerebrovascular,and traumatic causes of dementia[J].Semin Nucl Med,2016,46(1):57-87.
[18]Zoltowska KM,Maesako M,Berezovska O.Interrelationship between changes in the amyloidβ42/40 ratio and presenilin 1 conformation[J].Mol Med,2016,5(22):329-337.
[19]Apelt J,Ach K,Schiebs R.Aging-related down-regulation of neprilysin:a putative beta-amyloid-degrading enzyme:in transgenic Tg2576 Alzheimer-like mouse brain is accompanied by an astroglialupregulation in the vicinity of beta-amyloid plaques[J].Neurosci Lett,2003,339(3):183-186.
[20]Wang J,Hiltunen M,Helisalmi S,et al.Inceased expression of Abeta degrading enzyme IDE in the cortex of transgenic mice with Alzheimer's disease-like neuropathology[J].Neurosci Lett,2008,438(2):216-220.
[21]Czeh M,Gressens P,Kaindl AM.The Yin and Yang of microglia[J].Dev Neurosci,2011,33(3-4):199-209.
[22]Harry GJ,Kraft AD.Microglia in the developing brain:a potential target with lifetime effects[J].Neurotoxicology,2012,33(2):191-206.
[23]Rubio-Perez JM,Morillas-Ruiz JM.A review:inflammatory process in Alzheimer's disease,role of cytokines[J].ScientificWorldJournal,2012:756357.
[24]Park TS,Ryu YK,Park HY,et al.Humulus japonicus inhibits the progression of Alzheimer's disease in a APP/PS1 transgenic mouse model[J].Int JMol Med,2017,39(1):21-30.
[25]Sherwood CC,Stimpson CD,Raghanti MA,et al.Evolution of increased glia-neuron ratios in the human frontal cortex[J].Proc Natl Acad Sci U SA,2006,103(37):13606-13611.

